肌酸对神经细胞硝化应激的保护作用
2019-07-11张婷张倩孙悦李巧彦田云云王铁鹏
张婷,张倩,孙悦,李巧彦,田云云,王铁鹏
(石河子大学医学院生物化学教研室/新疆地方与民族高发病教育部重点实验室, 新疆 石河子 832000)
神经退行性疾病(如阿尔兹海默氏症、帕金森氏症、亨廷顿舞蹈症、肌萎缩性侧索硬化症等)的发生与衰老相关,在全球老龄化程度不断加剧的背景下,神经退行性疾病的发病机制及干预措施的研究受到研究人员越来越多的重视[1]。尽管各种神经退行性疾病的发病原因不同,但在疾病后期神经元的退变过程中,都经历了相同的神经元死亡通路,即神经兴奋性毒性机制[2]。研究表明,高浓度的一氧化氮及其介导的硝化应激作用是介导神经兴奋性毒性作用的核心因素,抑制一氧化氮产生及硝化应激作用,神经兴奋性毒性作用几乎可以得到完全逆转[3]。
在干预神经兴奋性毒性的研究中,科研人员不断尝试着多种药物对神经毒性的保护作用。近年来,肌酸作为潜在的神经毒性保护药物,逐渐得到了人们的关注[1,4]。肌酸作为一种含有胍基的内源性化合物,与肌酸激酶一起构成了“肌酸和肌酸激酶能量穿梭机制(Creatine-Creatine kinase Shuttle)”,被认为是细胞维持能量代谢平衡的缓冲体系和重要保障[5]。在利用肌酸保护不同类型神经细胞凋亡模型的研究中,不同的研究小组分别阐述了肌酸通过发挥能量代谢调节以外的机制保护神经细胞的作用途径[6],如肌酸具有还原剂作用[7-9]、肌酸具有稳定线粒体通透性转换孔作用[10]、肌酸可以调节NMDAR(N-methyl-D-aspartic acid Receptor)受体功能等[11]。针对肌酸是否对于神经兴奋性毒性具有保护作用以及具体的保护机制的问题,由于各种研究报道使用的实验材料不同、模型的复杂程度各异,不同的研究报告之间存在着较大争议,甚至出现截然相反的报道[6]。同时,尽管硝化应激是诱发神经兴奋性毒性作用的核心因素[3],直接探讨肌酸对于神经细胞硝化应激调节作用的研究鲜见报道。因此,本研究采用性质均一的SH-SY5Y神经细胞系作为研究对象,以排除复杂因素干扰,并利用一氧化氮供体GSNO(S-Nitrosoglutathione)建立硝化应激条件,以期通过对单纯模型的研究揭示肌酸对于神经兴奋性毒性的保护作用及其机制。
1 材料与方法
1.1 材料
SH-SY5Y细胞购自中国医学科学院基础医学研究所细胞资源中心;DMEM(Dulbecco's Modified Eagle Medium)培养基、胎牛血清购自Invitrogen;氨苄青霉素、硫酸链霉素、MTT(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide)试剂、Hoechst33342染料、DNFB(2,4-Dinitrofluorobenzene)、肌酸、GSNO、α-tubulin抗体购自Sigma公司;AMPK(Adenosine 5'-monophosphate-activated protein kinase)及磷酸化AMPK抗体购自Cell Signaling Technology公司;ATP检测试剂盒购自Beyotime公司;BCA定量试剂盒及电泳相关试剂购自北京普利莱基因技术有限公司;其他试剂为国产分析纯。
1.2 方法
1.2.1 细胞培养及药物处理
5H-SY5Y细胞培养采用DMEM培养基,添加10%胎牛血清,完全培养基中添加抗生素防止污染(青霉素100 U/mL,链霉素100 μg/mL),细胞培养到贴壁密度为90%-95%左右,采用相应浓度一氧化氮供体GSNO处理至指定时间。GSNO置于-20 ℃保存,使用时需新鲜配制,采用DMEM完全培养基为溶剂制备不同浓度的GSNO细胞处理液。鉴定肌酸的保护作用时,先采用不同浓度的肌酸孵育SH-SY5Y细胞30 min,之后在含有肌酸的培养基中添加GSNO试剂处理,并进行后续实验指标的检测。
1.2.2 MTT法检测细胞活力
SH-SY5Y细胞接种在96孔细胞培养板中,药物处理后,添加10×MTT储液(采用DMEM培养基配制),使得MTT终浓度达到5 mg/mL。细胞继续在37 ℃培养箱中培养3 h,而后吸掉培养板中的培养基,每孔添加200 μL DMSO溶液,在摇床上摇动混匀10 min,以充分溶解紫色产物,空孔中添加200 μL DMSO作为对照。酶标仪上设定565 nm波长下测定吸光度,各组间通过吸光度指标比较细胞活力,以对照组吸光度值为标准做归一化处理。
1.2.3 Hoechst33342染色
待染色细胞利用PBS洗2次,以4%多聚甲醛室温固定细胞30 min,吸除固定液。采用终浓度为5 μg/mL的hoechst33342细胞染色液染色10 min,再用PBS溶液洗净非特异结合染料。培养皿中添加2 mL PBS,在倒置荧光显微镜下观察并拍照,染料激发波长为346 nm。
1.2.4 ATP含量检测
ATP浓度检测利用荧光素酶催化荧光素底物发光时需要消耗ATP,化学发光强度与ATP含量成正比的原理进行定量检测。细胞加药处理完毕后,使用PBS洗细胞2次,在4 ℃冰盒上,使用ATP检测试剂盒专用裂解液裂解细胞。裂解后采用4 ℃,12000 g离心5 min,取上清用于检测。将标准ATP溶液用ATP检测裂解液稀释成不同的浓度梯度,制作标准曲线。样品检测使用96孔化学发光板,每孔加入100 μL ATP检测辅助工作液,室温放置5分钟,之后加入10 μL待定量样品于检测孔中,间隔2 s后,采用Varioskan Flash多功能酶标仪测定化学发光数值。利用BCA蛋白定量试剂盒定量待检测样品的蛋白浓度,将各样品中ATP浓度换算成nmol/mg蛋白形式,并以对照组为标准做归一化处理。
1.2.5 Western blot检测
细胞处理完毕,除去培养基,使用PBS(Phosphate buffer saline)缓冲液洗细胞2次以除去培养基成分。利用RIPA细胞裂解液处理细胞,在4 ℃冰盒上裂解细胞15 min后采用BCA试剂盒定量裂解液蛋白浓度。单泳道上样蛋白约20 μg,采用10%浓度SDS-PAGE电泳胶分离蛋白,浓缩胶条件为80 V恒压,分离胶条件为120 V恒压。电泳完毕,利用湿转印记仪将蛋白转印到硝酸纤维素(Nitrocellulose,NC)膜上,湿转条件为恒压80 V,转印2 h。采用李春红S染色检测蛋白条带,并裁剪转印膜,之后将NC膜在含有5%脱脂奶粉的TBST缓冲液中室温封闭2 h,TBST液洗2次后,配制相应稀释度抗体4 ℃孵育过夜。次日,TBST液洗膜4次,每次5~10 min。稀释二抗在室温下孵育NC膜1 h,TBST溶液再次洗膜4次后,采用ECL化学发光试剂盒显影。通过FluoChem HD-2成像仪拍照,利用AlphaWiew软件扫描蛋白条带灰度。实验中以α-tubulin为上样内参,待测蛋白的比较采用目标蛋白/内参蛋白的灰度值做定量。
1.2.6 数据分析
2 结果
2.1 硝化应激对神经细胞活力的影响
使用不同浓度的GSNO处理SH-SY5Y细胞24 h后,利用MTT法检测神经细胞活力(图1A)。
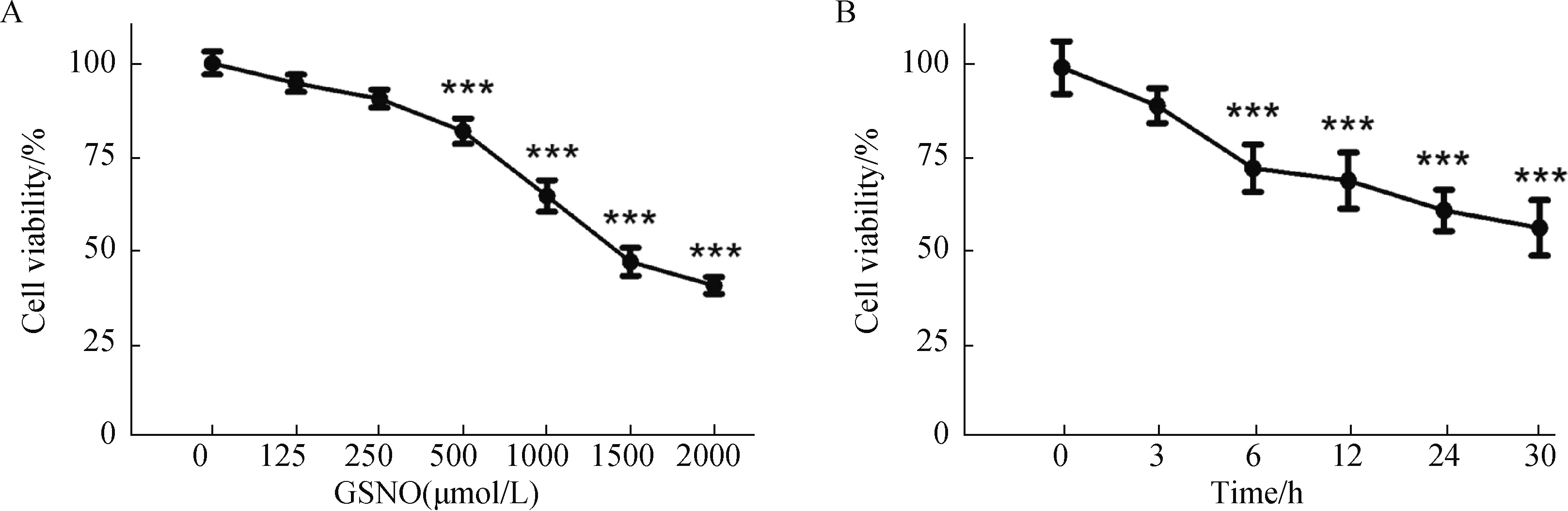
图1 GSNO处理SH-SY5Y细胞的剂量及时间效应Fig.1 The dose- and time-dependent effect of GSNO treatment on SH-SY5Y cell
结果(图1)显示,GSNO的细胞毒性表现为浓度依赖性递增,当其浓度增至500 μmol/L时,细胞活力减低为对照组活力的81.90%,与对照组相比出现显著性差异(P<0.001)。随着GSNO浓度进一步增加,细胞毒性表现得更加显著。GSNO的细胞毒性也表现为时间依赖性增加。采用1000 μmol/L GSNO处理SH-SY5Y细胞不同时间(图1B),6 h时细胞活力降低至对照组72.36%(P<0.001),与对照组出现显著差异;刺激时间延长到24 h时,细胞活力降低到对照组60.74%(P<0.001)。我们的前期实验结果表明,肌酸对于GSNO诱发硝化应激的保护作用,在细胞活力下降至60%左右时表现得最为明显,当细胞活力减低至40%以下,肌酸的保护作用不再显著。因而,在我们的研究中,最终确定以1000 μmol/L GSNO处理24 h为造模条件。
2.2 肌酸对硝化应激条件下神经细胞的保护作用
为确定肌酸的使用剂量,我们在1000 μmol/L GSNO刺激SH-SY5Y细胞24 h的硝化应条件下,采用不同浓度的肌酸预处理细胞30 min,验证其对神经细胞的保护作用(图2)。结果显示,GSNO处理使细胞活力降低至对照组57.93%;添加不同剂量肌酸后,其对于神经细胞的保护作用随着肌酸浓度的提升而不断增强。肌酸浓度达到2.5 μmol/L时,已经表现出显著的保护效应(P<0.05);浓度增加到5 μmol/L时,可将细胞活力提升至未刺激组的75.82%(P<0.001),保护效应最显著(图2)。由此,确定后续研究中采用5 μmol/L的肌酸保护剂浓度。
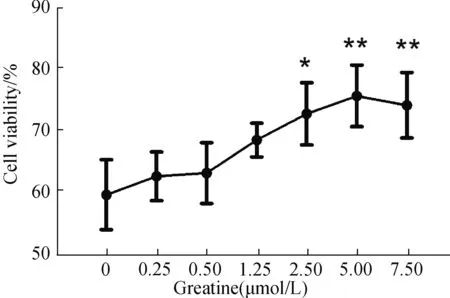
图2 肌酸保护神经细胞硝化应激的剂量效应Fig.2 The dose-dependent effect of creatine protection on neurocyte under nitrosative stress
2.3 肌酸通过肌酸激酶途径保护神经细胞硝化应激
肌酸是一种内源性能量代谢中间分子,细胞能量充裕时,在肌酸激酶的催化作用下,肌酸可接受ATP的高能磷酸键转换为磷酸肌酸,作为能量储备;当细胞处于能量应激状态时,肌酸激酶可催化磷酸肌酸释放高能磷酸键生成ATP,以维持细胞能量代谢平衡。因此,“肌酸和肌酸激酶能量穿梭机制(Creatine-Creatine kinase Shuttle)”被认为是细胞能量代谢平衡的重要缓冲体系[5]。为验证肌酸对于神经细胞硝化应激的保护作用是否通过“肌酸-肌酸激酶”的能量转换机制实现,我们采用肌酸激酶的特异性抑制剂DNFB处理细胞,以抑制肌酸激酶活力[12]。前期实验结果表明,采用5 μmol/L的DNFB处理细胞,并不影响SH-SY5Y活力(图3),但可以几乎完全抑制细胞内肌酸激酶活性。如图3所示,在GSNO引发的硝化应激条件下,SH-SY5Y细胞活力减低至对照组的57.27%(P<0.001);肌酸保护组可增强细胞活力至对照组78.82%(P<0.001),与无保护剂组相比差异显著。但是,当肌酸保护组中添加肌酸激酶抑制剂DNFB后,肌酸的保护作用被完全拮抗(图3)。研究结果表明,肌酸激酶的活性是肌酸发挥神经保护作用的必要条件。
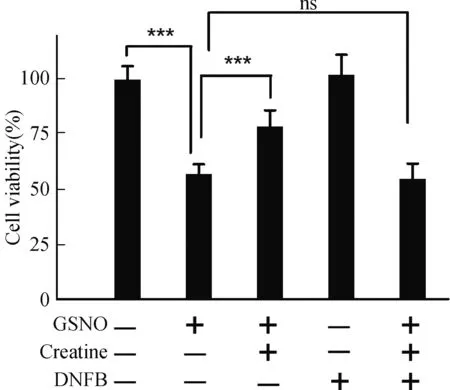
图3 肌酸通过肌酸激酶途径保护神经细胞Fig.3 Creatine protect neurocyte through creatine kinase pathway
2.4 肌酸对神经细胞形态的保护作用
肌酸对于神经细胞硝化应激的保护作用也体现在对细胞形态的影响上。对照组细胞(图4a,4e),可见光下形态饱满,hoechst33342细胞核染色时,细胞核着色均匀,荧光显微镜下部分细胞核正处于有丝分裂期(图4e)。GSNO处理24 h后(图4b,4f),细胞胞体皱缩、染色质凝集、DNA染色加深,表明细胞处于凋亡过程后期[13]。肌酸保护组可明显保护SH-SY5Y细胞形态,防止细胞核凝结(图4c,4 g);但添加肌酸激酶抑制剂DNFB(5 μmol/L)后,肌酸的保护作用消失(图4 d,4h)。
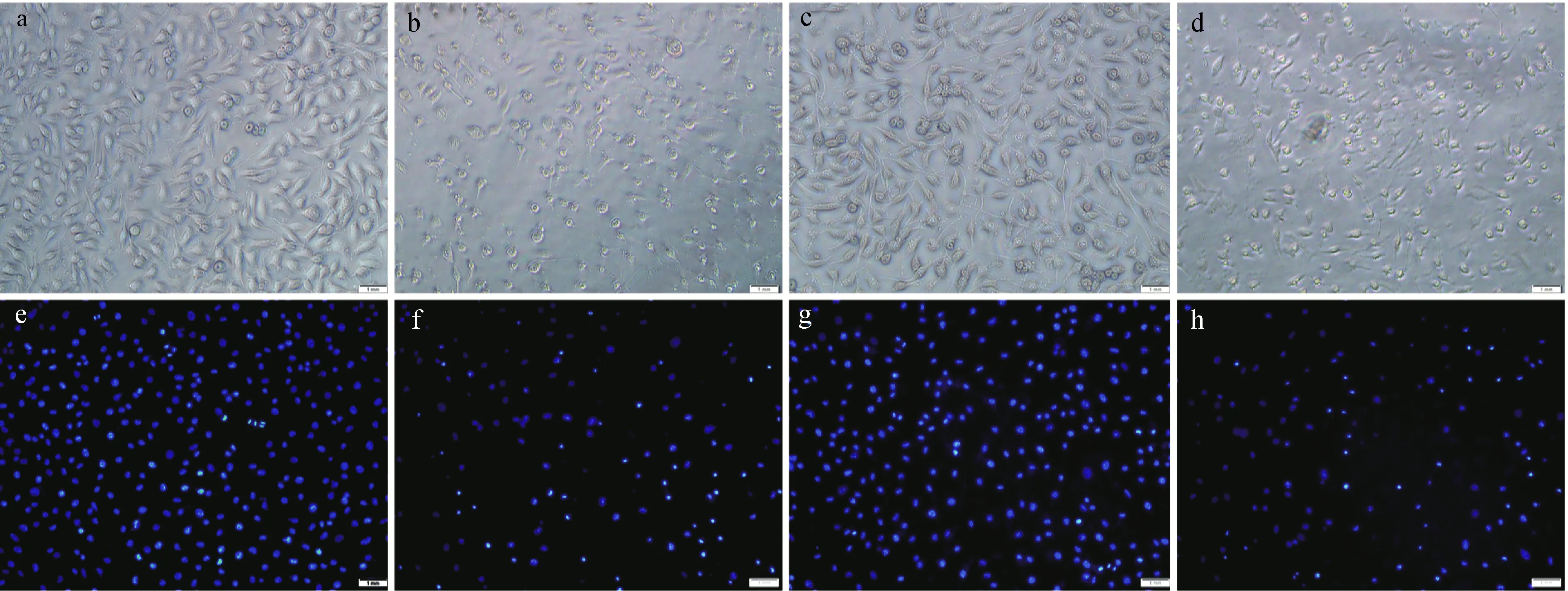
a,e:对照组细胞;b,f:GSNO处理组;c,g:肌酸干预组;d,h:肌酸+DNFB组图4 肌酸对神经细胞形态的保护作用Fig.4 The protective effect of creatine on neurocyte morphology
2.5 肌酸对硝化应激条件下ATP含量的影响
如果肌酸是通过“肌酸-肌酸激酶能量穿梭”机制对硝化应激条件下的神经细胞起到保护作用,那么,该保护作用应当在细胞内通过ATP含量指标直接表现出来。为此,我们利用基于化学发光方法的ATP定量试剂盒检测了肌酸处理前后的胞内ATP水平。前期实验结果显示,GSNO处理后,细胞内ATP含量在刺激后10~15 min区间测定值最低,表现为“能量应激”,之后ATP含量又随着时间逐渐增加,30 min左右其含量恢复到刺激前水平[13]。因此,实验中选择GSNO处理后10 min,作为检测胞内ATP含量的时间点。结果显示,对照组细胞具有较高的ATP基础含量,但1000 μmol/L GSNO处理10 min后,其ATP含量显著减低至对照组的78.91%(P<0.001)(图5)。硝化应激条件下,肌酸保护组可增加胞内ATP含量至对照组的90.34%,与无保护剂组相比差异显著(P<0.05),而肌酸对胞内ATP含量的提升作用可被DNFB(5 μmol/L)完全拮抗(图5)。
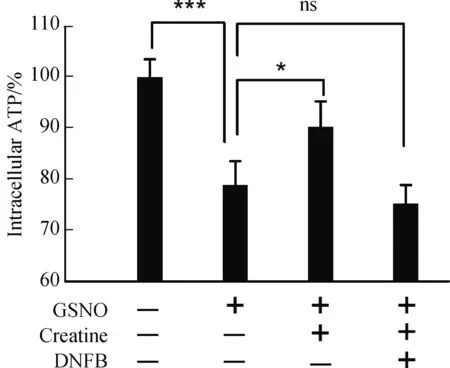
图5 肌酸对神经细胞内ATP含量的调节作用Fig.5 The modulation on intracellular ATP content of neurocyte by creatine
2.6 肌酸对AMPK的调节作用
肌酸对AMPK的调节作用作用见图6。
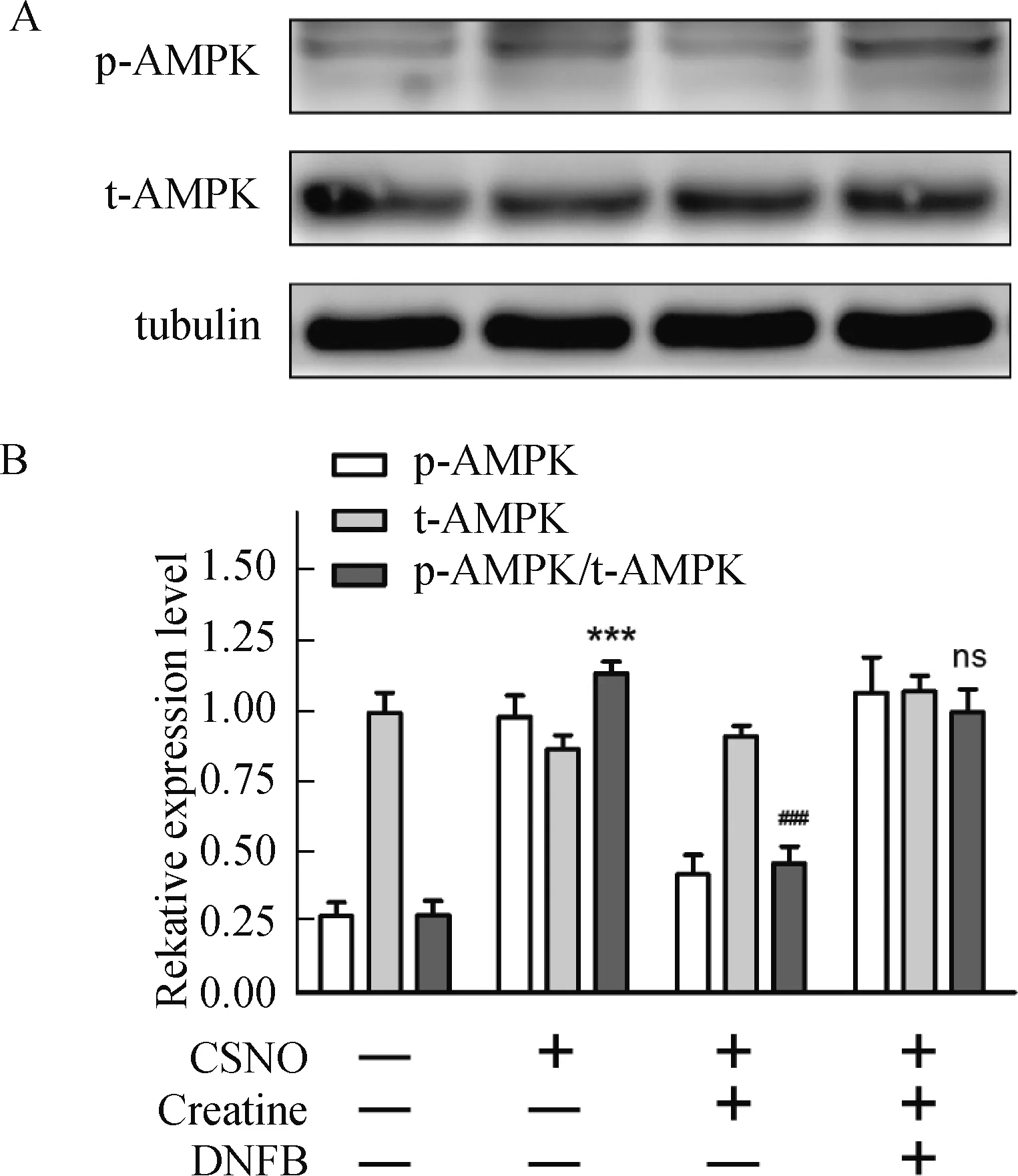
***,P<0.001,与对照组比较;###,P<0.001,与GSNO 处理组比较;ns,P>0.05,与GSNO处理组比较图6 肌酸对AMPK磷酸化的调节作用Fig.6 The modulatory role of creatine on AMPK phosphorylation
AMPK是细胞内最敏感的能量状态“感受器”,当细胞出现能量应激时,胞内AMP/ATP比值增加,此时AMPK会发生磷酸化激活,并通过激活下游的多条能量发生机制,促进细胞内的能量供给[14]。因此,AMPK的磷酸化水平是衡量细胞内ATP相对含量或体现细胞“荷能”状态的直接标志[14]。为确定肌酸对神经细胞硝化应激保护作用是否影响了细胞的能量代谢,即是否改变了细胞的荷能状态,我们检测了不同组别中AMPK的总含量(t-AMPK)及其磷酸化蛋白含量(p-AMPK),并采用AMPK磷酸化比率(p-AMPK/t-AMPK,灰度值比)的指标,表征细胞是否处于能量应激状态中[13]。研究结果显示,对照组细胞的AMPK基础磷酸化水平很低,AMPK磷酸化比率约为0.27;GSNO处理后AMPK的磷酸化水平急剧增加(图6),其AMPK磷酸化比率显著提高至1.13(与对照组相比差异显著,P<0.001);肌酸干预组则显著降低AMPK的磷酸化水平,使AMPK磷酸化比率下调至0.46(与GSNO处理组差异显著,P<0.001);但当肌酸干预组中添加了肌酸激酶抑制剂DNFB后,AMPK磷酸化比率回升至0.98,与GSNO处理组无显著差异(P>0.05)。
3 讨论
肌酸对神经退行性疾病以及对神经细胞凋亡的调节作用是近年来的研究热点之一[1,4-5]。肌酸是机体内源性化合物,水溶性好,且口服高剂量也不会对机体产生毒副作用,因而具有较好的潜在临床应用价值[15]。神经兴奋性毒性作用是由于一氧化氮及硝化应激引起的神经细胞死亡机制[3],尽管人们利用不同模型研究肌酸对于兴奋性毒性的调节作用,但结果和作用机制不尽相同,且直接将肌酸用于保护硝化应激的研究鲜有报道。
Valastro和Wills等小组的研究表明,在帕金森氏症模型中,肌酸干预效果显著[16-17];但Bender和Kieburtz等小组的独立研究分别报告肌酸在帕金森氏症模型中无效[18-19]。类似的,在肌萎缩型脊髓侧索硬化症[10-20]、亨廷顿舞蹈症[21-22]等研究体系中,使用肌酸作为神经系统保护剂,分别呈现出有效和无效的不同结果。
关于肌酸保护作用的机制也存在不同主张。Guidi和Fimognari等团队独立报道,肌酸本身具有抗氧化剂功能,可通过降低活性氧含量保护神经细胞[8,9];但Genius和Juravleva等研究组的研究表明,肌酸的加入非但没有降低氧化应激,相反增加了活性氧的产生[6,23]。Royes等还报道肌酸的神经保护作用体现在其对谷氨酸受体NMDAR的调控作用上[11], Klivenyi则主张肌酸的作用主要在于对线粒体“通透性转换孔”及线粒体膜电位的维持上[10],Cunha等则提出肌酸可以通过激活特殊的促细胞存活的信号通路实现保护作用[24]。
以上相关研究中出现的差异性报道表明,不同的实验体系复杂程度不同,实验模型存在较大差别,而且肌酸本身,的确可能通过多种作用机制对神经细胞毒性产生影响[6]。为避免过多复杂因素的干扰,我们利用NO供体GSNO处理SH-SY5Y细胞构建神经细胞硝化应激体系,模型简明直接,专注于兴奋性毒性作用中最重要的硝化应激机制[3],也降低了复杂实验模型(如动物模型、临床试验)中的不可控因素影响[6],方便阐明问题。实验数据显示,利用1000 μmol/L GSNO处理SH-SY5Y细胞,细胞活力显著下降到对照组64.65%左右(图1,图3),且通过GSNO处理的时间曲线确定24 h(细胞活力降低至60.74%)为较合适的刺激时间(图1)。研究结果表明,在上述刺激条件下,肌酸可以对神经细胞表现出较明显的保护作用(图3),而当GSNO浓度过高、处理时间过久,肌酸的保护作用则将难以体现。
部分文献报道表明,肌酸可能通过多种机制实现细胞保护作用,如肌酸作为抗氧化剂[8,9]、肌酸影响NMDAR受体[11]、肌酸调节线粒体通透性及膜电位等[10],本研究在单纯的硝化应激细胞模型中未能对上述机制加以验证。我们的结果显示,5 mmol/L肌酸处理能够显著提升硝化应激压力下的神经细胞活力(图2,图3),但当肌酸激酶活性被抑制后(DNFB处理),肌酸的保护作用几乎完全消失(图3),肌酸对神经细胞形态的保护作用也表现出一致性的结果(图4)。上述发现提示,在我们的模型条件下,肌酸的神经保护作用可能主要是通过肌酸激酶催化,提高了胞内磷酸肌酸的荷载,使细胞处于高荷能状态,能够抵御硝化应激下的能量排空损伤实现的。如果肌酸激酶失去活性,肌酸的保护作用便完全无法发挥(图3),因此,在简单的硝化应激细胞模型中,肌酸主要是通过能量缓冲作用保护神经细胞,而文献报道中提到的其他肌酸保护机制可能不是其在本模型下的优势作用途径。
进一步,我们检测了细胞内的直接能量供体ATP的含量。结果显示,硝化应激条件下肌酸预处理组细胞内的ATP含量显著高于非肌酸干预组(图5)。另外,通过检测细胞内的能量指标“传感器”AMPK的磷酸化水平,也表明肌酸干预组的确显著抑制了AMPK的磷酸化(图6),表明肌酸处理有效保护了硝化应激条件下的细胞能量供给。
综上所述,在一氧化氮供体引发的神经细胞硝化应激条件下,肌酸能够有效保护神经细胞活力,其保护机制主要是通过肌酸激酶机制提高神经细胞能量荷载以抵御能量应激来实现的。值得注意的是,在不同的神经兴奋性毒性模型中报道的肌酸作用机制存在差异,这可能与具体模型中的“复杂”影响因素相关。例如,当机体衰老导致肌酸激酶活性降低[25],或者当模型中的肌酸激酶氧化失活时[6],肌酸的保护作用无法通过能量保护机制发挥,此时肌酸的其他保护机制可能会得以凸显。因而,在研究肌酸的神经保护作用中,把各种简单实验模型直观明了的优点与复杂研究体系整合多种机制的优势相结合,将大大促进人们对肌酸作用机制的认识,并能促进肌酸的临床转化与应用。
