猕猴桃皮中6种多酚类化合物的HPLC检测法建立
2019-07-10刘晓燕马立志周笑犁
刘晓燕,尚 霞,马立志,周笑犁
(贵阳学院食品与制药工程学院,贵州省果品加工技术研究中心,贵州贵阳 550005)
我国猕猴桃资源丰富、种类繁多,近年来其种植面积和产量都在不断递增[1]。猕猴桃皮是猕猴桃加工产业中的废料,猕猴桃在加工过程约中有20%~30%的物质以皮渣的形式被丢弃,而猕猴桃果皮中含有丰富的多酚类化合物,其含量远高于果肉[2]。
多酚是具有苯环并结合多个羟基化学结构的物质总称,包括黄酮类、单宁类、酚酸类以及花色苷类等[3]。多酚作为一类具有生物活性的天然化合物越来越受到人们的重视,其主要具有清除自由基、预防心脑血管病、抗癌、美容、抗衰老等作用,对便秘、溃疡有一定的防治作用[4-10]。植物多酚广泛存在于植物体内,许多水果都含有一定量的多酚物质。水果中多酚物质的组成十分复杂,各种多酚物质在不同种水果中的分布与含量存在着很大差异[11]。
目前酚类化合物含量的测定方法主要有Folin-Ciocalteau法、HPLC、气相色谱法、LC-MS分析等,其中HPLC是测定多酚类化合物含量的常用方法[12-16]。张春梅等[17]建立了HPLC同时测定槟榔花中9种多酚类化合物的方法;邓佩欣等[18]建立了同时测定石榴皮中4种多酚含量的HPLC法;邓俊琳等[19]建立了同时检测油橄榄鲜果中6种多酚化合物含量的HPLC法。目前利用HPLC检测猕猴桃多酚的研究甚少,本研究也旨在建立一种HPLC同时分离多酚的方法,为今后猕猴桃皮多酚的研究提供一定的参考依据。
1 材料和方法
1.1 材料与仪器
猕猴桃 陕西省周至县,果实放软清洗后剥皮备用;根皮苷标准品、绿原酸标准品、表儿茶素标准品、原儿茶酸标准品 均为HPLC级,纯度≥99%,合肥博美生物科技有限责任公司;咖啡酸标准品、4-香豆酸标准品(纯度≥99%) 均为分析标准品,上海阿拉丁生化科技股份有限公司;甲醇为色谱醇 美国Tedia公司;乙醇、磷酸、盐酸、磷酸二氢钾等试剂 均为分析纯,天津市富宇精细化工有限公司;AB-8大孔吸附树脂 一级级别,天津市光复精细化工研究所。
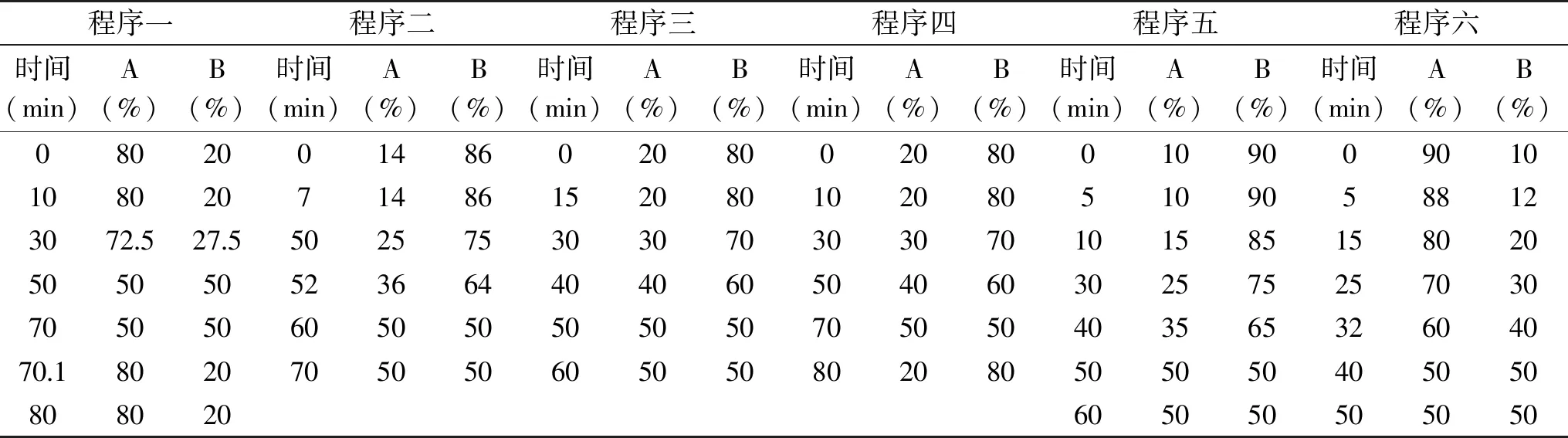
表1 梯度洗脱程序Table 1 Gradient elution program
LC-15C高效液相色谱仪、UV-2770型紫外可见分光光度计、AUW-120D 电子天平 日本岛津公司;RE-52A旋转蒸发器 上海亚荣生化仪器有限公司;HJ-200-SD喷雾干燥机 重庆荣凯机械;FDL-5200D超声波清洗器 江苏省昆仑山仪器有限公司。
1.2 实验方法
1.2.1 对照品溶液制备 分别精确称取各对照品:表儿茶素0.0030 g、绿原酸0.0044 g、根皮苷0.0051 g、原儿茶酸0.0055 g、咖啡酸0.0045 g、4-香豆酸0.0082g,加入60%甲醇,超声溶解并定容得到浓度分别为0.30、0.44、0.51、0.22、0.45、0.82 mg/mL各标准储备液,4 ℃保存备用。使用前适当稀释,经0.45 μm微孔滤膜过滤进样。
1.2.2 猕猴桃果皮多酚溶液制备
1.2.2.1 猴桃果皮多酚的提取 取猕猴桃果皮,55 ℃热风干燥12 h至恒重,使用高速多功能粉碎机粉碎过40目筛备用。采用乙醇提取法:温度60 ℃、时间60 min、液料比1∶10 mL/g,乙醇浓度70%。重复提取2次,合并滤液后在60 ℃下旋转蒸发浓缩至浸膏。再经大孔吸附树脂纯化(上样流速1.0 mL/min,洗脱剂为70%的乙醇,洗脱流速1.0 mL/min),收集洗脱液减压浓缩,喷雾干燥(65 ℃)后即得猕猴桃果皮多酚粉末备用。
1.2.2.2 猕猴桃果皮多酚溶液配制 精确称取制备好的猕猴桃果皮多酚粉末(0.100±0.005) g,加入60%甲醇,超声溶解定容得浓度为10 mg/mL的猴桃果皮多酚溶液,4 ℃保存。进样前经0.45 μm微孔滤膜过滤。
1.2.3 色谱条件
1.2.3.1 检测波长的选择 用紫外分光光度计对各对照品进行扫描,结果显示扫描波长范围为200~400 nm,在此范围内选取4个波长:260、270、280 nm,在各个波长下进样,根据基线稳定性和目标组分分离度确定最佳波长。
1.2.3.2 梯度洗脱程序的选择 设置六种不同的梯度洗脱程序进样,对6种多酚化合物进行分离,确定最适合的梯度洗脱程序。
1.2.3.3 柱温的选择 选取4个常用温度:25、30、40、45 ℃,在各个温度下分别进样,根据目标组分分离度确定最佳色谱柱温度。
1.2.3.4 进样量的确定 选取5、10、15 μL进样,确定最佳进样体积。
1.2.3.5 最佳色谱条件 色谱柱:InertSustain C18(4.6 mm×250 mm,5 μm),流动相:10 mmoL/L的KH2PO4水溶液(pH2.0)(A)-甲醇(B),流速1 mL/min,柱温、进样量、检测波长、梯度洗脱程序为1.2.3的优选条件。
1.2.4 方法学的考察
1.2.4.1 方法的回归方程 将6种对照品储备液按适宜的浓度梯度进行稀释(至少五个梯度),在1.2.3.5色谱条件下对各对照品设置的至少五个梯度浓度分别进样三次,记录每次测定结果的峰面积,并求出三次峰面积的平均值作为纵坐标,再以对应浓度为横坐标绘出各标准品的线性关系图,建立线性回归方程。
1.2.4.2 精密度实验 将6种对照品按1.2.3.5色谱条件分别连续进样6次,计算出各色谱峰峰面积的RSD值,考察精密度。
1.2.4.3 重复性实验 平行称取猕猴桃皮样品5份,在1.2.2的方法下制备猕猴桃果皮多酚溶液,在1.2.3.5色谱条件分五次进样分析,以5次进样测出的结果计算各自色谱峰峰面积的RSD值,考察重复性。
1.2.4.4 稳定性实验 将猕猴桃果皮多酚溶液在提取后的0、2、4、6、8、10、12 h时分别按1.2.3.5色谱条件进样分析,再计算出各色谱峰峰面积的RSD值,考察稳定性。
1.2.4.5 加样回收率实验 平行称取已知各多酚类化合物含量的猕猴桃皮粉末6份,一份空白,另5份分别加入6种对照品适量,在1.2.2方法下制备猕猴桃果皮多酚溶液,按1.2.3.5色谱条件进样测定,以5次进样测定的结果计算回收率平均值。
1.2.5 含量测定 按照1.2.2的方法制备猕猴桃果皮多酚溶液3份,按1.2.3.5色谱条件下进样分析,根据峰面积计算出猕猴桃果皮多酚中的原儿茶酸、绿原酸、咖啡酸、表儿茶素、4-香豆酸和根皮苷6种多酚类化合物的含量。
1.3 数据处理
实验重复3次,数据计算均在Microsoft Excel 2013中完成。
2 结果与分析
2.1 液相色谱条件的优化
2.1.1 检测波长 通过各波长下色谱图的对比分析(图1~图3),结果表明当检测波长为280 nm时,基线较平稳且各目标峰之间分离更明显,故选取280 nm为检测波长。
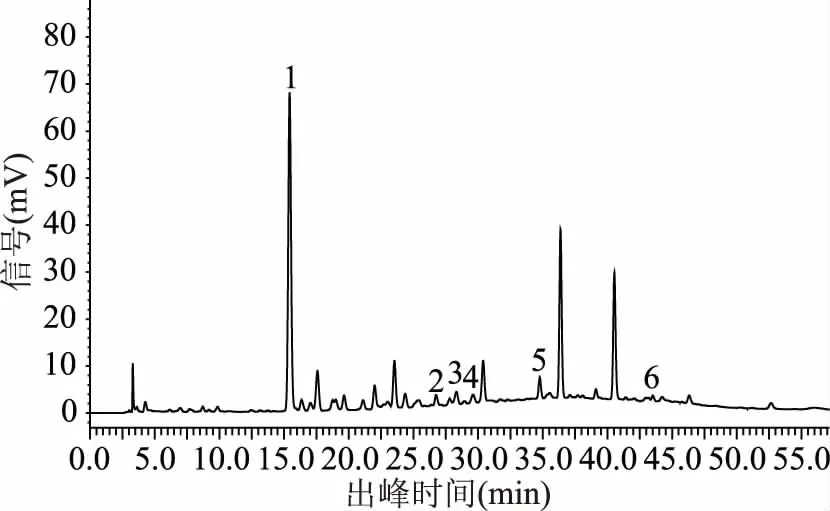
图1 样品图(波长260nm)Fig.1 Sample diagram(wavelength 260 nm)注:1、原儿茶酸 2、绿原酸 3、咖啡酸 4、表儿茶素 5、 4-香豆酸 6、根皮苷,图2~图19同。
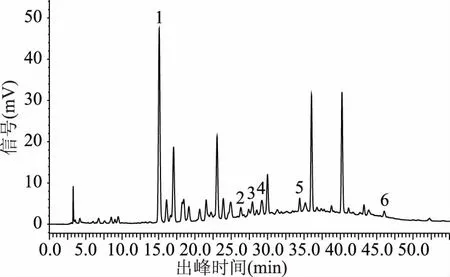
图2 样品图(波长270nm)Fig.2 Sample diagram(wavelength 270 nm)
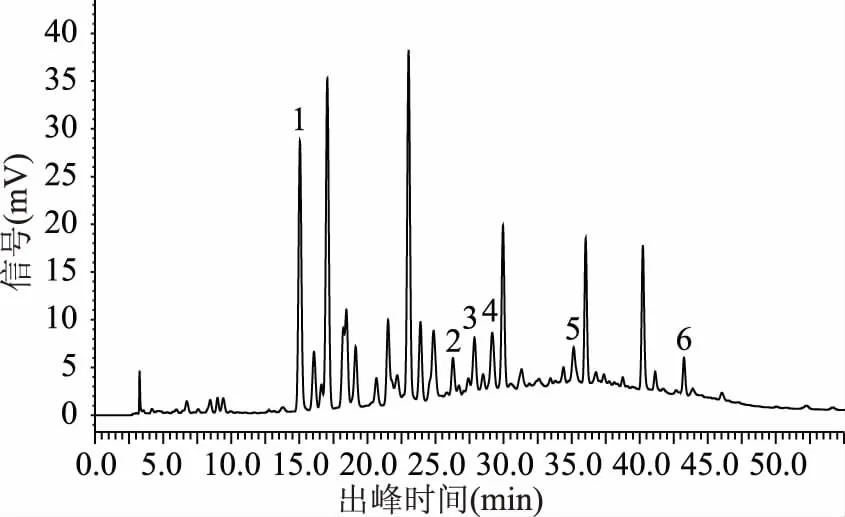
图3 样品图(波长280nm)Fig.3 Sample diagram(wavelength 280 nm)
2.1.2 梯度洗脱程序 通过对各个梯度洗脱程序下色谱图的对比分析(图4~图9),结果显示,最合适的梯度洗脱程序为程序六,在此梯度洗脱程序下猕猴桃果皮多酚中各目标组分能在50 min内得到良好的分离(见图10)。
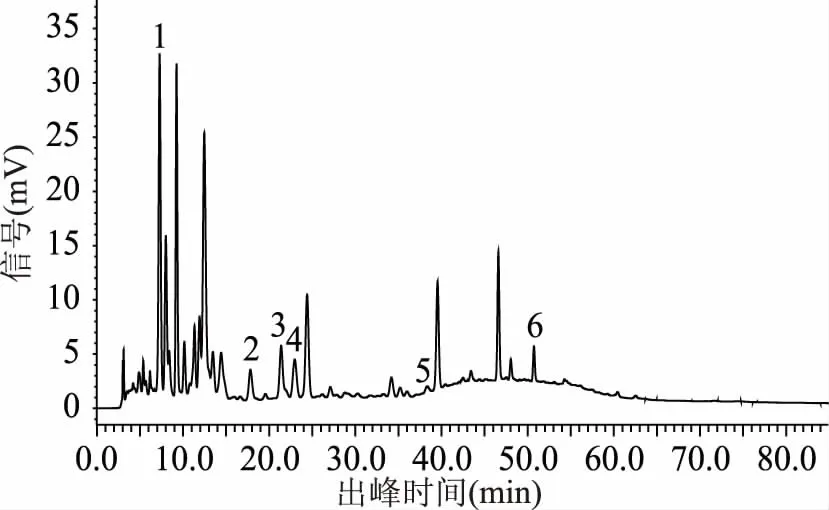
图4 样品图(梯度洗脱程序一)Fig.4 Sample diagram(gradient elution program 1)
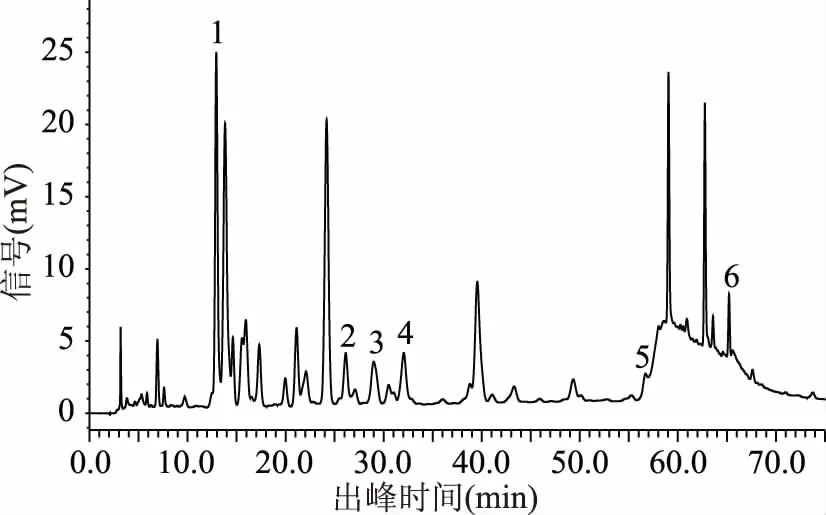
图5 样品图(梯度洗脱条件二)Fig.5 Sample diagram(gradient elution program 2)
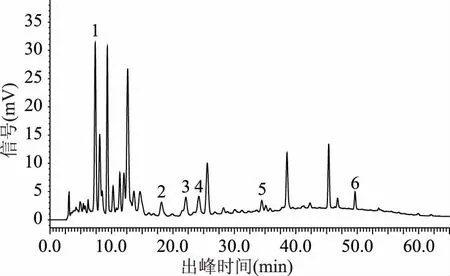
图6 样品图(梯度洗脱程序三)Fig.6 Sample diagram(gradient elution program 3)
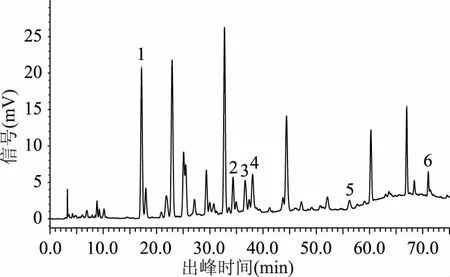
图7 样品图(梯度洗脱程序四)Fig.7 Sample diagram(gradient elution program 4)
图8 样品图(梯度洗脱程序五)Fig.8 Sample diagram(gradient elution program 5)
图9 样品图(梯度洗脱程序六)Fig.9 Sample diagram(gradient elution program 6)
2.1.3 柱温 通过对各柱温下色谱图的对比分析(图10~图13),结果显示柱温对表儿茶素、绿原酸、咖啡酸、4-香豆酸4种多酚化合物的分离影响较大,对根皮苷、原儿茶酸2种多酚化合物的分离影响相对较小,总的来说当柱温为40 ℃时,猕猴桃果皮多酚中6种目标组分的分离效果最好。
图10 样品图(柱温25℃)Fig.10 Sample diagram(column temperature 25 ℃)
图11 样品图(柱温30℃)Fig.11 Sample diagram(column temperature 30 ℃)
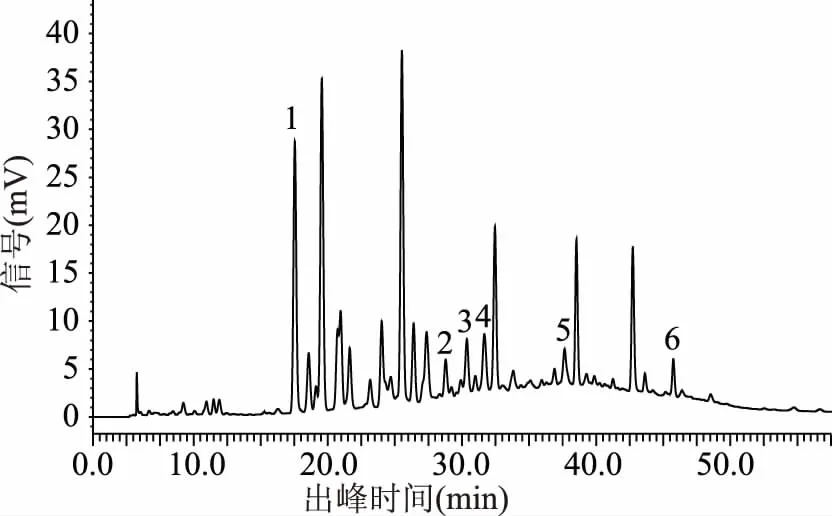
图12 样品图(柱温40℃)Fig.12 Sample diagram(column temperature 40 ℃)
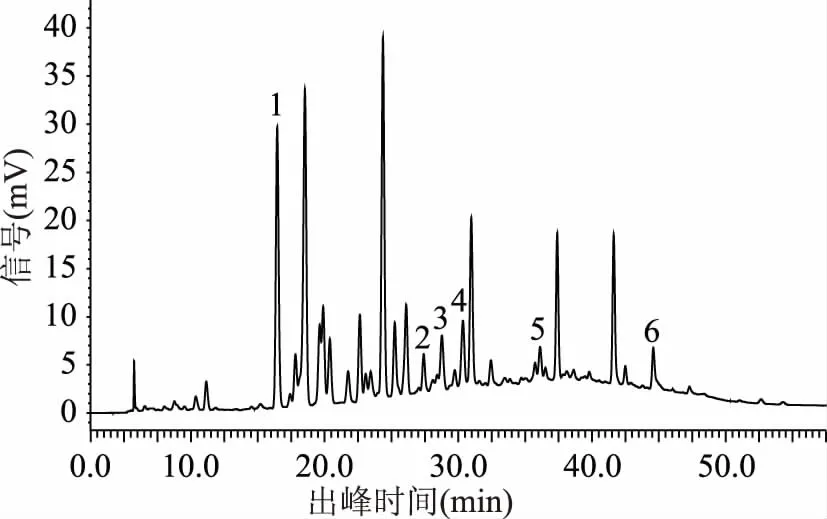
图13 样品图(柱温45℃)Fig.13 Sample diagram(column temperature 45 ℃)
2.1.4 进样量确定 通过对三个不同进样量条件下所得色谱图的对比分析(图14~图16),结果表明在此次实验中进样量对猕猴桃果皮多酚中6种多酚类化合物的分离效果影响相对较小,经对比分析,最终选取进样量为10 μL。
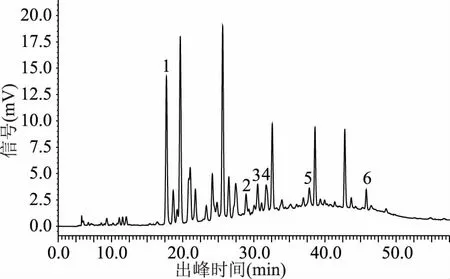
图14 样品图(进样量5μL)Fig.14 Sample diagram(Sampling quantity 5 μL)
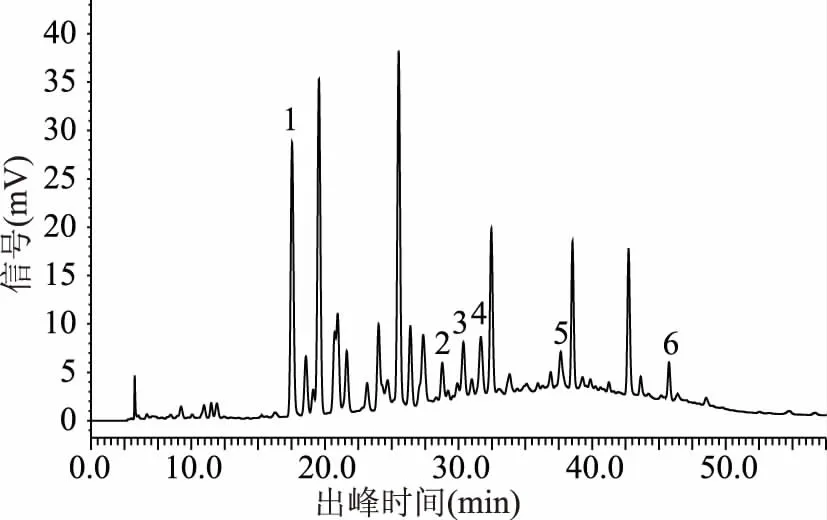
图15 样品图(进样量10μL)Fig.15 Sample diagram(Sampling quantity 10 μL)
图16 样品图(进样量10μL)Fig.16 Sample diagram(Sampling quantity 10 μL)
2.1.5 最佳色谱条件 色谱柱:InertSustain C18(4.6 mm×250 mm,5 μm),流动相:10 mmoL/L的KH2PO4水溶液(pH2.0)(A)-甲醇(B),柱温40 ℃,流速1 mL/min,进样量10 μL,检测波长为280 nm,梯度洗脱程序顺序为0 min,90% A,10% B;5 min,88% A,12% B;15 min,80% A,20% B;25 min,70% A,30% B;32 min,60% A,40% B;40~50 min,50% A,50% B。
在该色谱条件下进样,得混合标准品和猕猴桃果皮多酚样品的HPLC色谱图分别如图17-图18。
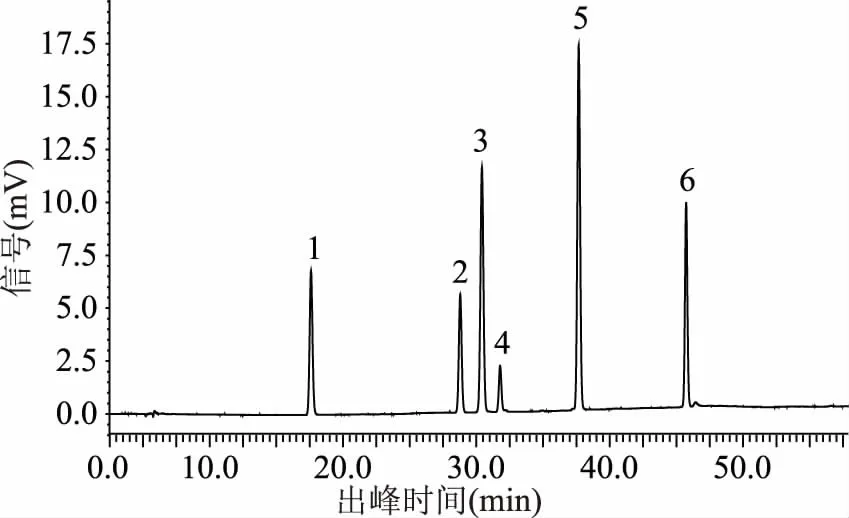
图17 混合标准品HPLC图Fig.17 Mixed HPLC map standard sample
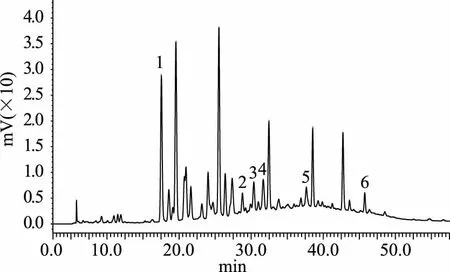
图18 样品HPLC图Fig.18 Sample HPLC diagram
2.2 方法学考察
2.2.1 方法的回归方程 各对照品建立的线性回归方程,见表2。
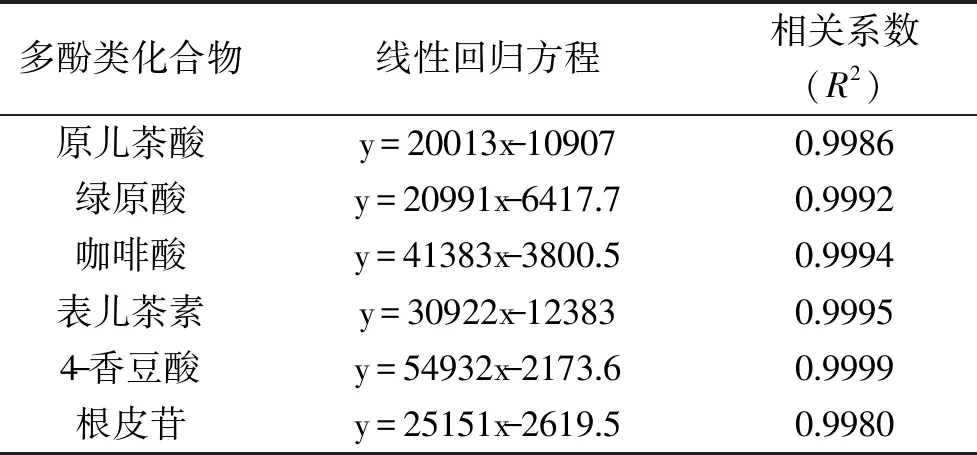
表2 6种多酚化合物的线性回归方程、相关系数Table 2 Linear regression equation and correlation coefficient of 6 polyphenols
2.2.2 精密度 通过精密度实验的考察,6种多酚类化合物的平均相对标准偏差(RSD)均在1.62%~1.85%之间,表明此方法有较高的精密度。
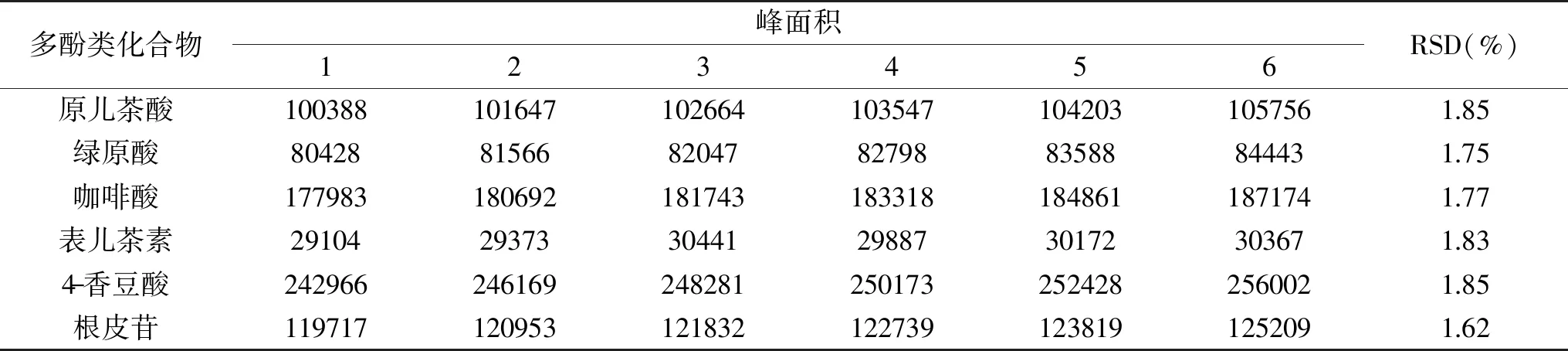
表3 6种多酚类化合物的精密度Table 3 The precision of 6 kinds of polyphenols
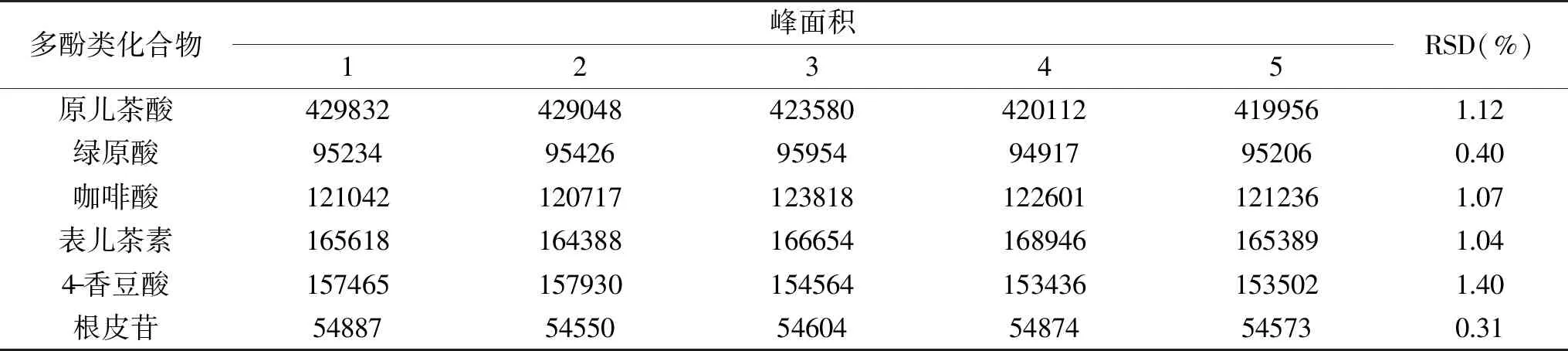
表4 6种多酚类化合物的重复性Table 4 The reproducibility of 6 polyphenols
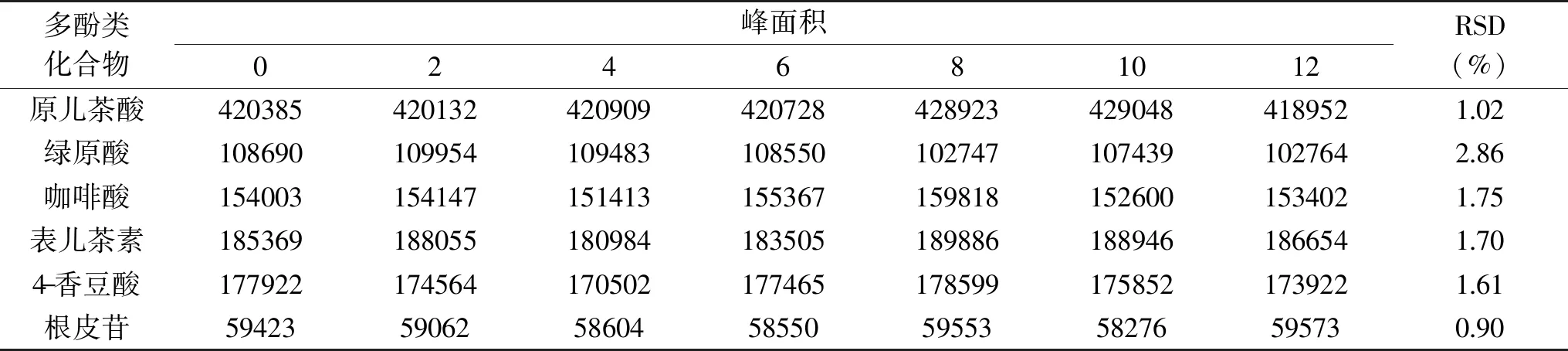
表5 6种多酚类化合物的稳定性Table 5 Stability of 6 polyphenols
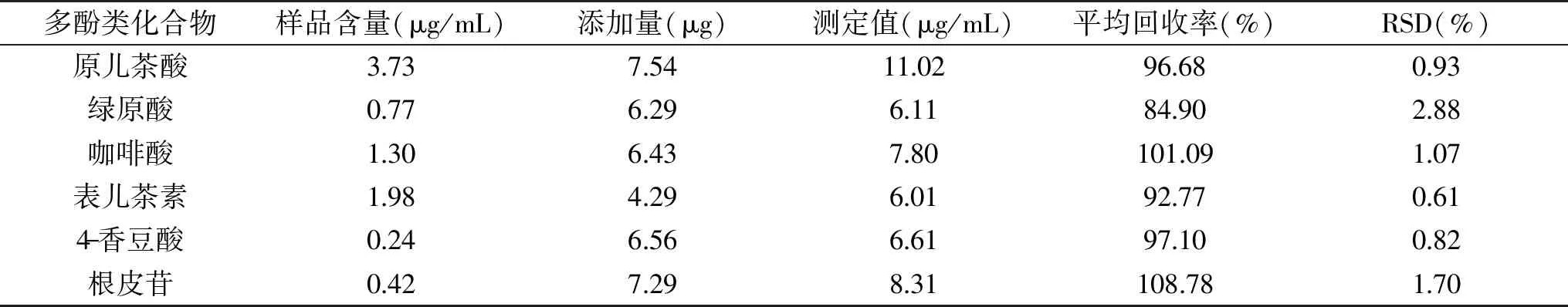
表6 6种多酚类化合物的回收率Table 6 Recovery rate of 6 polyphenols
2.2.3 重复性 通过重复性实验的考察,6种多酚类化合物的平均相对标准偏差(RSD)均在0.31%~1.40%之间,表明此方法重复性良好。
2.2.4 稳定性 通过稳定性实验的考察,除绿原酸的RSD值为2.86%,其余5种多酚类化合物的平均相对标准偏差(RSD)均在0.90%~1.75%之间,表明此方法有较强的稳定性。
2.2.5 加样回收率 通过回收率实验的考察,除绿原酸的平均回收率为84.90%、RSD值为2.88%外,其余5种多酚类化合物的平均回收率均在92.77%~108.78%之间,相对标准偏差(RSD)在0.61%~1.70%之间,表明此方法有较好的回收率。
2.3 猕猴桃果皮多酚含量测定
将在猕猴桃果皮多酚中测得各目标组分的峰面积带入各对照品的回归方程中,计算得到猕猴桃皮样品中原儿茶酸、表儿茶素、绿原酸、咖啡酸、4-香豆酸、根皮苷6种多酚类化合物的含量分别为22.18±0.20、6.39±0.16、5.44±0.10、3.99±0.10、4.42±0.06、3.61±0.05 μg/mg。
3 结论与讨论
本实验以乙醇为溶剂提取猕猴桃皮中的多酚,再经大孔吸附树脂纯化后,用InertSustain C18(4.6 mm×250 mm,5 μm)色谱柱,10 mmoL/L的KH2PO4水溶液(pH2.0)(A)-甲醇(B)作流动相,40 ℃柱温,流速1 mL/min,进样量10 μL,检测波长280 nm,采用梯度洗脱的方式,能较好的将6种目标组分在50 min内完全分离。且经方法学实验考察,表明此方法重复性良好(RSD≤1.40%)、稳定性较强(RSD≤2.86%)、精密度较高(RSD≤1.85%)、回收率在84.90%~108.78%之间。样品测得6种目标组分原儿茶酸、表儿茶素、绿原酸、咖啡酸、4-香豆酸、根皮苷6种多酚类化合物的含量分别为(22.18±0.20)、(6.39±0.16)、(5.44±0.10)、(3.99±0.10)、(4.42±0.06)、(3.61±0.05) μg/mg,其中原儿茶酸相对含量较高。与高振鹏[20]从猕猴桃皮渣中鉴定出的13种成分相比,本研究得到的6种猕猴桃皮渣中多酚单体有原儿茶酸、绿原酸、咖啡酸、表儿茶素四种单体是一致的。与杜丽娟等[21]测定的猕猴桃果酒中的13种成分相比,有原儿茶酸、绿原酸、咖啡酸、表儿茶素、香豆酸五种单体是一致的。与左丽丽[8]从狗枣猕猴桃多酚中鉴定出的10种成分相比,有香豆酸、绿原酸二种单体是一致的。说明不同产地、不同品种、不同部位提取的多酚成分都有一定的差异。与石榴皮[18]、苹果皮[22]中测定的多酚类化合物比较,猕猴桃皮多酚物质种类丰富,含量高。
本文建立的HPLC法同时检测猕猴桃皮中原儿茶酸、表儿茶素、绿原酸、咖啡酸、4-香豆酸、根皮苷6种多酚类化合物的含量,结果准确可靠,操作简便、快速。
农产品废弃物综合利用是目前研究的热点,本研究也旨在为猕猴桃皮及多酚进一步开发利用提供一定的参考依据。本研究由于未串联质谱进行分析,故还有些成分未鉴定出来,在下一步的工作开展中将进一步研究。
