赤鱼鱼皮制备胶原肽的酶解工艺优化及其理化特性分析
2019-07-10李剑瑛施沈佳黎中宝陈俊德
李剑瑛,施沈佳,黎中宝,陈俊德,刘 睿
(1.集美大学水产学院,福建厦门 361021; 2.国家海洋局海洋生物资源综合利用工程技术研究中心, 国家海洋局第三海洋研究所,福建厦门 361005; 3.南京中医药大学药学院,江苏南京 210023)
赤魟鱼是我国常见的经济鱼类,其尾刺、肝、软骨均具有药用价值。目前,国内外对于赤魟的研究主要集中在尾刺、线粒体等[1-2]。然而,关于赤魟鱼鱼皮胶原肽的研究未见报道。赤魟鱼鱼皮富含胶原,是提取胶原及其衍生物良好的原料[3]。近年来,传染性疾病如禽流感、牛海绵状脑病和口蹄疫等的爆发和伊斯兰、回教教徒信仰方面的忌讳,引发人们对猪、牛等陆源生物胶原使用的担忧[4]。水产品鱼类在加工生产过程中,会产生巨量的加工副产物鱼皮,造成环境污染,若能将其合理开发利用,可实现低值资源高值化利用。
胶原肽广泛应用于药品、食品、保健品和化妆品等领域。世界胶原市场需求量高达20万吨,销售额210亿美元,并呈增长趋势,具有巨大的市场前景[5]。酶解法具安全、可控、环保等特点,是开发高附加值胶原肽的主流方法[6]。因此,本研究以赤魟鱼鱼皮为原料制备明胶,在此基础上,以水解度为指标,确定蛋白酶酶解鱼皮明胶的最佳工艺条件,鉴定酶解胶原肽的氨基酸序列,并测定其理化性质,为胶原肽的产业化开发提供理论指导和技术支撑。
1 材料与方法
1.1 材料与仪器
赤魟鱼(Dasyatisakaje)鱼皮 福建省漳州市东山县;动物蛋白酶(20000 U/g) 国药集团化学试剂有限公司;碱性蛋白酶(200000 U/g)、胰蛋白酶(4000 U/g)、中性蛋白酶(200000 U/g)、菠萝蛋白酶(500000 U/g)、木瓜蛋白酶(800000 U/g) 食品级,南宁庞博生物工程有限公司;BCA蛋白浓度测定试剂盒 北京碧云天生物公司;茚三酮 分析纯,北京百灵威科技有限公司;玉米油 益海嘉里食品营销有限公司。
DSHZ300A恒温水浴摇床 太仓市华利达实验设备有限公司;UV-1780紫外分光光度计 岛津企业管理(中国)有限公司;便携式pH计 梅特勒-托利多仪器(上海)有限公司;戴安 U3000Nano RSLC 纳升液相系统 美国DIONEX公司;Thermo LTQ Orbitrap XL质谱仪 美国Thermo Fisher公司。
1.2 实验方法
1.2.1 赤魟鱼皮明胶的提取 参考Kala等[7]方法并稍作修改,去除脂肪、肌肉后的鱼皮依次用0.2 g/L NaOH、0.2 g/L硫酸溶液、0.2 g/L柠檬酸溶液浸泡45 min后,水洗至中性滤干水分备用。250 g鱼皮(湿重)加入2.5 L蒸馏水,水浴45 ℃下搅拌10 h提取明胶。明胶提取液室温下4500 r/min离心30 min后,将上清液置于冷冻干燥冻机中冻干,冻干后样品放于-40 ℃冰箱中保存备用。

1.2.2 酶的筛选 分别选用菠萝蛋白酶、碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶、动物蛋白酶,确定酶加量2 g/L,底物浓度5 g/L,水解时间6 h,按表1所示,在各蛋白酶最适pH和温度条件下进行水解,酶解后于100 ℃水浴灭酶15 min,冰浴冷却,冷冻干燥并检测其水解度。选择水解度最高的酶用于后续实验。各酶的酶解条件如表1。
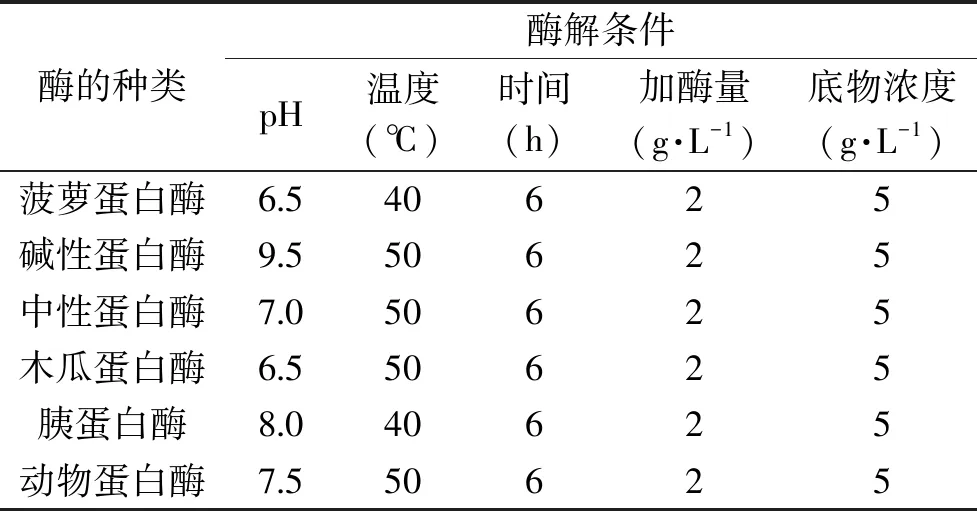
表1 六种酶对赤魟鱼皮明胶的酶解作用Table 1 Enzymolysis effect of six enzymes on gelatin of Dasyatis akajei skin
1.2.3 单因素实验 利用1.2.2节筛选出的水解度最高的酶酶解赤魟鱼鱼皮明胶,固定温度40 ℃、时间6 h、酶加量2 g/L、底物浓度5 g/L,考察不同pH(3.5、4.5、5.5、6.5、7.5)对水解度的影响;固定时间6 h、酶加量2 g/L、底物浓度5 g/L、pH5.5,考察不同温度(30、35、40、50、60 ℃)对水解度的影响,固定温度40 ℃、pH5.5、酶加量2 g/L、底物浓度5 g/L,考察时间(1、2、3、4、5、6 h)对水解度的影响,固定温度40 ℃、pH5.5、底物浓度5 g/L、时间3 h,考察加酶量(0.1、0.5、1.0、5.0、10.0 g/L)对水解度的影响,固定温度40 ℃、pH5.5、底物浓度5 g/L、时间3 h、酶加量5 g/L,考察底物浓度(1.0、2.5、5.0、7.5、10.0 g/L)对水解度的影响。通过单因素实验,考察各单因素变量对赤魟明胶水解度的影响。
1.2.4 赤魟鱼皮明胶酶解条件响应面优化设计 在单因素试验基础上,根据Box-Benhnken组合实验设计原理,以水解度为指标,考察pH、温度、时间、加酶量对水解度的影响,响应面实验设计见表2。经过酶解得到的物质为胶原肽。将最优条件下获取的胶原肽用于1.2.5理化性质的检测。
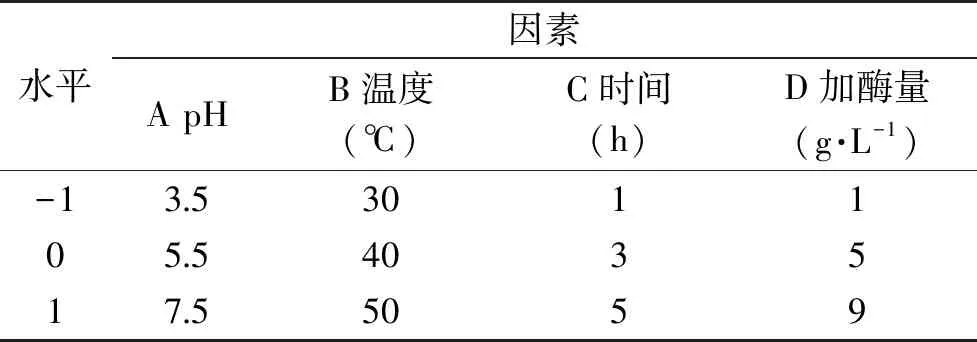
表2 响应面实验因素及水平Table 2 Factors and levels of response surface experiment
1.2.5 赤魟鱼鱼皮胶原肽理化性质检测
1.2.5.1 高效液相色谱-串联质谱(LC-MS/MS)表征胶原肽 将10 mg胶原肽溶于0.1 g/L的三氟乙酸溶液中,SepPak C18柱脱盐,离心冷冻干燥后,将样品重新溶解于乙腈/甲酸/水(2∶0.2∶98,v/v)中。色谱条件:色谱柱:5 μm Reprosil C18 AQ柱(75 μm×150 mm),进样量5 μL;流速:400 nL/min;流动相A:乙腈/甲酸/水(2∶0.2∶98,v/v);流动相B:乙腈/甲酸/水(80∶0.2∶20,v/v);2%~30% B线性梯度洗脱150 min。质谱条件:喷雾电压2.5 kV;离子传输毛细管温度200 ℃;碰撞气体:He,碰撞能量:35%,激活时间:30 ms;质谱一级全扫描范围:m/z 300~2000;串联质谱分析采用一级质谱数据依赖二级质谱扫描模式。Xcalibur 2.0.7和Tune 2.4软件进行数据分析[8]。
1.2.5.2 胶原肽水解度的测定 配制质量浓度为0.65 g/L的胶原肽,取2 mL加入1 mL茚三酮显色液,于100 ℃沸水中加热15 min,取出冰浴冷却后,加5 mL体积分数为40%的乙醇溶液充分混匀后,静止15 min,于570 nm处检测其吸光度。用6 mol/L HCl配制0.65 g/L的明胶溶液于120 ℃下水解24 h完全水解明胶,并检测其水解度(degreeof hydrolysis,DH)[9]。用甘氨酸为标准品绘制标准曲线,标准曲线为y=0.0397x-0.0105,相关系数r=0.9992,线性范围在0~20 ug/mL。利用标准曲线求出氨基态氮的含量,计算公式如下。
水解度(%)=(水解液中氨基态氮含量-原料中氨基态氮含量)/原料中总氮含量×100
1.2.5.3 胶原肽溶解度的测定 配置质量浓度为1 g/L的胶原肽,用1 mol/L HCl或1 mol/L NaOH溶液调节pH2~8后。溶液在25 ℃搅拌30 min,8000×g离心10 min[10]。利用微量BCA蛋白浓度测定试剂盒,测定蛋白质含量,计算公式如下所示。

1.2.5.4 胶原肽脂肪吸收能力(FAC)的测定 取500 mg胶原肽与10 mL玉米油混合。25 ℃下静置30 min,每隔10 min均质一次,2000×g离心25 min。测量上清液体积[11]。
式中:V1:实验加油量(mL);V2:离心后剩余的油的量(mL);m:样品质量(g)。
1.2.5.5 胶原肽持水能力(WHC)的测定 500 mg胶原肽溶于50 mL去离子水中,均质120 s后,在25 ℃下保持30 min,5000×g离心30 min。去上清液,离心管与沉淀物一起称重[12]。
式中:m1:离心后样品与离心瓶的质量(g);m2:离心瓶的质量(g);m3:样品的质量(g)。
1.2.5.6 胶原肽起泡性能(FC)和泡沫稳定性(FS)的测定 配制质量浓度为0.5 g/L浓度的胶原肽,取20 mL胶原肽溶液用1 mol/L HCl及1 mol/L NaOH溶液调节pH至 2、4、6、8和10,1600 r/min 25 ℃下均质120 s后,将样品快速转移至250 mL量杯容器中,并在30 s后记录总体积[13]。将FS定为3 min后剩余的泡沫体积的百分比。
式中:V1:搅打后静止30 s体积(mL);V2:搅打前体积(mL)。
式中:V3:静置3 min后的体积(mL);V2:搅打之前的体积(mL)。
1.2.5.7 胶原肽乳化性及乳化稳定性的测定 用0.5 mol/L的乙酸溶液配制0.5 g/L的胶原肽溶液,用2 mol/L的HCl溶液及2 mol/L的NaOH溶液调节pH至2、3、4、5、6、7和8,并定容至10 mL,再加入10 mL的玉米油,10000 r/min均质2 min。移入50 mL离心管中,1500 r/min离心5 min[14]。
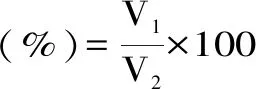
式中:V1:离心后乳化混合胶原肽液体积(mL);V2:均质乳化后混合胶原肽溶液总体积(mL)。
将样品与玉米油混合液1000 r/min 均质2 min,在15、30、45、60和75 min测量离心管中上层乳化层的高度。
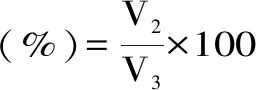
式中:V2:剩余乳化液体积(mL);V3:原乳化液体积(mL)。
1.3 数据处理
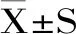
2 结果与分析
2.1 赤魟鱼鱼皮提取明胶得率
赤魟明胶得率达56.52%±0.03%,该结果比军曹鱼13.8%[7]、舌鳎10.3%[7]、亚洲鲈鱼27.3%高[15],比海鲈66.4%低[16]。明胶产量高低与鱼的物种及提取条件有关。鱼的物种不同,其鱼皮组成和基质不同[17],预处理时酸和碱处理使鱼皮充分膨胀,膨胀时交联被打开,使得产率提高[7]。本研究中赤魟鱼皮的明胶得率较高,可用于商业明胶的提取。
2.2 酶的筛选
由图1所示,水解度最高为菠萝蛋白酶16.38%±0.50%,其次分别是碱性蛋白酶、动物蛋白酶、中性蛋白酶、胰蛋白酶,最低的为木瓜蛋白酶10.74%±0.19%。酶的特异性使其与底物作用的位点存在差异性,酶解得到胶原肽的数量和明胶被水解的程度不同[18]。为了进一步了解酶解条件对明胶水解度的影响,我们选取菠萝蛋白酶制备赤魟鱼鱼皮胶原肽。
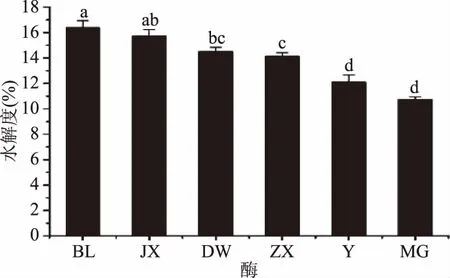
图1 鱼皮明胶酶解液水解度Fig.1 Hydrolysis degree of gelatin hydrolysate from skin of Dasyatis akajei注:图上方字母不同表示差异显著(p<0.05),图2~图6、图8~图12同;BL表示菠萝蛋白酶酶解液,JX表示碱性蛋白酶酶解液,DW表示动物蛋白酶酶解液,ZX表示中性蛋白酶酶解液,Y表示胰蛋白酶酶解液,MG表示木瓜蛋白酶酶解液。
2.3 单因素实验分析
2.3.1 pH对胶原肽水解度的影响 如图2所示,明胶的水解度随着pH升高,呈现先上升后下降的趋势,pH在3.5~5.5范围内,水解度随着pH的增大而增大,当pH为5.5时水解度达到最大值15.55%±0.10%,后随着pH的升高而下降。主要是因为pH通过影响酶的活性和底物的构象进一步影响明胶的水解度[19]。故本研究选取pH5.5为最适pH。
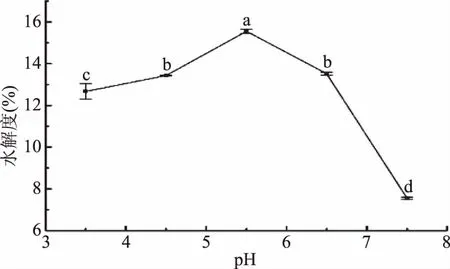
图2 pH对酶解产物水解度的影响Fig.2 Effects of pH on the hydrolysis degree of enzymatic hydrolysates
2.3.2 温度对胶原肽水解度的影响 如图3所示,明胶的水解度随着温度升高,呈现先上升后下降的趋势。在30~40 ℃范围内,水解度随着温度的升高而增大,当温度为40 ℃时达到最大值17.47%±0.68%,后随着温度升高而下降。可能是因为随着温度的上升,酶的活性逐渐升高,酶解效率逐渐增高,当达到一定程度后,随着温度的升高蛋白酶变性导致酶活下降,酶解效率从而逐渐下降[20],因此水解度呈现先上升后下降的趋势。故本研究选取40 ℃为最适酶解温度。
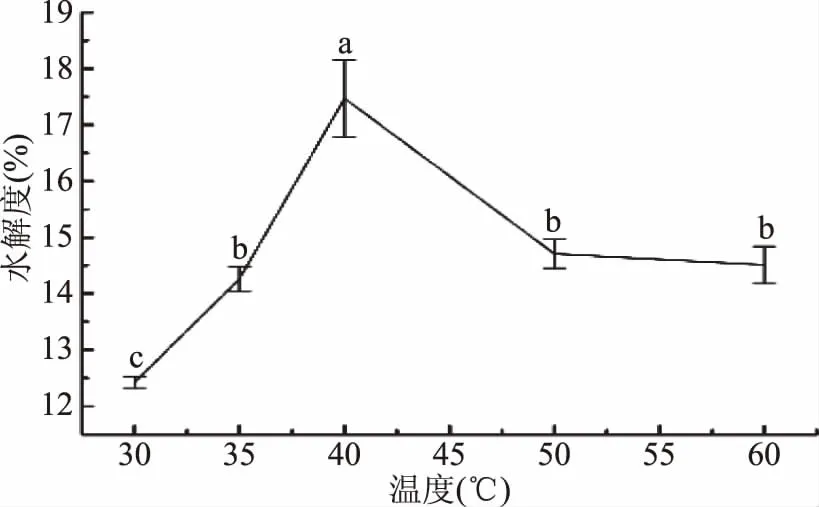
图3 温度对酶解产物水解度的影响Fig.3 Effect of temperature on the hydrolysis degree of enzymatic hydrolysates
2.3.3 酶解时间对胶原肽水解度的影响 如图4所示,明胶蛋白的水解度随酶解时间的增加,呈现先上升后稳定的趋势。酶解时间为1~3 h时,水解度随着时间的增加而增大,在3 h时达到最大值14.45%±0.18%,3 h后无显著变化。这可能与酶反应动力学有关,反应前期由于酶和底物浓度均较高,因此反应朝着正反应方向进行,随着时间的推移,底物浓度不断发生反应,含量不断减少,反应变得缓慢,后期基本保持不变[21]。因此随着酶解时间的延长,水解度呈现先上升后稳定的趋势。故本研究选取3 h为最适酶解时间。
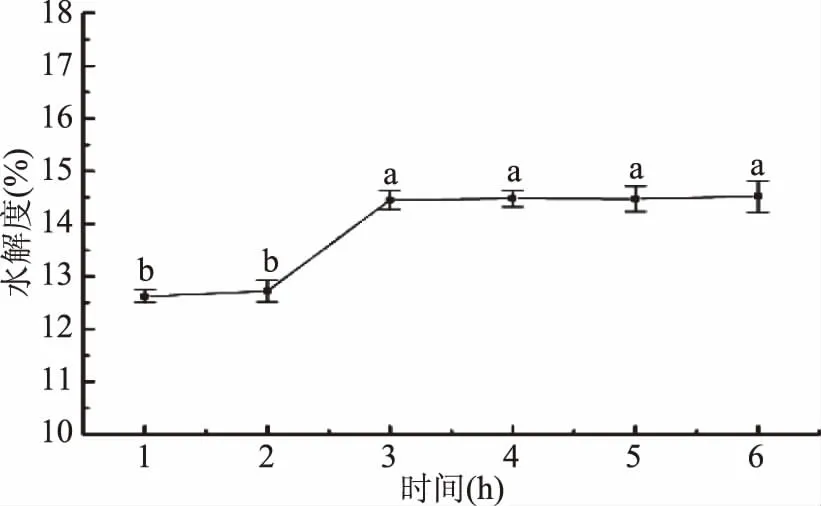
图4 时间对酶解产物水解度的影响Fig.4 Effects of time on the hydrolysis degree of enzymatic hydrolysates
2.3.4 加酶量对胶原肽水解度的影响 如图5所示,加酶量在0.1~5 g/L范围内,水解度随着加酶量的增大而增大,5 g/L时达到最大值15.56%±0.37%。可能是因为加酶量对水解度的影响主要与酶和底物的结合位点及形成的中间产物的量有关,反应前期由于底物浓度较高,此时底物与酶结合位点还有空余,且反应生成的中间产物较少,因此随着加酶量的增大水解度呈现上升的趋势[22-23]。当加酶量大于5 g/L后水解度无显著变化(p>0.05)。可能是因为随着酶加量进一步增大,底物与酶的结合位点不断减少,中间产物逐渐增多达到饱和状态,因此随着加酶量的升高,水解度上升缓慢甚至出现轻微下降的趋势。故本实验选取加酶量为5 g/L为最适加酶量。
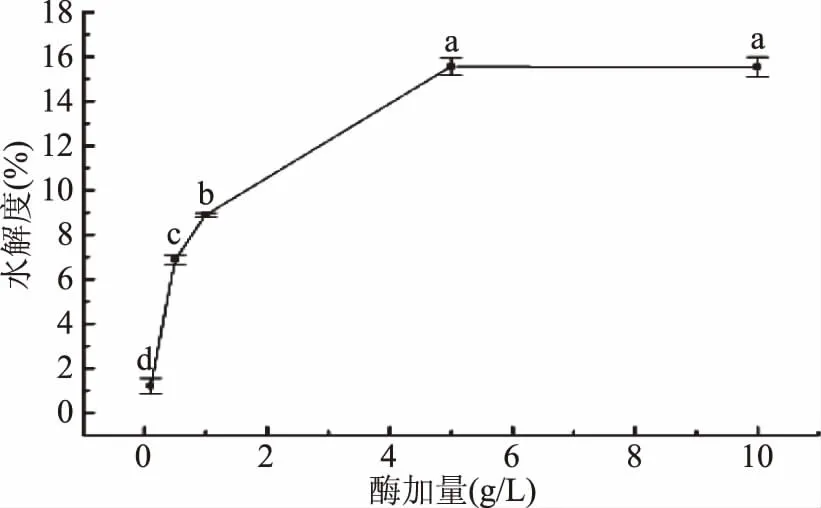
图5 加酶量对酶解产物水解度的影响Fig.5 Effects of enzyme addition on degree of hydrolysis of enzymatic hydrolysates
2.3.5 底物浓度对胶原肽水解度的影响 如图6所示,明胶蛋白的水解度随着底物浓度增加,呈现先上升后稳定的趋势。在1~7.5 g/L范围内,水解度随着底物浓度的增大而增大,7.5 g/L时达到最大值15.85%±0.5%,大于7.5 g/L呈现缓慢下降的趋势。考虑成本问题本研究选取底物浓度为5 g/L。
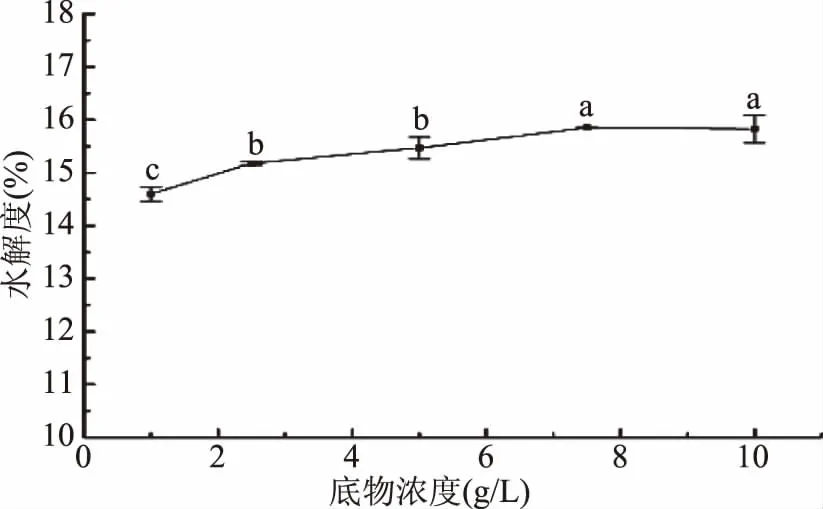
图6 底物浓度对酶解产物水解度的影响Fig.6 Effects of substrate concentration on the degree of hydrolysis of enzymatic hydrolysates
2.4 酶解实验响应面优化
2.4.1 响应面实验结果 在单因素的基础上,固定底物浓度为5 g/L,以pH、温度、时间、加酶量这4个因素为自变量,水解度为响应值,根据Box-Behnken实验设计原理进行响应面实验,其方案及结果如表3所示。
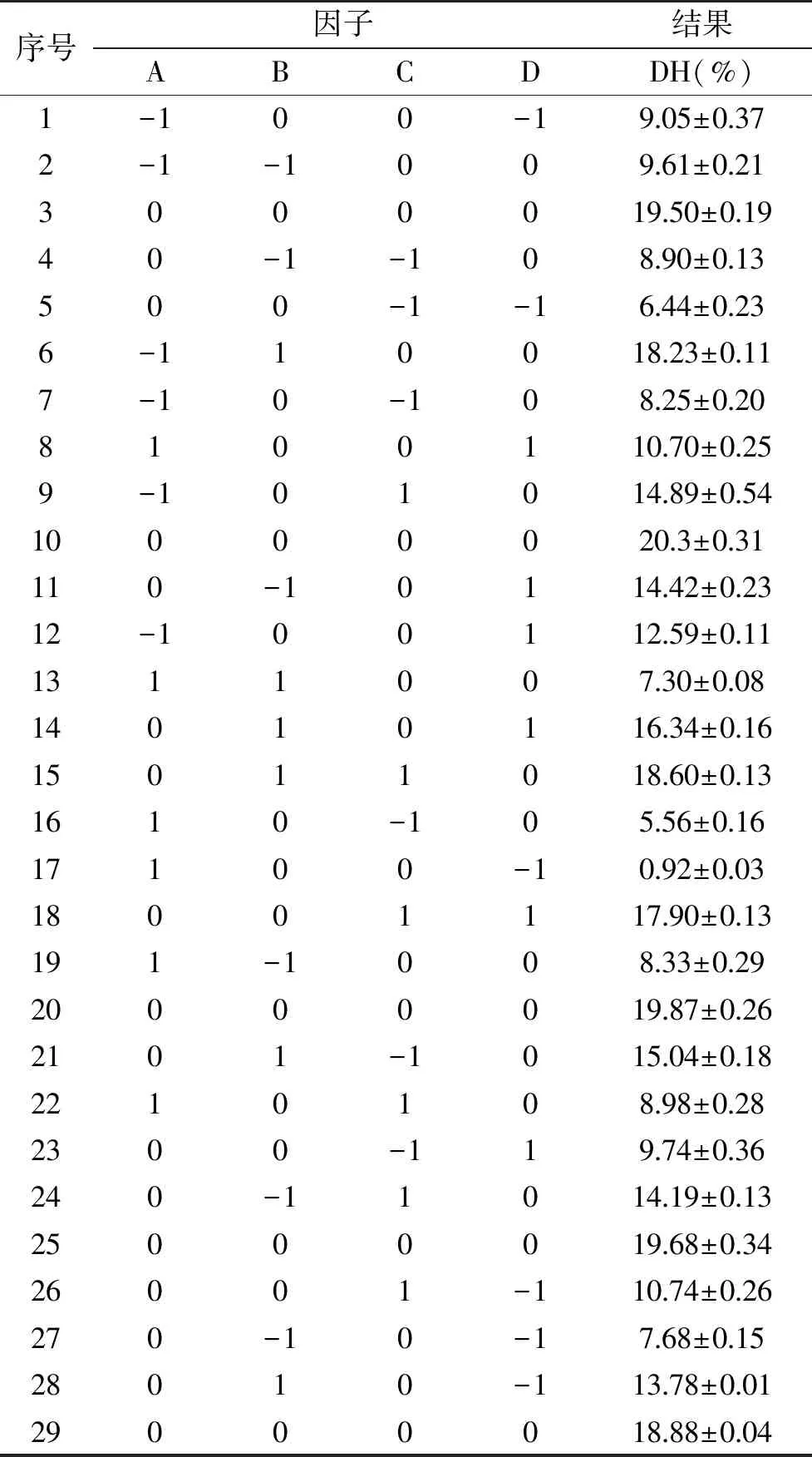
表3 响应面试验方案及实验结果Table 3 The design and results of response surface experiment
2.4.2 模型的建立及方差分析 对其进行多元回归拟合,得取代度的二次多项式回归方程为:
Y=19.65-2.34A+1.97B+2.53C+2.7D-2AB-0.8AC+1.56AD-0.69BC-BD+0.96CD-6.78A2-2.19B2-3.6C2-4.61D2
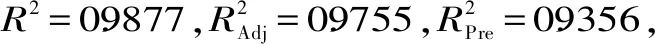
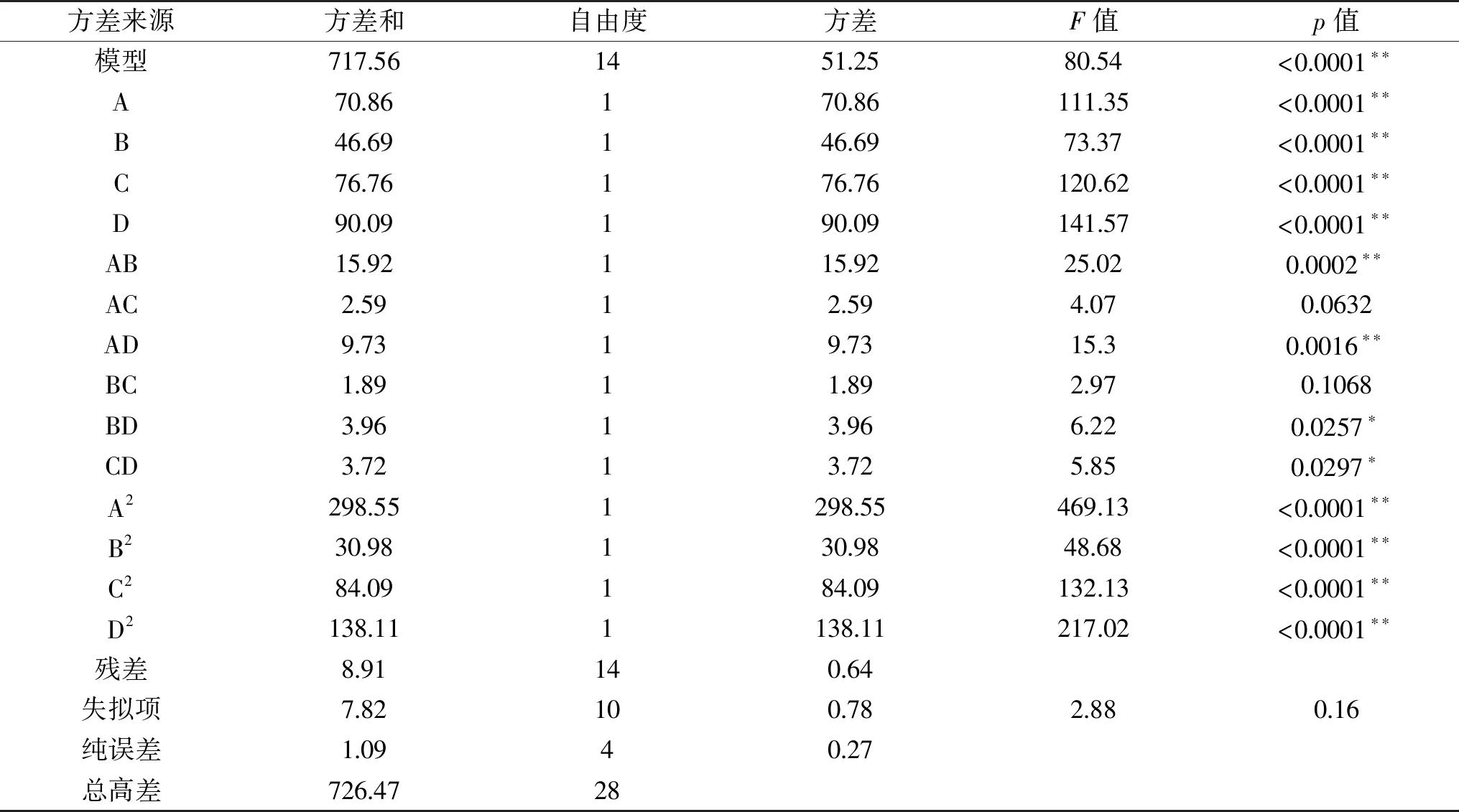
表4 回归模型方差分析Table 4 Analysis of variance of quadratic response model with degree of substitution
2.5 赤魟鱼鱼皮胶原肽理化性质及功能特性检测结果
2.5.1 LC-MS/MS对胶原肽表征 利用LC-MS/MS从样品中鉴定出180个肽(表5)。如图7所示,计算每个肽的氨基酸残基的数量(共2174个氨基酸残基),可知亲水氨基酸的总频率为1346/2174,疏水氨基酸的总频率为828/2174。同时,利用两亲性指数(GRAVY)来评价肽的亲疏水性(<0表示亲水性,>0表示疏水性),可知亲水性肽占66.11%,疏水性肽占33.89%。因此胶原肽整体表现为亲水性,这与亲水肽更容易在酶解过程中被释放出来相关。肽的分子量在707.40~2021.04 Da之间,0.56%的肽分子量大于2000 Da,99.44%的肽分子量低于2000 Da。Roberts等[25]认为肽的分子量越低越容易越过膜屏障,进入循环系统,达到高吸收效果。故本实验所制备的胶原肽可能通过肠吸收发挥作用。
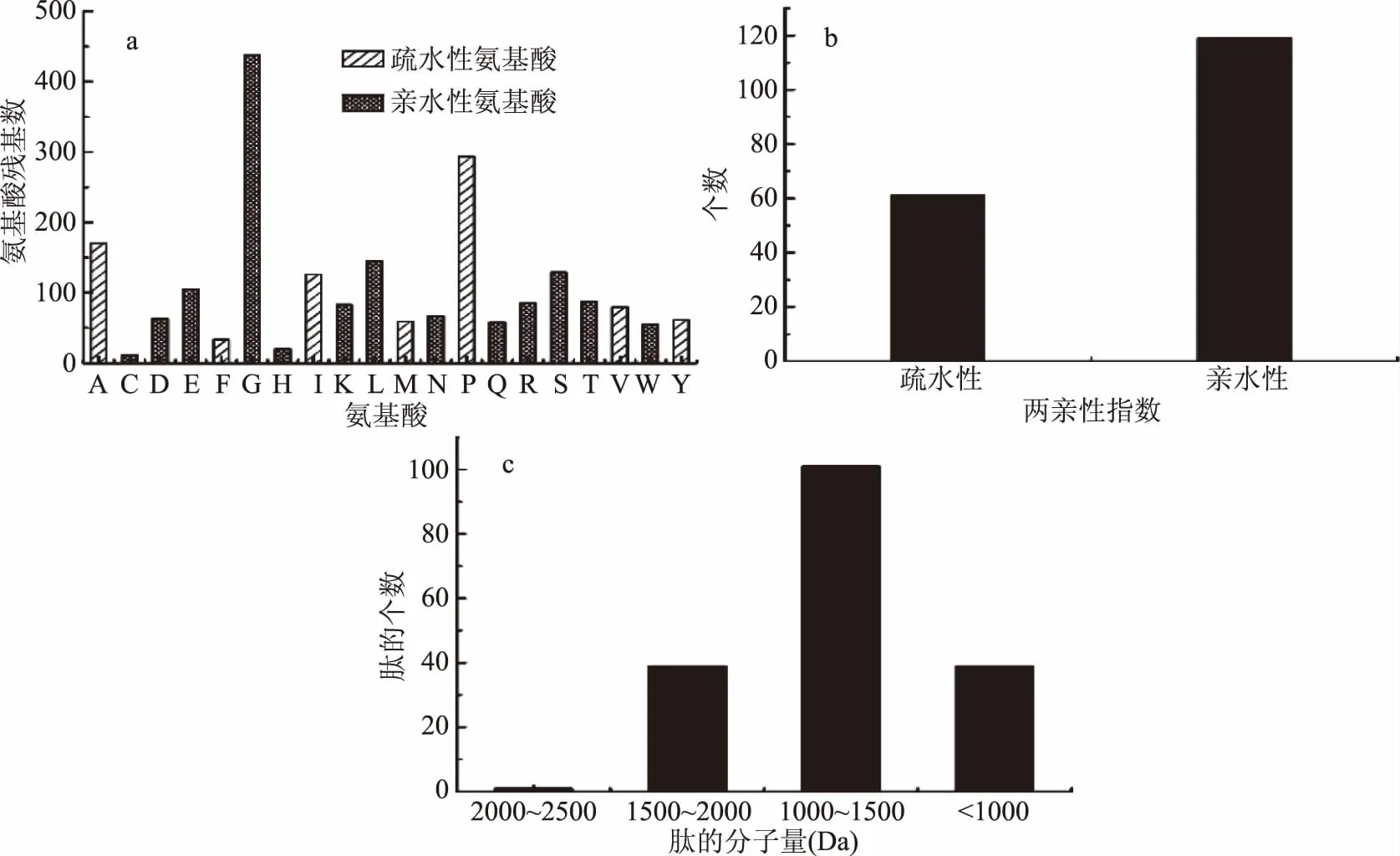
图7 胶原肽的基本信息Fig.7 Basic information of collagen peptides注:a:胶原肽的氨基酸残基;b:胶原肽的两亲性指数;c:胶原肽的分子量分布;不同字母分别为不同氨基酸简写:A(丙氨酸)、C(半胱氨酸)、D(天冬氨酸)、E(谷氨酸)、F(苯丙氨酸)、G(甘氨酸)、H(组氨酸)、I(异亮氨酸)、K(赖氨酸)、L(亮氨酸)、M(蛋氨酸)、N(天冬酰胺)、P(脯氨酸)、Q(谷氨酰胺)、R(精氨酸)、(丝氨酸)、T(苏氨酸)、V(缬氨酸)、W(色氨酸)、Y(酪氨酸),表5同。
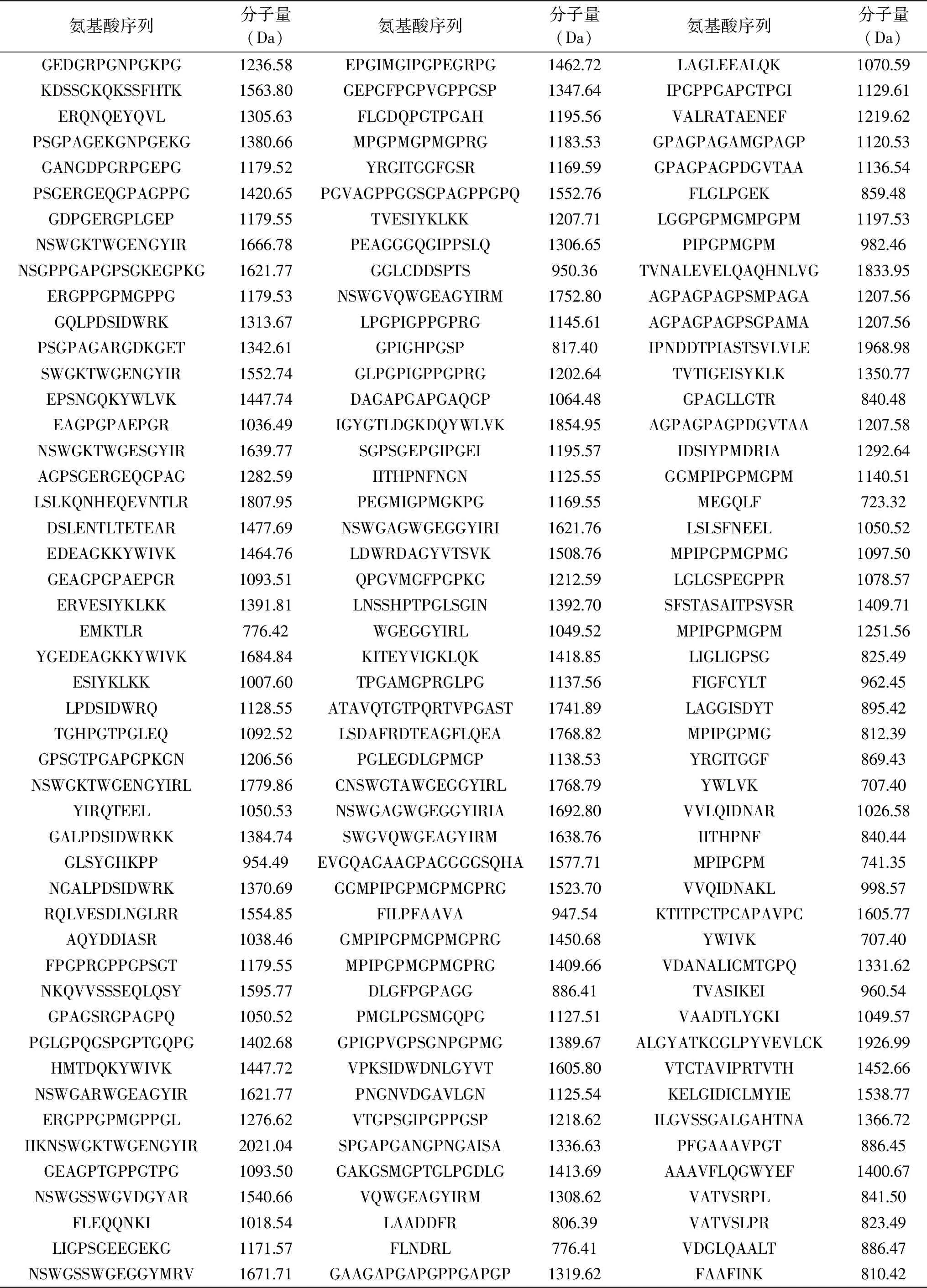
表5 肽的鉴定与分子量信息Table 5 Peptides identification and molecular weight
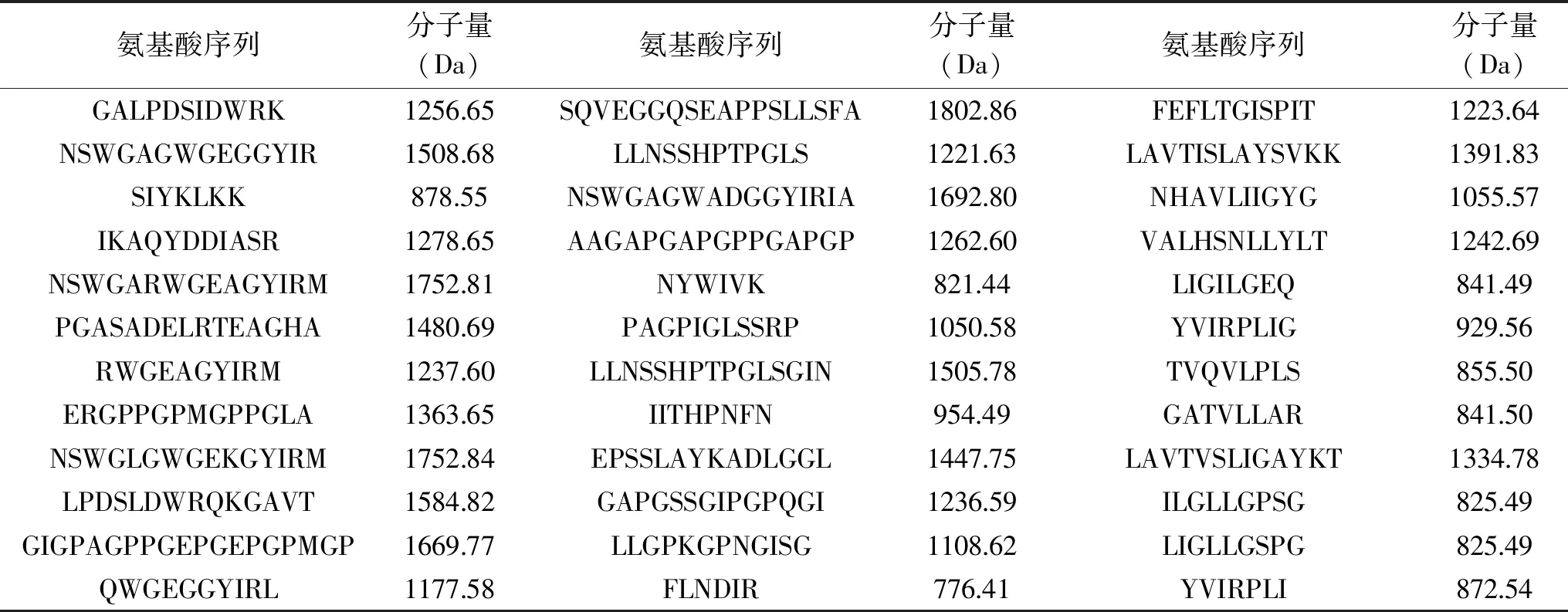
续表
2.5.2 pH对胶原肽溶解性的影响 如图9所示,不同pH条件下胶原肽溶解度均达到90%以上。研究发现胶原肽分子量的大小与其溶解性呈负相关,这可能是因为分子量越小其水解时产生更多的极性残基,这些残基可与水分子形成氢键增加其溶解性[26],且Balti等[27]研究也发现酶水解可溶性较低的蛋白质复合物,将可溶性肽释放出来进而改善蛋白质水解产物的溶解性。胶原肽鉴定结果表明99.44%的胶原肽分子量低于2000 Da,该结果与胶原肽表现出的良好的溶解性相对应,良好的溶解性使胶原肽具有成为配方食品体系重要成分的潜力。
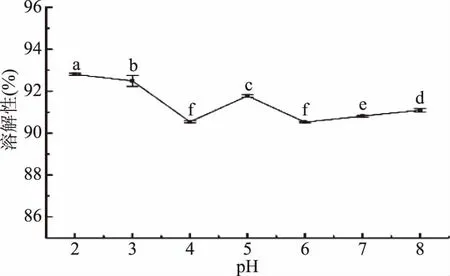
图8 pH对胶原肽溶解性的影响Fig.8 Effects of pH on the solubility of collagen peptides
2.5.3 pH对胶原肽起泡性及其稳定性的测定的影响 如图9所示,胶原肽的起泡性随pH的增大呈现先上升后下降的趋势,pH为6时其起泡性最高达到15.38%±0.15%,pH为2时最低为7.69%±0.08%。胶原肽的起泡性与体积和表面粘度、膜两侧的电斥力、表面张力等因素有关[28]。由于起泡性是蛋白质的界面性质,其对食品的质构及口感有影响,因此,胶原肽在pH为6时,具有应用到饮料、烘培、糖果、甜食中的潜力[29]。
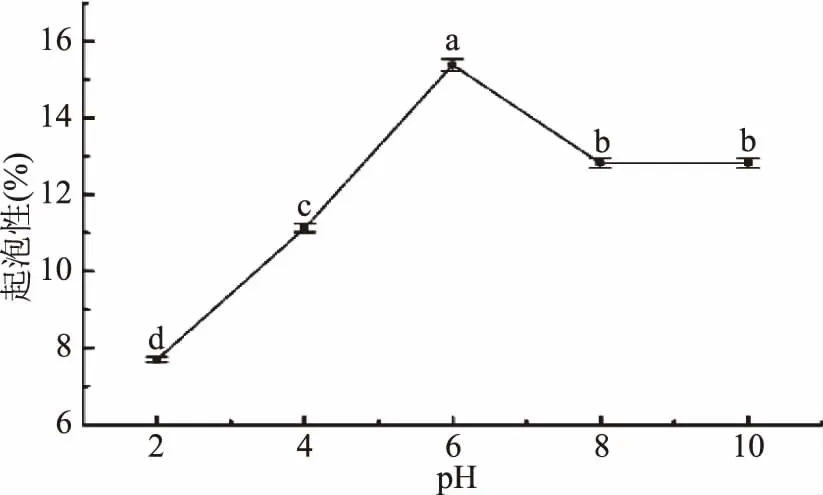
图9 pH对胶原肽起泡性的影响Fig.9 Effects of pH on the sudsing of collagen peptides
由图10可知,胶原肽的起泡稳定性随着pH的增大呈现先上升后下降的趋势,pH为6时其稳定性最好达到14.36%±0.14%。当pH小于4或pH大于8,其起泡性及起泡稳定性较低,主要与胶原肽分子的净电荷量有关,此时净电荷较高,排斥效果显著,导致其在界面上不能形成致密的、稳定的排列顺序[30]。
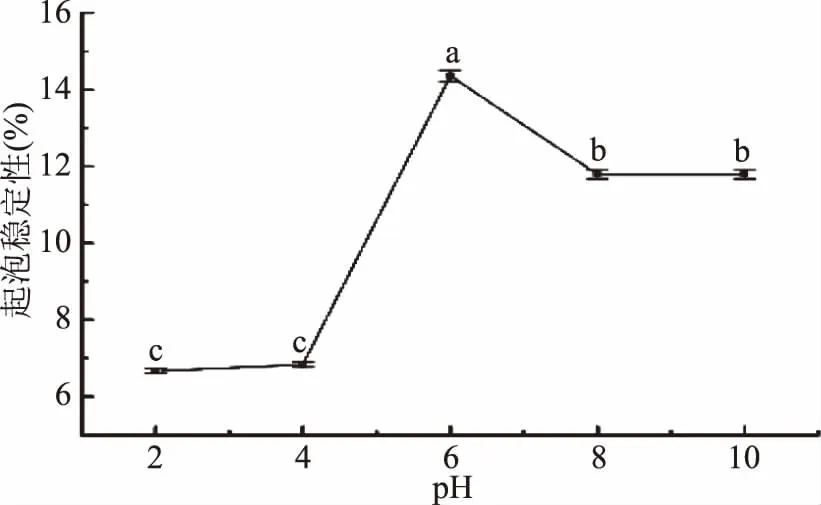
图10 pH对胶原肽起泡稳定性的影响Fig.10 Effects of pH on foaming stability of collagen peptide
2.5.4 pH对胶原肽乳化性及其稳定性的影响 如图11所示,胶原肽的乳化性随着pH的增大,整体呈现先上升后下降的趋势,pH为3时乳化性达到最大值78.82%±0.22%,pH为8时达到最小值63.99%±0.52%。该乳化性比酪蛋白(73.4%)低,比鳕鱼皮胶原蛋白肽(56.0%)高[31]。乳化性的高低与胶原肽的分子量有关,分子量越小其疏水基团暴露越多,将会打破亲疏水平衡的关系,使得界面张力减弱,最终导致乳化性降低[31],而pH的变化将会使胶原肽表面与脂质周围保护层的疏水性发生改变,从而使胶原肽乳化性发生变化[32]。
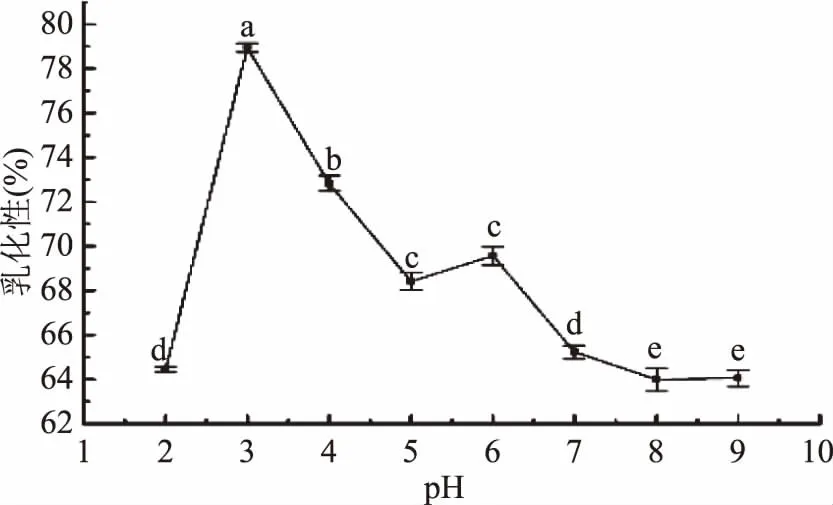
图11 pH对胶原肽乳化性的影响Fig.11 Effects of pH on emulsification of collagen peptide
图12所示,随着时间的延长,胶原肽的乳化稳定性呈现逐渐下降的趋势,在45 min时其乳化稳定性趋于稳定达到40.87%±0.37%,这可能与肽的分子量有关系,分子量越小,其越不容易在水与油界面之间扩散和吸附形成膜,从而使乳化稳定性降低[33]。
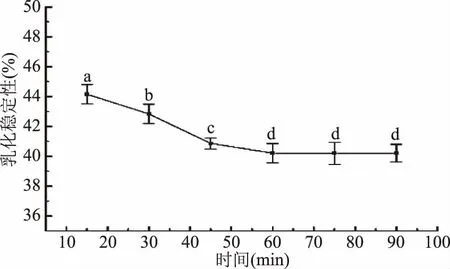
图12 酶解时间对胶原肽起乳化稳定性的影响Fig.12 Effect of time on emulsion stability of collagen peptides
2.5.5 胶原肽脂肪吸收能力 蛋白肽的脂肪吸收能力是蛋白质的非极性疏水区与脂肪非极性脂肪族链的相互作用的结果,一般以每克蛋白质吸收油的毫升数来表示。赤魟鱼胶原肽的脂肪吸收能力为(8.98±0.01) mL/g蛋白,优于石鱼胶原肽6.25 mL/g蛋白[34]、大鲵鱼皮胶原蛋白肽2.57 mL/g蛋白、猪皮胶原蛋白肽1.65 mL/g蛋白[35],良好的脂肪吸收能力可使食品中油脂的添加量加大,因此可以使食品可口又不油腻[36];可用于糖果或肉类加工过程中的蛋白质水解产物中,例如利用较好的脂肪吸收能力来提高香肠的脂肪和水分的含量[37]。
2.5.6 胶原肽持水能力 蛋白质水解产物的持水能力与蛋白质的去折叠和变性以及碳水化合物及其他非蛋白质成分有关[38],赤魟鱼皮胶原肽的持水能力(3.25±0.05) g/g肽,远高于LIF(0.21±0.03) g/g肽[39],良好的持水能力可加入碎肉中以提高蒸煮的产量[40]或应用于化妆品中[39]。
3 结论
本研究确定制备赤魟鱼鱼皮胶原肽的蛋白酶为菠萝蛋白酶,通过单因素试验和响应面试验分析,调整后的胶原肽的最佳制备条件为pH5.00、温度44.5 ℃、时间3.7 h、加酶量6.00 g/L。在此条件下,胶原肽的水解度为20.47%±0.11%,与预测值21.18%无显著差异。利用LC-MS/MS鉴定分析胶原肽结构,实验结果表明,胶原肽酶解液含180个肽,这些肽分子量为707.40~2021.04 Da;其中99.44%的肽分子量低于2000 Da,易被人体吸收。这些肽中66.11%肽为亲水性肽,33.89%肽为疏水性肽,说明胶原肽具有较好的溶解性,这与不同的pH条件下,胶原肽的溶解性都大于90%的实验结果相符。进一步理化性质研究结果表明:pH为6时胶原肽起泡性和起泡稳定性均达到最大值分别为15.38%±0.15%及14.36%±0.14%,pH为3时乳化性达到最大值78.82%±0.22%;持水能力为(3.25±0.05) g/g;脂肪吸收能力为(8.98±0.01) mL/g蛋白。本研究以水产加工副产物鱼皮为原料,建立酶解法制备高附加值胶原肽的工艺技术,鉴定胶原肽的氨基酸序列,并分析其理化特性,为低值海洋生物资源高值化利用提供理论指导和技术支撑。后续研究将会将胶原肽往功能食品、药品方向开发。
