甘草黄酮对大气细颗粒物PM2.5引起肺泡巨噬细胞损伤的保护作用
2019-07-10张汉语李超英
熊 琪,茹 琴,张汉语,陈 琳,周 梅,田 香,李超英,*
(1.江汉大学武汉生物医学研究院,湖北武汉 430056; 2.太和医院临床营养科,湖北十堰 442000)
大气细颗粒物(PM2.5)通过干扰肺部的气体交换,可引发肺部相关疾病的发生与发展,其主要表现在随着PM2.5浓度的增加诱发人体呼吸系统疾病和死亡率的明显上升[1-2]。肺泡巨噬细胞主要分布于呼吸道和肺泡表面,它是肺部重要的吞噬细胞,可首先吞噬外来颗粒物,再由溶酶体将颗粒物分解,从而减少由外来物质入侵引起的肺部损伤,因此肺泡巨噬细胞被称为肺部抵御外来物质入侵的第一道防线[3-4]。PM2.5污染对肺泡巨噬细胞造成不同程度的损伤,如降低其吞噬功能及释放各种炎性因子[5-6],因此研究PM2.5毒理效应及相关干预物质对肺泡巨噬细胞保护作用对降低呼吸系统疾病的发病率有重要的指导意义[7-8]。
甘草是我国珍贵的传统中药材,主要成分包括甘草酸、甘草次酸、黄酮等成分。甘草黄酮(licorice flavonoids)类物质是甘草中最重要的生理活性物质之一,大量研究证实其作用广泛,主要包括抗氧化、抗炎、抗肿瘤、调节血糖作用等,因此甘草黄酮广泛用于临床医药、保健食品、食品添加剂等方面[9-13]。然而目前甘草黄酮对细颗粒物导致的呼吸系统损伤研究尚无报道,因此,本研究旨在探讨甘草黄酮对细颗粒物引发的肺泡巨噬细胞损伤的保护作用,为今后细颗粒物PM2.5毒性防治工作及甘草黄酮的临床应用提供理论依据。
本实验以大鼠肺泡巨噬细胞(NR8383)为研究对象,细颗粒物标准品(SRM 2786)为干预物质,建立体外PM2.5染毒NR8383细胞的实验模型,通过初步对SRM 2786引发的NR8383细胞炎性损伤和氧化应激损伤的机制研究,探讨不同浓度的甘草黄酮对SRM 2786染毒后损伤NR8383细胞的保护作用。
1 材料与方法
1.1 材料与仪器
细颗粒物标准品SRM 2786 美国国家标准与技术研究所;大鼠肺泡巨噬细胞(NR8383) 中国科学院上海细胞库;甘草黄酮标准品(纯度为99%) 中国食品药品检定研究院;胎牛血清(FBS)、Kaighn’s Modification F-12K培养基、磷酸盐缓冲液(PBS)和青链霉素 美国Gibco公司;四甲基偶氮唑盐(MTT)试剂盒、二甲基亚砜(DMSO)及2,7-二氯荧光黄双乙酸盐(2,7-Dichlorodi-hydrofluorescein diacetate,DCFH-DA) 美国Sigma公司;超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)检测试剂盒 南京建成生物工程研究所;BCA蛋白测定试剂盒 武汉博士德生物有限公司;NO释放检测试剂盒 中国碧云天生物技术公司;荧光探针肿瘤坏死因-α(TNF-α)、白介素-6(IL-6)及白介素-1β(IL-1β)Elisa检测试剂盒 美国Biosource公司。
3308 CO2培养箱、1300 Series A2超净工作台、Multiskan Go全波长酶标仪、Fluoroskan Ascent FL荧光酶标仪 Thermo Scientific公司;ZOETMFluorescent Cell Imager细胞成像仪 Bio-Rad Laboratories Inc.;Avanti J-26 X高速离心机 Beckman Coulter Company;DD5台式低速离心机 湖南赫西仪器装备有限公司;HH S21-4S水浴锅 上海新苗医疗器械制造有限公司;UP-250超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 细颗粒物的来源及悬液制备 本实验所选用的细颗粒物标准品SRM 2786购于美国国家标准与技术研究所。其主要成分组成及成分分析详见于美国国家标准与技术研究所官方网站[14]。实验所用的SRM 2786均为现配现用,具体配制方法为将一定量的SRM 2786溶于F-12K完全培养基,配制成母液浓度为2000 μg/mL的SRM 2786储存液,经细胞破碎仪超声振荡混匀后(功率为100 W,超声破碎1 min),根据实验室前期实验结果[8],将其用F-12K完全培养基稀释为125 μg/mL的SRM 2786悬液。
1.2.2 甘草黄酮溶液的配制 将甘草黄酮溶于DMSO制成母液浓度为20 mg/mL的甘草黄酮储存液(DMSO浓度在甘草黄酮储存液中占比小于0.5%),再依次溶于F12K完全培养基配制成不同实验终浓度的甘草黄酮溶液,其浓度分别为1.56、3.125、6.25、12.5、25、50、100、200及400 μg/mL。
1.2.3 细胞培养 采用F-12K完全培养基(10%胎牛血清+100 U/mL青霉素+0.1 mg/mL链霉素溶液)对NR8383细胞进行培养。NR8383细胞为半贴壁半悬浮细胞,取生长融合度为80%~90%的细胞进行如下实验。
1.2.4 细胞活性的测定 取对数生长期的NR8383细胞(培养72 h后),将细胞接种于无菌96孔板(细胞密度为1×104cell/mL),置于37 ℃、5% CO2的培养箱24 h培养。24 h后分别将不同浓度的甘草黄酮(1.56、3.125、6.25、12.5、25、50、100、200及400 μg/mL),本实验将NR8383细胞分为6组,分别为含F12K培养基NR8383细胞对照组、125 μg/mL SRM 2786染毒NR8383细胞模型组、及经筛选出的合适浓度的甘草黄酮给药组(分别给予3.125、6.25、12.5、25 μg/mL,同时给予125 μg/mL SRM 2786),每组设3个复孔;同时,设置无细胞空白组(除对照组和空白组以外,其他各组均为样本组)。37 ℃、5% CO2的培养箱继续孵育细胞24 h培养后,光学显微镜下观察细胞形态并拍照每孔,随后每孔加入10 μL的MTT(5 mg/mL),放入培养箱继续培养4 h后,弃上清,每孔加入200 μL DMSO混匀,充分溶解细胞形成的结晶,采用酶联免疫检测仪(570 nm波长)测定吸光度(A)值,计算细胞存活率(%)=(样本组A值-空白组A值)/(对照组A值-空白组A值)×100。
1.2.5 细胞因子含量的测定 将对数生长期的NR8383细胞用移液枪反复吹打,收集细胞,室温1000 r/min离心6 min后将细胞接种于24孔板(细胞密度为1×105cell/mL),每孔加1 mL 溶于F12K培养基的细胞;24 h过夜培养后,弃去原F12K培养液,本实验将NR8383细胞分为6组,分别为含F12K培养基NR8383细胞对照组、125 μg/mL SRM 2786染毒NR8383细胞模型组、及经筛选出的合适浓度的甘草黄酮给药组(分别给予3.125、6.25、12.5、25 μg/mL,同时给予125 μg/mL SRM 2786),继续培养24 h,每组设置3个复孔;同时,1000 r/min离心6 min后,收集各组细胞上清液,根据Elisa试剂盒说明书测定各组细胞上清液中TNF-α、IL-6及IL-1β的含量。
1.2.6 NO释放测定 本实验采用硝酸还原酶化学比色法测定细胞上清液NO含量[15],将对数生长期的NR8383细胞接种于24孔板(细胞密度为1×105cell/mL),每孔加1 mL 溶于F12K培养基的细胞;24 h过夜培养后,弃去原F12K培养液,本实验将NR8383细胞分为6组,分别为含F12K培养基NR8383细胞对照组、125 μg/mL SRM 2786染毒NR8383细胞模型组、及经筛选出的合适浓度的甘草黄酮给药组(分别给予3.125、6.25、12.5、25 μg/mL,同时给予125 μg/mL SRM 2786),继续培养24 h,每组设置3个复孔;取各组细胞上清液50 μL,依次加入等量的Griess试剂I和Griess试剂II,利用酶联免疫检测仪在A540波长下测定吸光度,检测细胞上清液中NO的含量。
1.2.7 ROS释放测定 根据Kim实验室[16]ROS检测方法,用DCFH-DA荧光探针测定NR8383细胞内ROS释放水平,NR8383细胞处理及SRM 2786染毒组和甘草黄酮给药组的分组方式同上述实验方法一致(1.2.5~1.2.6)。将对数生长期的NR8383细胞接种于6孔板里(细胞密度为1×106cell/mL)各组细胞以1000 r/min转速离心6 min后,弃上清溶液,分别用PBS漂洗1次,随后加入终浓度为100 μmol/L的DCFH-DA(500 μL/孔),放入培养箱孵育1 h后,弃上清,用PBS漂洗各孔2次,最后用1 mL PBS重悬各孔细胞,收集细胞后,荧光酶标仪在激发波长485 nm,发射波长538 nm测定条件下测定各组吸光度值,每组做三个重复。
1.2.8 细胞中SOD及GSH-PX含量的测定 将对数生长期的NR8383细胞接种于6孔板里(细胞密度为1×106cell/mL),按照上述实验中(1.2.5~1.2.6)相同的给药及分组方法处理各组细胞后,收集细胞,室温下1000 r/min离心6 min,弃上清收集细胞,将300 μL PBS重悬各组细胞后,细胞超声破碎仪冰浴裂解各组细胞(20 kHz持续5 s破碎,间隔10 s,重复三次)。裂解完成后,将各组细胞离心(4 ℃高速12000×g离心15 min)后取上清,首先利用BCA试剂盒给两个实验中各组细胞测定蛋白浓度,然后分别严格按照SOD和GSH-PX提取试剂盒说明书操作,最终测定各组细胞中SOD与GSH-PX含量,每组做3个重复。
1.3 数据处理
2 结果与分析
2.1 甘草黄酮对NR8383细胞存活率的影响
MTT结果显示相较于对照组,当甘草黄酮浓度为3.125~25 μg/mL时,NR8383细胞存活率均有显著上升(见图1)(p<0.05);当甘草黄酮浓度分别为1.56、50、100、200及400 μg/mL时,细胞存活率相较于对照组均无显著改变(p>0.05)。因此,以甘草黄酮为3.125~25 μg/mL用于以下相关实验。
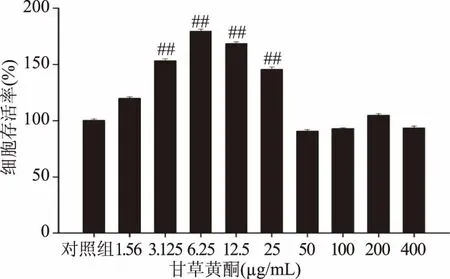
图1 甘草黄酮对NR8383细胞存活率的影响Fig.1 Effects of licorice flavonoids on NR8383 cell survival rates注:##与对照组相比,p<0.01;*与SRM 2786组相比,p<0.05; **与SRM 2786组相比,p<0.01;图2~图6、表1同。
2.2 甘草黄酮对SRM 2786干预后NR8383细胞存活率的影响
如图2所示,相较于对照组,125 μg/mL SRM 2786暴露组NR8383细胞的存活率降至56.11%±1.04%,差异极显著(p<0.01)。与125 μg/mL SRM 2786染毒相比,125 μg/mL SRM 2786与各浓度甘草黄酮共处理NR8383细胞的存活率均明显增高,且差异极显著(p<0.01)。
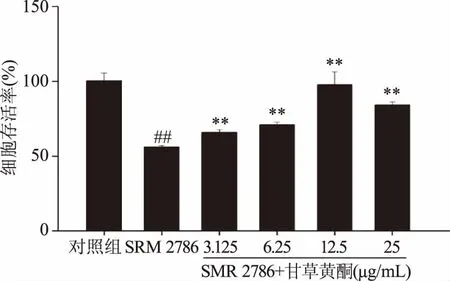
图2 甘草黄酮对125μg/mL SRM2786染毒NR8383细胞存活率的影响Fig.2 Effects of licorice flavonoids on NR8383 cell survival rates induced by 125 μg/mL SRM2786
2.3 甘草黄酮对SRM 2786干预后NR8383细胞形态的影响
如图3所示,SRM 2786处理NR8383模型组,相对于对照组,细胞表面明显有颗粒物SRM 2786附着,细胞间隙也存在大量颗粒物SRM 2786,除此之外模型组的细胞数量也显著减少,部分贴璧NR8383细胞也呈现悬浮状态;当加入不同浓度甘草黄酮后,相对于SRM 2786模型组,细胞数量均有显著性提高,且NR8383细胞贴璧数量变多,其次细胞间隙较为干净,表明甘草黄酮可促进NR8383细胞的吞噬作用清除部分颗粒物SRM 2786,从而提高细胞存活率,使细胞数目相较于模型组有了显著提高。此结果与本文中甘草黄酮对SRM 2786干预后NR8383细胞存活率的影响的结果也较为一致。
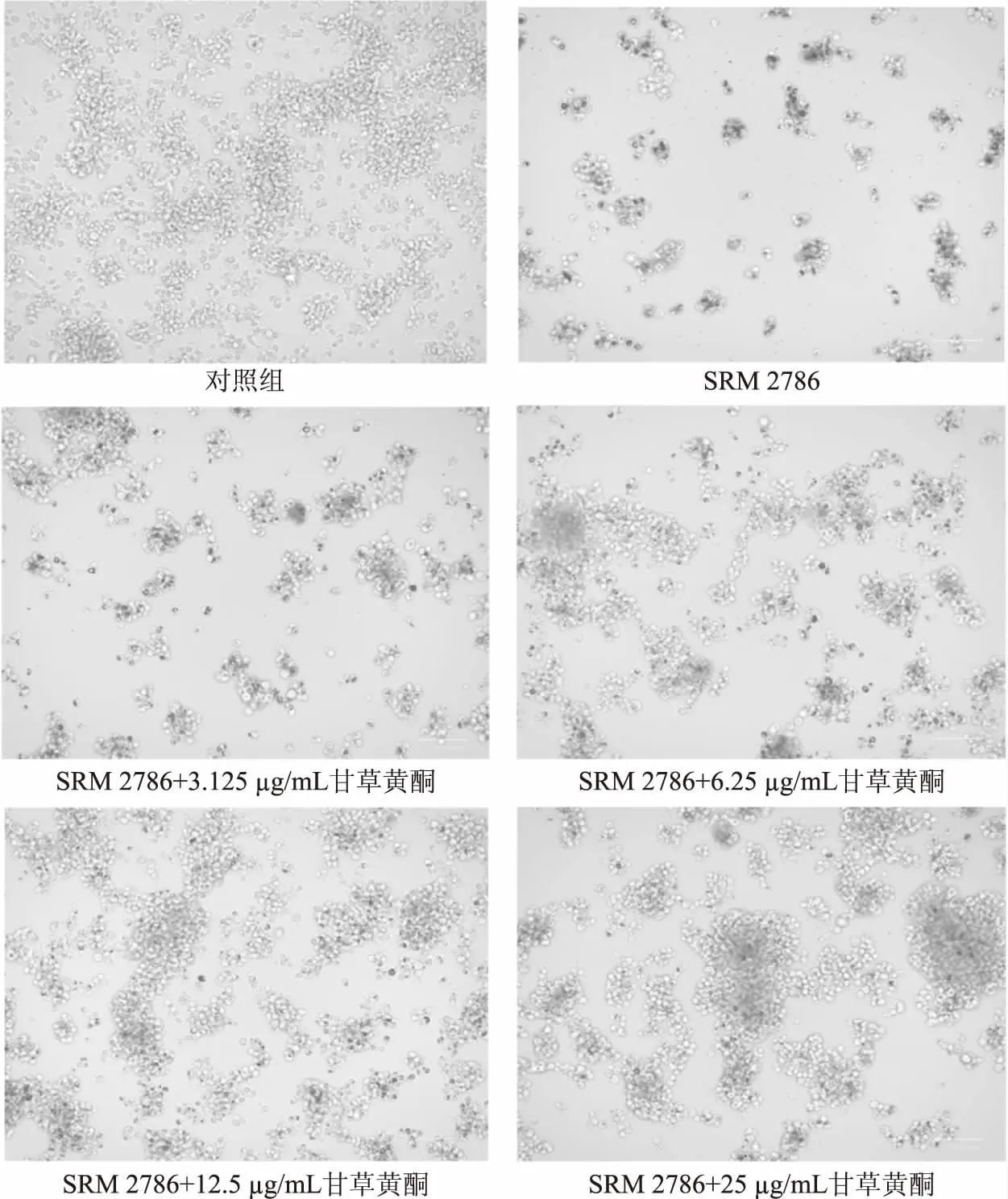
图3 NR8383细胞在SRM2786及甘草黄酮处理下的生长形态(100×)Fig.3 Growth morphology of NR8383 cells treated by SRM 2786 and licorice flavonoids(100×)
2.4 甘草黄酮对SRM 2786干预后NR8383细胞炎症因子释放的影响
颗粒物引发的细胞炎性损伤是参与细胞毒性损伤的重要机制之一[17]。管燕等[18]研究发现甘草黄酮对脂多糖诱导的小鼠肺部急性炎症有良好的保护作用。本研究首次探讨甘草黄酮对SRM 2786染毒后NR8383细胞的相关炎性因子释放的影响。表1中,与对照组相比,125 μg/mL SRM 2786处理NR8383模型组细胞上清液中的炎症因子(TNF-α、IL-6和IL-1β)含量均上升,且差异极显著(p<0.01)。与125 μg/mL SRM 2786模型组比较,125 μg/mL SRM 2786与各浓度甘草黄酮共处理NR8383细胞上清液中的TNF-α、IL-6和IL-1β含量均显著降低,且差异均为极显著(p<0.01)。
表1 甘草黄酮对SRM2786染毒NR8383细胞释放炎症因子的影响Table 1 Effects of licorice flavonoids on cytokine release induced by SRM2786 in NR8383
2.5 甘草黄酮对SRM 2786干预后NR8383细胞NO含量释放的影响
NO及其相关化合物不仅可以直接氧化内源抗氧化剂,还对过氧化氢酶等抗氧化性酶的活力有抑制作用,从而引发细胞氧化损伤[19-20]。NO是体内一种反应性极强的自由基,具有广泛的生理作用如图3所示,与对照组相比,125 μg/mL SRM 2786处理NR8383模型组细胞上清液中的NO释放有显著上升,且差异极显著(p<0.01)。然而125 μg/mL SRM 2786模型组与各浓度甘草黄酮共处理NR8383细胞上清液中的NO释放相较于125 μg/mL SRM 2786模型组均有降低,且当甘草黄酮浓度为6.25~12.5 μg/mL时,其差异显著(p<0.05),当甘草黄酮浓度为25 mg/mL时,其差异极显著(p<0.01)。
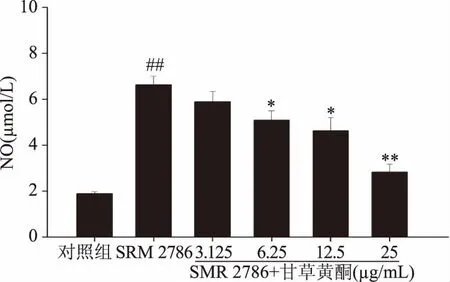
图4 不同浓度甘草黄酮与125μg/mL SRM2786对NR8383细胞NO释放影响Fig.4 The combined effect of different concentrations of licorice flavonoids and 125 μg/mL SRM 2786 on NO production in NR8383 cells
2.6 甘草黄酮对SRM 2786干预后NR8383细胞ROS含量释放的影响
如图5所示,相对于对照组,SRM 2786干预NR8383细胞模型组的ROS含量有了极显著提高(p<0.01),且随着甘草黄酮浓度的增加,NR8383细胞ROS含量的释放相对于SRM 2786模型组亦有极显著下降(p<0.01)。
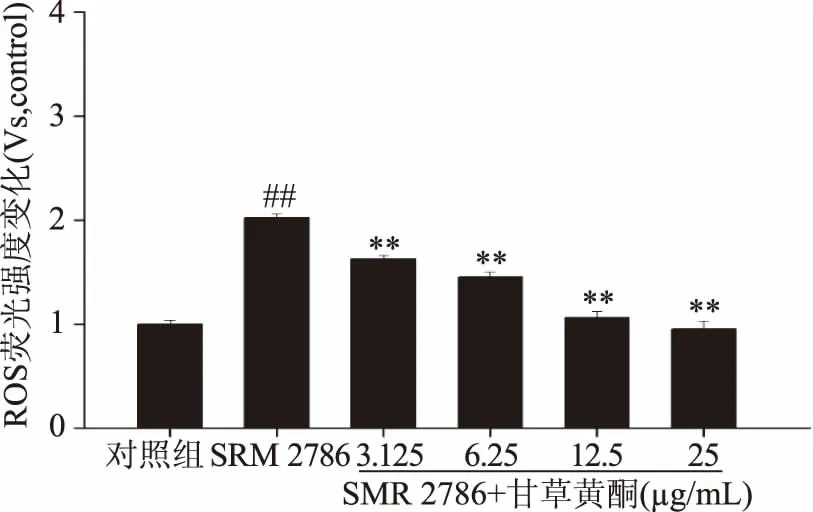
图5 不同浓度甘草黄酮与125μg/mL SRM2786对NR8383细胞ROS释放影响Fig.5 The combined effect of different concentrations of licorice flavonoids and 125 μg/mL SRM 2786 on ROS production in NR8383 cells
2.7 甘草黄酮对SRM 2786干预后NR8383细胞SOD活性和GSH-PX含量的影响
抗氧化酶(SOD和GSH-PX)能够有效抑制机体氧化作用,减少体内自由基堆积[21]。甘草黄酮对SRM 2786诱导NR8383细胞氧化应激相关酶活性如图6所示,SRM 2786模型组的SOD活性和GSH-PX含量相较于对照组有极显著降低(p<0.01);相较于SRM 2786模型组,不同浓度的甘草黄酮可以显著(p<0.05或极显著p<0.01)提高由SRM 2786导致NR8383细胞下降的SOD活性及GSH-PX含量。
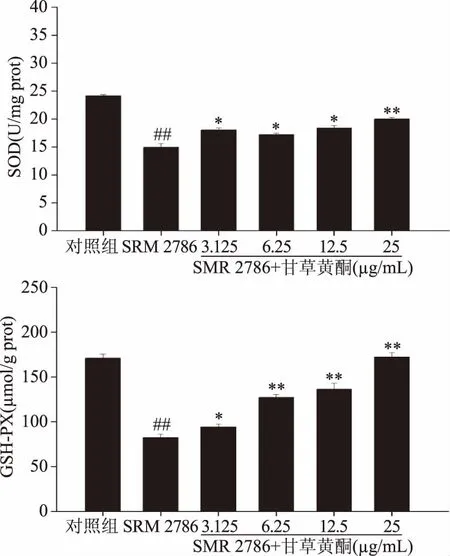
图6 不同浓度甘草黄酮与125μg/mL SRM2786对NR8383细胞SOD活性和GSH-PX含量的影响Fig.6 The combined effect of different concentrations of licorice flavonoids and 125 μg/mL SRM 2786 on SOD activities and GSH-PX contents in NR8383 cells
3 讨论与结论
研究证实,长期生活在高浓度的细颗粒物PM2.5的环境可能与肺炎及肺癌导致的死亡风险上升有关[22-23]。肺泡巨噬细胞不仅可用来准确评价细颗粒物毒性[24],也可用来研究如何降低细颗粒物对其损伤,从而对改善人体自身免疫力有重大意义。本实验室前期结果显示,细颗粒物标准品SRM 2786可使NR8383细胞线粒体发生机能紊乱及细胞凋亡,最终导致NR8383细胞的毒性损伤[25-27]。本实验结果显示SRM 2786染毒可显著降低NR8383细胞存活率、显著增加炎症因子释放(TNF-α、IL-6及IL-β)和氧化应激相关ROS及NO的释放,同时细胞中SOD活性和GSH-PX含量显著降低,因此进一步证实SRM 2786可通过氧化损伤和炎性损伤引起NR8383细胞毒性损伤。
黄酮类物质可显著改善肺间质纤维化的肺功能指标,同时对急性肺损伤也有显著保护作用[28-30]。王存良等[31]的动物实验证实甘草黄酮可通过增加肝癌荷瘤小鼠免疫细胞的数量而明显抑制肿瘤,然而甘草黄酮对肺泡巨噬细胞的影响目前尚无报道。因此,本研究主要探讨甘草黄酮对SRM 2786染毒后的NR8383细胞存活率、炎性损伤及氧化应激的影响。实验证实甘草黄酮可显著增加由SRM 2786导致降低的细胞存活率、显著降低ROS和NO释放及显著增加细胞SOD活性和GSH-PX含量,因此说明甘草黄酮通过降低细胞炎性损伤和氧化损伤对SRM 2786引起的NR8383细胞毒性损伤具有一定保护作用。
综上所述,本研究发现甘草黄酮对细颗粒物PM2.5引起的肺泡巨噬细胞损伤有保护作用,主要表现在提高细胞存活率、减少炎性因子(TNF-α、IL-6 和 IL-1β)、降低ROS和NO释放及增加细胞SOD活性和GSH-PX含量。其作用机制可能与抑制炎性损伤与氧化损伤相关,今后将对甘草黄酮的相关药理作用进一步深入研究,为其在细颗粒物损伤肺泡巨噬细胞的防治研究及富含甘草黄酮的相关新功能食品的开发提供实验理论依据。
