乙酰化降解海带多糖的抗氧化、吸湿/保湿性能探究
2019-07-10蔡婉静刘少伟施晓予
蔡婉静,刘少伟,李 苒,秦 天,施晓予
(华东理工大学生物工程学院,国家生物反应器重点实验室,上海 200237)
海带由于极易形成藻类生态系统,早已达到大规模的商业种植规模,其在东南亚地区的产量尤为丰富。据报道,至2016年底,我国的海带年产量已高达140余万吨[1],占据我国海藻养殖面积的31%。其富含硫酸多糖,又被称为褐藻糖胶,是海带主要的生物活性成分之一。海带多糖独特的硫酸根成分赋予其特殊的抗氧化、抗凝血、抗病毒能力。Peng等[2]的研究表明,从海带提取的多糖表现出显著的羟自由基和超氧自由基清除能力,将其制成天然的抗氧化剂或功能性食品原料,具有及其广阔的市场前景。
据相关研究表明,海带多糖的生物活性与其分子量、基团种类、硫酸基含量和多糖结构密切相关[3]。改性修饰可以改变多糖的结构构象及其基团种类,从而改善其生物活性[4]。根据原理,多糖的改性修饰可分为两类[5]:一种是通过物理或化学降解改变多糖的分子量大小,另一种是通过化学修饰引入新的官能团,从而改变其基团种类。目前,对海带多糖改性常采用单一方法改性,只改变海带多糖的分子量或者基团种类,这种改性方式受其原理限制,对多糖生物活性的提升效果有限,而采用降解和引入基团两种改性方式联合处理的改性研究目前尚未见报道。
为提高海带多糖的抗氧化活性及吸湿/保湿能力,本文将超声降解和醋酸酐法改性结合,联合处理得到乙酰化降解海带多糖,并对多糖体外抗氧化剂和吸湿/保湿活性进行测定比较,以期开发一款优质的食品抗氧化剂及生物美容原料。
1 材料与方法
1.1 材料与仪器
海带 购买自中国福建当地的农贸市场;乙醇、醋酸酐、氢氧化钠、盐酸、硫酸、苯酚、氯化钡、三氯乙酸、明胶、硫酸钾、葡萄糖、过氧化氢、硫酸亚铁、水杨酸、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯化铁、过硫酸铵、碳酸钠 均为分析纯,上海泰坦化学试剂有限公司;DPPH(1,1-二苯基-2-三硝基苯肼) TCL化成工业发展有限公司;甘油 上海凌峰化学试剂有限公司。
DHG-9123A电热恒温鼓风干燥箱 齐欣科学仪器(上海)有限公司;DL-5-B离心机 上海安亭科学仪器厂;YB700-B多功能高速粉碎机 永康市铂欧五金制品有限公司;旋转蒸发仪 上海申生科技有限公司;CP214C电子天平 奥豪斯仪器(上海)有限公司;85-2恒温磁力搅拌器 驰久仪器(上海)有限公司;UV-2000紫外可见分光光度计 尤尼克仪器(上海)有限公司;FE-20精密pH计 奥豪斯仪器(常州)有限公司;NDJ-8S自动粘度仪 捷护仪器(上海)有限公司;S-3400N SEM扫描电镜 日立仪器(日本)有限公司;KH-250B超声清洗仪 昆山禾创超声仪器有限公司。
1.2 实验方法
1.2.1 乙酰化降解海带多糖的制备
1.2.1.1 海带多糖的制备 采用水提醇沉法[6]制备海带多糖。将海带在80 ℃下热风干燥2 h,磨粉后过60目筛。将海带粉与蒸馏水按1∶50的料液比混合,80 ℃水浴条件下震荡提取4 h。提取结束后3500 r/min离心15 min,取上清液,减压浓缩至原体积1/3,加入95%乙醇直至溶液中乙醇浓度为30%,静置过夜(12 h)后3500 r/min离心15 min取上清液。在上清液中加入95%乙醇至溶液中乙醇浓度为70%,离心取沉淀,用95%乙醇充分洗涤后,于烘箱中50 ℃热风干燥至恒重,即得海带多糖(LP)。
1.2.1.2 降解海带多糖的制备 称取2 g LP,充分分散于200 mL蒸馏水中。将混合均匀的多糖溶液转移至300 mL锥形瓶中,将锥形瓶置于超声清洗仪中,在水浴温度50 ℃、功率150 W的条件下超声处理4 h。超声处理结束后,待其冷却至室温,旋转蒸发浓缩至原体积1/3,按1.2.1.1醇沉、离心、洗涤、烘干后,即得降解海带多糖(DLP)。
1.2.1.3 乙酰化降解海带多糖的制备 采用醋酸酐法[7]制备乙酰化降解海带多糖。称取2 g DLP,将其分散于200 mL NaOH溶液(pH=9.0)中,待多糖充分溶解后,分4次加入80 mL醋酸酐,在加入过程逐滴加入NaOH溶液(pH=9.0),控制反应液pH在8.0~8.5之间。将反应液在磁力搅拌条件下充分搅拌20 min,而后置于40 ℃水浴条件下反应2 h。反应结束后,待反应混合液冷却至室温后,逐滴加入HCl溶液(1.0 mol/L)直至反应液pH至7.0。3500 r/min离心10 min除去不可溶物质后,将所得上清液经浓缩、醇沉、离心、多次洗涤、干燥后,制备得到乙酰化降解海带多糖(ADLP)。
1.2.2 多糖化学组成测定 总糖含量采用苯酚-硫酸法测定[8],标准曲线:Y=11.649X+0.0092(R2=0.9991)。硫酸基团含量采用明胶-氯化钡法测定[9],标准曲线:Y=0.6117X+0.3633,(R2=0.9993)。乙酰基取代度测定采用中和滴定法[10],取代度(DS)计算公式如下:
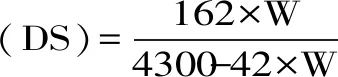
式(1)
其中,W为多糖样品中乙酰基团含量。
1.2.3 理化性质测定
1.2.3.1 溶解能力测定 多糖的溶解能力测定参照Kong等[11]提出的方法,以多糖完全溶解所需时间表征。量取50 mL蒸馏水置于烧杯中,加入0.01 g多糖样品,将混合物置于磁力搅拌器上搅拌溶解(150 r/min),直至多糖最终完全溶解。
1.2.3.2 相对粘度测定 多糖溶液相对粘度的测定参照Wu[12]提出的方法。使用自动粘度仪分别测定样品液(1 mg/mL)和去离子水的粘度,相对粘度即为样品溶液粘度和去离子水粘度的比值。
1.2.3.3 pH测定 将多糖配制成1 mg/mL的溶液,在室温条件下(25~30 ℃)使用FE-20精密pH计测定样品液pH。
1.2.4 表观结构观测 多糖样品的表观结构采用S-3400N SEM扫描电镜进行测量。将多糖样品用研钵研碎后,用导电胶粘贴于铝制置样台之上,喷金后进行电镜检测。
1.2.5 抗氧化能力测定
1.2.5.1 DPPH自由基清除能力测定 DPPH自由基清除能力的测定参照Cheng等[13]使用的方法,并采用常用抗氧化剂维生素C作为阳性对照。各取2 mL不同浓度的多糖待测液及维生素C溶液加入试管,再加入2 mL DPPH自由基反应液(6 mmol/L),混合均匀后于25 ℃避光条件下反应30 min,在517 nm处测定吸光度。以2 mL甲醇与2 mL DPPH自由基反应液的混合液作为对照实验;2 mL甲醇与2 mL待测样品液的混合液作为空白实验。DPPH自由基清除率按以下公式计算得到:
式(2)
式中:A1-待测样品吸光度值;A2-空白实验组吸光度值;A0-对照实验组吸光度值。
1.2.5.2 羟基自由基清除能力测定 羟基自由基清除能力按照Yue等[14]使用的方法,并在此基础上进行少量改动。各取2 mL不同浓度的多糖待测液,依次加入2 mL FeSO4溶液(6 mmol/L)、2 mL水杨酸溶液(6 mmol/L)、2 mL过氧化氢溶液(6 mmol/L),混合均匀后于37 ℃水浴条件下反应30 min,在510 nm处测定吸光度。将蒸馏水替代多糖样品溶液的反应液作为对照组,蒸馏水替代水杨酸的反应液作为空白组。羟基自由基清除率按照下式进行计算:
式(3)
其中:A1-待测样品吸光度值;A2-空白实验组吸光度值;A0-对照实验组吸光度值。
1.2.5.3 总还原能力测定 总还原能力的测定参照Cheng等[13]使用的方法,并进行了部分改动。分别吸取2 mL不同浓度的待测多糖溶液,加入0.5 mL磷酸缓冲液(pH=7.4)、1.5 mL铁氰化钾(0.3%),混合均匀后置于50 ℃水浴条件下反应10 min。反应完成后,取出2 mL反应液置于不同试管中,加入0.5 mL三氯化铁溶液,静置反应5 min后,于700 nm波长处测定吸光度。将蒸馏水替代磷酸缓冲液、铁氰化钾、三氯化铁的反应液作为空白组。
1.2.6 吸湿/保湿能力测定 参考Li等[15]在研究中采用的方法,并以常用保湿剂甘油[16]作为阳性对照。
1.2.6.1 吸湿能力测定 取0.100 g待测多糖样品、甘油置于扁形称量瓶中,将其放入置有饱和硫酸铵溶液(RH81%)和饱和碳酸钠溶液(RH43%)的干燥器内,室温下放置,并在2、4、8、12、24、36 h后测定样品重量。吸湿能力按照公式(4)计算:
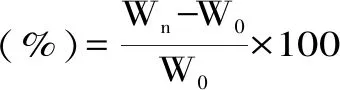
式(4)
其中:Wn-不同时间段样品的重量;W0-样品的初始重量。
1.2.6.2 保湿能力测定 取0.100 g待测多糖样品、甘油置于扁形称量瓶中,并分别加入样品质量3倍的去离子水,转动称量瓶直至样品将水分完全吸收。将称量瓶放入装有干燥完全的硅胶的干燥室内(RH,10%),于室温下放置,并在2、4、8、12、24、36 h后测定样品重量。保湿能力按照公式(5)计算:
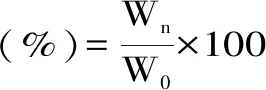
式(5)
其中:Wn-不同时间段样品的重量;W0-含水样品的初始重量。
1.3 数据处理
实验数据结果采用Excel 2013和SPSS 21软件处理。每组实验设置三个平行样本,实验结果以实验数据均值(Mean)±标准差(SD)的形式表示。数据的显著性差异检验采用t检验法。
2 结果与分析
2.1 多糖化学组成及理化性质分析结果
2.1.1 多糖化学组成分析 如表1所示,随着改性进程的逐步深入,多糖样品的总糖含量逐步减少,说明超声降解及乙酰化改性处理造成了多糖链的部分降解[17],从而引起多糖样品中的总糖含量降低。经过超声降解处理过后,ADLP、DLP的硫酸基团含量较LP略有上升,这可能是因为乙酰化改性及超声降解了部分多糖,且几乎没有破坏海带多糖的硫酸基团。ADLP的乙酰基团取代度(DS)达0.360,表明醋酸酐法已成功将乙酰基团引入DLP中。
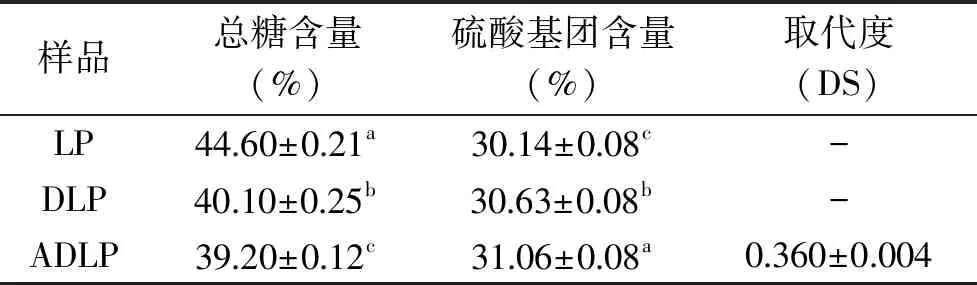
表1 三种多糖样品的主要成分分析Table 1 Main component analysis of three polysaccharide samples
2.1.2 理化性质分析 由图1可看出,LP、DLP、ADLP的水溶液pH分别为5.51±0.01、6.20±0.01、6.51±0.01,表明三种多糖均为中性物质,且在弱酸性溶液中稳定。LP、DLP、ADLP的溶解所需时间分别为(6.52±0.03)、(4.97±0.09)、(0.841±0.01) min(图1),表明降解及乙酰化改性均能提高海带多糖的溶解能力,同时,DLP和ADLP溶解能力的提高,暗示其生物活性能力也会相对应的提升[18]。LP、DLP以及ADLP的相对粘度值分别为(1.567±0.030)、(1.435±0.006)、(1.153±0.003)(如图1),ADLP的相对粘度为三者中最低。多糖的相对粘度与其分子链长度、柔韧性、以及分子链内部的相互作用力有关[19],较低的相对粘度间接表明ADLP的分子链长度是最低的,这一方面归功于ADLP的部分多糖链被乙酰化试剂降解,另一方面是因为乙酰基团的引入导致多糖链的充分伸展,导致多糖粘度下降[20]。
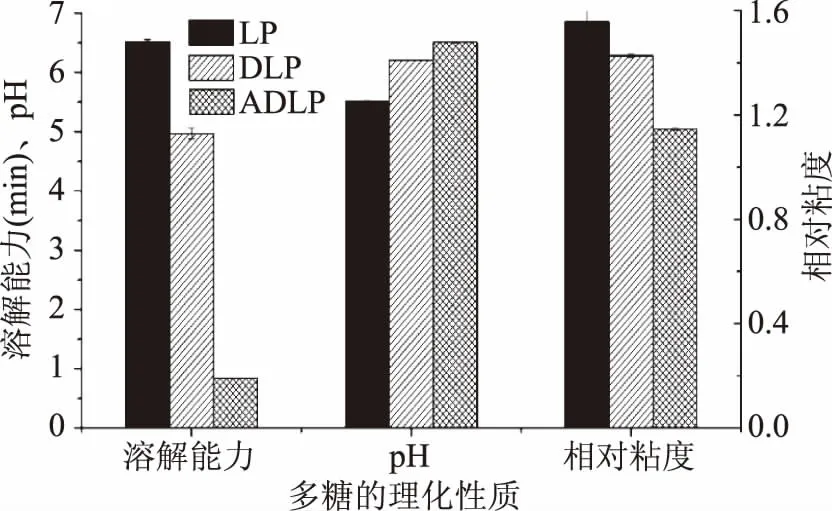
图1 海带多糖样品的溶解能力、pH及相对粘度Fig.1 Solubility,pH and relative viscosity of Laminaria japonica polysaccharide samples
2.1.3 表观/微观形态分析 由图2可以看出,LP、DLP在外观形态上都呈现不规则的块状形态,且两者的表面都较为光滑,DLP比LP稍显松散一些;相较于LP、DLP的块状形态,ADLP呈现更为松散的粉末形态。三种多糖样品的扫描电镜图如图3所示,在放大5000倍的情况下,LP的表面呈现光滑椭圆形态,并粘附有少量较小的LP;DLP的表面较LP更为粗糙,表明超声降解处理成功降解了部分多糖;而ADLP的表面更为粗糙并且呈现一定的孔状结构,这使得其具有更优异的水溶性以及更大的比表面积,并使多糖链中的活性基团能充分暴露并与自由基接触反应,从而提升了多糖的生物活性[21];与LP相比较,未经改性处理的LP,其表面更为光滑,且不具有多孔结构,这与其较低的水溶能力以及较高的相对粘度相一致。
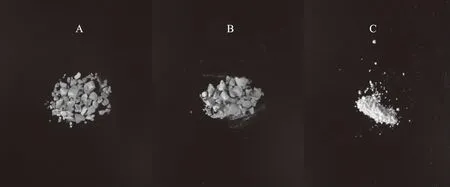
图2 海带多糖样品的表观图像Fig.2 Photograph of Laminaria japonica polysaccharide samples注:A-海带多糖LP;B-降解海带多糖DLP;C-乙酰化降解海带多糖ADLP;图3同。

图3 海带多糖样品的扫描电镜图(5000×)Fig.3 SEM images of Laminaria japonica polysaccharide samples(5000×)
2.2 抗氧化性能分析结果
以三种多糖为研究对象,并以常用抗氧化剂维生素C为阳性对照,利用DPPH自由基、羟基自由基、总还原能力反应体系评估三种多糖样品的抗氧化能力。
2.2.1 DPPH自由基清除能力 从图4可以看出,除LP外,其他几种样品对DPPH自由基清除率的影响均随样品浓度的增加呈现一定的剂量效应关系,即抗氧化能力随着浓度的升高而逐渐提高。如表2所示,根据拟合的回归方程,计算各样品的半数抑制率IC50,IC50越小表示其抗氧化能力越强。结果显示,DLP、ADLP DPPH自由基清除能力的IC50分别为9.070、6.060 mg/mL,由此可知,在一定的浓度范围内,三种多糖对DPPH自由基清除能力从大到小依次为:ADLP>DLP>LP,但三种多糖的DPPH自由基清除能力均弱于抗氧化剂维生素C。
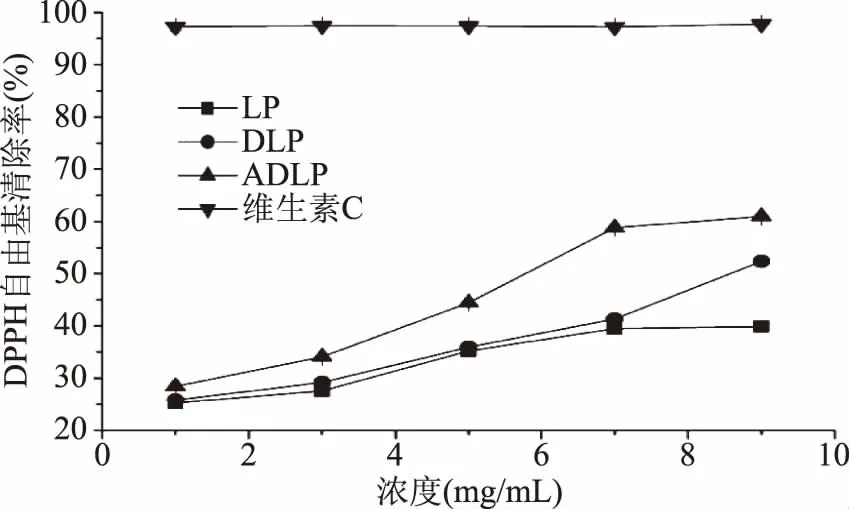
图4 海带多糖样品对DPPH自由基的清除能力Fig.4 DPPH radical scavenging abilities of Laminaria japonica polysaccharide samples
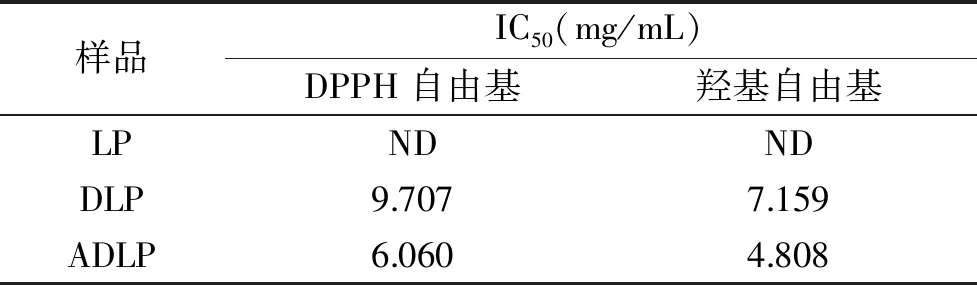
表2 海带多糖样品的抗氧化能力评价Table 2 Evaluation of antioxidant capacities of Laminaria japonica polysaccharide samples
LP及ADLP的DPPH自由基清除能力均强于普通海带多糖LP,说明超声降解及乙酰化处理均可有效提升海带多糖的抗氧化活性。降解处理可使多糖链降解,增加了多糖链数量,使得多糖链末端的还原端数量增多,从而提升了多糖的供氢能力,这与Xu等[22]以黑醋栗降解多糖为研究对象的实验结果相一致。此外,改性引入的乙酰基能活化多糖链中的异头碳,使得多糖的供氢能力提升,继而提升ADLP的DPPH自由基清除活性[23]。
2.2.2 羟基自由基清除能力 从图5中可以看出,三种海带多糖的羟基自由基清除活性也呈现比较明显的剂量效应关系。DLP、ADLP的IC50分别为7.159、4.808 mg/mL(表2),表明三种多糖对·OH自由基的清除活性从高至低依次为ADLP、DLP、LP,其中ADLP在溶液浓度为9 mg/mL时,其羟基自由基清除活性高达84.75%,但三种多糖的羟基自由基清除活性均低于维生素C(p<0.05)。
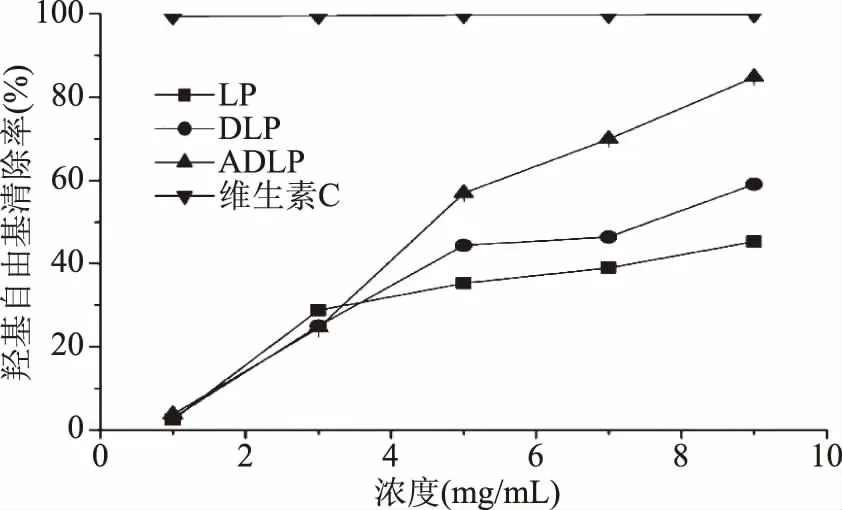
图5 海带多糖样品对羟基自由基的清除能力Fig.5 Hydroxyl radical scavenging abilities of Laminaria japonica polysaccharide samples
实验结果表明,降解及乙酰化过程均能有效提升海带多糖的羟基自由基清除活性,这与在DPPH自由基清除活性实验中观测得到的结果一致。羟基自由基的清除主要有两种机制[24]:(a)清除羟基自由基:抗氧化剂通过提供氢(H)离子将羟基自由基还原;(b)抑制羟基自由基产生:抗氧化剂与能活化H2O2的过渡金属离子(如Fe2+)螯合,从而抑制Fenton反应中羟基自由基的产生。超声降解处理提升海带多糖的羟基自由基清除活性,可能是由于降解处理使得多糖链断裂,使得多糖链末端的还原端数量增加,从而提升多糖的羟基自由基清除能力。而乙酰化处理提升海带多糖的羟基自由基清除活性的机制,则可能是由于改性引入的乙酰基团能与Fe2+离子螯合,抑制H2O2活化,从而抑制羟基自由基的产生,这与Shao等[25]在对浒苔多糖进行乙酰化改性后观测得到的结果一致。
2.2.3 总还原能力 从图6可看出,三者的总还原能力同样呈现明显的剂量效应关系。当样品浓度达9 mg/mL时,LP、DLP、ADLP的吸光度分别达到1.174、1.237、2.207。总体来说,三种海带多糖的总还原能力从大到小依次为ADLP>DLP>LP,且ADLP的总还原能力显著高于DLP与LP(p<0.05),而DLP与LP的总还原能力没有显著差异(p>0.05)。
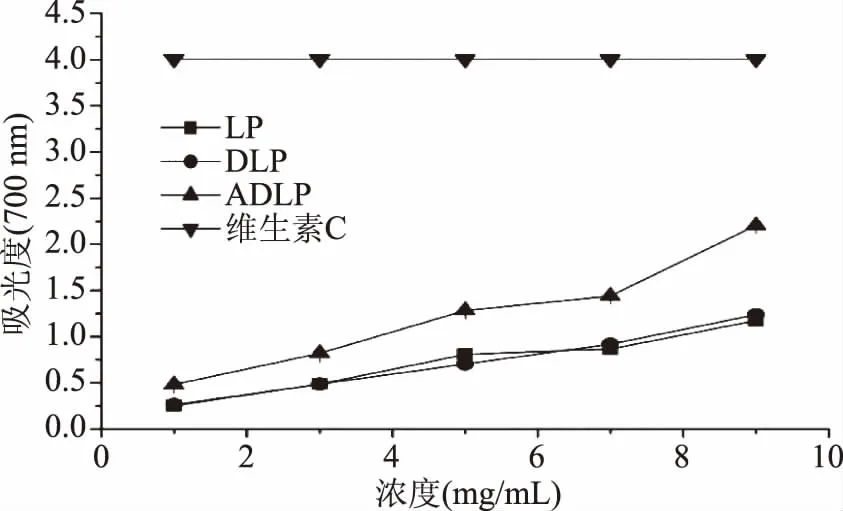
图6 海带多糖样品的总还原能力Fig.6 Reducing power of Laminaria japonica polysaccharide samples
实验结果表明,超声降解对于多糖的总还原能力没有太大影响,而乙酰化改性可以有效提高多糖的总还原能力。这主要是因为乙酰基团的引入使得多糖链结构变得更为舒展[26],赋予其更加优异的水溶性从而能在更高浓度条件下发挥生物活性;另一方面,更为舒展的结构使得多糖链中的活性基团(如羟基)得到充分暴露,从而能与自由基充分接触通过供氢作用达到还原效果[27]。
2.3 吸湿/保湿能力结果分析
2.3.1 吸湿能力 多糖的吸湿能力如图7所示。样品在两种湿度条件下的吸湿能力均表现一致,从大到小依次为甘油>DLP>ADLP>LP。在低湿度(RH43%)条件下,所有多糖样品的吸湿率都在前12 h内迅速上升,并在12 h后逐渐达到平衡,达到平衡后,LP、DLP、ADLP及甘油的吸湿率分别为15.67%、19.33%、17.67%、28.67%;而在高湿度(RH81%)条件下,所有多糖样品吸湿率则在24 h后达到饱和状态,LP、DLP、ADLP及甘油在饱和状态下的吸湿率分别为21.00%、27.33%、26.33%、50.33%,ADLP的吸湿率比LP高出25.4%,表明ADLP较LP具有良好的吸湿能力。
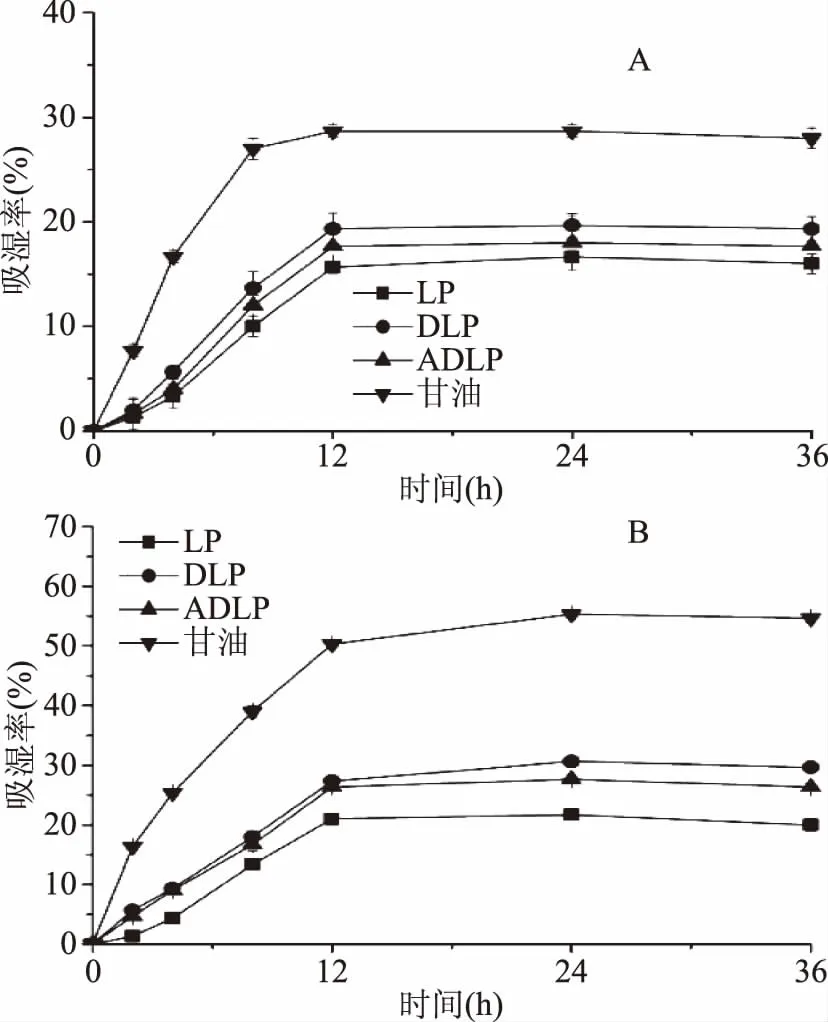
图7 海带多糖样品的吸湿能力(A-RH43%,B-RH81%)Fig.7 Moisture absorption capacities of Laminaria japonica polysaccharide samples(A-RH43%,B-RH81%)
实验结果显示,DLP和ADLP的吸湿能力显著高于LP(p<0.05),表明超声降解和乙酰化改性均能有效增强海带多糖的吸湿性。这一方面归功于超声降解处理能有效降低海带多糖的分子量,增加海带多糖链末端的吸收位点数量,从而增强其吸湿能力[28]。另一方面,这可能是由于乙酰化改性引入的乙酰基团能与水形成氢键,从而提升海带多糖的吸湿能力[25]。
2.3.2 保湿能力 从图8中可以看出,三种多糖样品和甘油在硅胶干燥环境(RH 10%)下,其保湿率在前12 h内均迅速下降,在12 h后下降速度明显变缓,并于24 h后达到平衡。在24 h后,LP、DLP、ADLP、甘油的保湿率分别为51.56%、53.51%、43.85%、42.19%。四者的保湿能力从大到小依次为DLP>LP>ADLP>甘油,三种多糖样品的保湿能力均优于甘油。结果表明,超声降解能有效提升海带多糖的保湿能力,而乙酰化改性对海带多糖保湿能力略有下降。这可能是由于改性过程中使用的乙酰化试剂破坏了海带多糖的部分三维结构,从而导致其持水能力下降[29]。
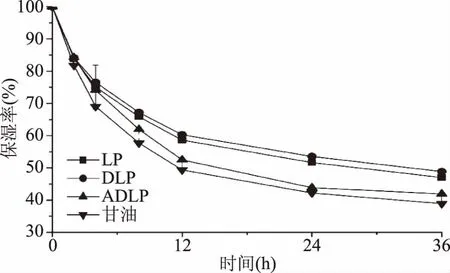
图8 海带多糖样品的保湿能力(RH10%)Fig.8 Moisture retention capacities of Laminaria japonica polysaccharide samples at RH 10%
3 结论
本文采用超声降解及乙酰化改性联合处理海带多糖,成功制备得到乙酰化降解海带多糖ADLP,并探究其抗氧化能力、吸湿/保湿能力变化。结果显示ADLP的抗氧化能力明显高于LP及DLP,表明超声降解及乙酰化改性联合处理可有效提升海带多糖的体外抗氧化能力。此外,ADLP表现出良好的吸湿/保湿能力,其吸湿能力优于普通海带多糖LP,保湿能力优于常用保湿剂甘油。研究结果表明,经由超声降解和乙酰化改性联合处理得到的ADLP是一种可被应用于食品保存或是生物美容的潜在待开发物质。
