超声波处理对蜂王浆蛋白功能和结构的影响
2019-07-10臧梦璐方诗文
王 艺,刘 帆,臧梦璐,方诗文,李 璇,薛 峰
(南京中医药大学药学院,江苏南京 210023)
蜂产品具有较高的营养价值和保健功效,因此被广泛用于人类的食品和药品中。目前,蜂产品主要包括蜂蜜、蜂花粉、蜂蜡和蜂王浆[1]。蜂王浆是工蜂体内腺体分泌的一种牛奶状粘稠液体,是蜜蜂幼虫的早期蜂粮和蜂王的终身蜂粮。新鲜蜂王浆的pH在3.6~4.2之间,其中水分含量60%~70%,蛋白质含量9%~18%,碳水化合物含量10%~16%[1]。蜂王浆中的蛋白质被认为是其主要的功能性成分,其主要由蜂王浆主蛋白构成(major royal jelly proteins MRJPs)。MRJPs是一个蛋白质家族,拥有10个家族成员(MRJPs1~MRJPs10),分子量分布在55~80 kDa[1]。国内外关于蜂王浆的产品较为单一,主要以鲜蜂王浆及其冻干粉为主。开展蜂王浆蛋白的相关研究,对于开发新型蜂王浆产品具有重要意义。
国内外关于蜂王浆蛋白(royal jelly proteins,RJPs)的研究主要集中在其制备工艺和生理活性方面。张越等建立了蜂王浆蛋白水提酸沉法的最优工艺[2]。Ramanathan等系统性地总结了蜂王浆蛋白的抗氧化、抗肿瘤、免疫调节等生理活性[1]。但是国内外关于蜂王浆蛋白的功能特性(溶解性、乳化性、起泡性以及疏水性等)的研究则鲜有报道。然而,蛋白质本身的功能特性是决定其应用领域的关键因素。因此,开展蜂王浆蛋白功能特性的研究,并利用蛋白质改性技术提高蜂王浆蛋白的各项功能特性,对于其在食品工业中的应用具有重大意义。
目前,蛋白质的改性技术主要包括化学改性、物理改性和酶法修饰[3-4]。在蛋白质改性技术中,利用等离子体、高压电场、电流体、脉冲电场和超声波等物理技术来改善蛋白质的功能特性成为当前研究的热点[5-6]。其中超声波(10~1000 W/cm2和20~100 kHz)技术被广泛应用于蛋白质改性中。例如:高场强超声波(20 kHz,200、400和600 W)被用于改善大豆蛋白的凝胶特性[7];超声波(20 kHz,120~1020 W)被用于改善花生蛋白的乳化性能[8]。此外,超声波还被用于提高美拉德反应速率和增加蛋白质水解度[9-10]。超声波所产生的空穴效应、机械效应、热效应和自由基效应,被认为是诱导蛋白结构发生改变的主要因素[11-12]。然而,目前关于超声波处理对蜂王浆蛋白结构和功能特性的影响尚不清楚。
基于上述原因,本实验以蜂王浆蛋白为对象,探讨超声波处理对其溶解性、乳化性、起泡性、酶解特性以及表面疏水性的影响。同时,通过对蜂王浆蛋白结构的研究,阐释超声波处理改善蜂王浆蛋白功能特性的机制,从而为拓展蜂王浆蛋白的应用领域提供理论依据。
1 材料与方法
1.1 材料与仪器
蜂王浆 南京老山药业股份有限公司;牛血清白蛋白标准品、碱性蛋白酶 上海源叶生物科技有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐 碧云天生物技术研究所;磷酸氢二钠、磷酸二氢钠 江苏永华化学科技有限公司;十二烷基磺酸钠 上海研拓生物科技有限公司;疏水荧光探针 梯希爱化成工业发展有限公司;铁氰化钾 国药集团化学试剂有限公司。
JY92-IIN型超声波细胞破碎仪 宁波新芝生物科技股份有限公司;紫外分光光度计 上海仪电分析仪器有限公司;PHS-25型pH计 上海经贸科学仪器有限公司;LD5-28型低温高速离心机 北京雷勃尔医疗器械有限公司;LGJ-18S型冻干机 北京松源华兴科技发展有限公司;FM200型高速剪切机 上海弗鲁克流体机械制造有限公司;Mos-450型圆儿色谱仪 法国Biologic公司;F-7000荧光光谱仪和S3400型扫描电镜 日本Hitachi公司;Spark10M型酶标仪 瑞士Tecan公司。
1.2 实验方法
1.2.1 蜂王浆蛋白的制备 采用水提酸沉法[2]。将100 g蜂王浆加入到2000 mL去离子水中,在室温下(25 ℃)机械搅拌30 min(150 r/min)。在10000×g下离心25 min,取上清液,采用1 mol/L和0.1 mol/L的HCl调节其pH为4.4。静置40 min后,在10000×g下离心25 min,收集沉淀。将沉淀复溶于去离子水中,采用1 mol/L和0.1 mol/L的NaOH调节其pH为7.0。经透析脱盐(24 h),冷冻干燥后于4 ℃保藏。
1.2.2 蜂王浆蛋白的超声波处理 采用去离子水配制蜂王浆蛋白溶液,浓度为5%。将100 mL上述蜂王浆蛋白溶液放置于超声波细胞破碎仪中,采用水浴的方式保持样品处于稳定的环境温度(25 ℃),超声波处理条件为:探头直径0.636 cm,频率20 kHz,输出功率200、400、600 W,时间20 min。样品处理结束后,采用冷冻干燥获得蜂王浆蛋白粉。同时,以未经过超声波处理的蜂王浆蛋白粉作为对照。
1.2.3 蛋白质溶解度的测定 采用去离子水配制浓度为2 mg/mL的蛋白溶液。取蛋白溶液2 mL,在12000×g下离心30 min。取上清液,采用Lowry法测定蛋白质浓度,同时以牛血清白蛋白为标准品,蛋白质溶解度(Solubility,%)按照如下公式计算。
溶解度(%)=(CS/C0)×100
式中,CS和C0分别代表上清液中蛋白质的浓度和样品蛋白质浓度(2 mg/mL)。蛋白质标准曲线方程为:y=7.5171x+0.0128,R2=0.9993。
1.2.4 蛋白质乳化性的测定 采用去离子水配制浓度为2 mg/mL的蛋白溶液。取上述蛋白溶液30 mL,加入10 mL大豆油,在高速剪切机中处理1 min形成乳液,剪切速率为24000 r/min。分别在0、10 min时,取50 μL乳液,加入5 mL十二烷基磺酸钠溶液(0.1%),混匀后在500 nm下检测吸光值[13]。样品乳化活性(emulsifying activity index,EAI)按照如下公式计算。
EAI(m2/g)={(4.606×A0)/[C×φ×θ×104]}×稀释倍数
式中,A0代表0 min时样品稀释液所测定的吸光值,C代表乳状液蛋白质浓度(g/mL),φ代表乳状液中油所占比例(v/v),θ代表光路(1 cm)。乳化稳定性(emulsifying stability index,ESI)按照如下公式计算。
ESI(min)=[A0/(A0-A10)]×10
式中,A0和A10分别代表0、10 min时样品稀释液所测定的吸光值。
1.2.5 蛋白质起泡性的测定 采用去离子水配制浓度为20 mg/mL的蛋白溶液。取上述样品溶液20 mL,至于100 mL量筒中,在高速剪切机中处理1 min,剪切速率为24000 r/min。记录所形成泡沫的体积,静置30 min后再次记录泡沫体积[14]。样品起泡性(foaming ability,FA)、起泡稳定性(foaming stability,FS)按照如下公式计算。
FA(%)=(V0/VS)×100
式中,VS和V0分别代表蛋白溶液的体积和所形成泡沫的体积。
FS(%)=(V30/V0)×100
式中,V0和V30分别代表0、30 min时泡沫的体积。
1.2.6 蛋白质水解度的测定 采用去离子水配制浓度为5%的蛋白溶液。将蛋白溶液放置于60 ℃水浴中,采用1、0.1 mol/L的NaOH溶液调整pH为8.5。按照2/0.1(底物/酶)的比例添加碱性蛋白酶,酶解时间为4 h。酶解结束后,沸水水浴15 min灭酶。冷却至室温后,用1、0.1 mol/L的HCl调整pH至4.4,在4000 r/min下离心30 min,取上清液用NaOH溶液调整pH至7.0,之后进行冷冻干燥。采用三硝基苯磺酸(TNBS)法对样品的水解度进行检测[14]。
1.2.7 蛋白质水解物抗氧化活性的测定 蛋白质水解物的制备参照1.2.6。按照文献[10]的方法,评价水解物对2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基的清除能力以及水解物的还原力。在ABTS自由基清除体系中水解物的浓度为0.5~2.5 mg/mL,在还原力测定体系中水解物的浓度为0.1~2.0 mg/mL。
1.2.8 蛋白质的圆二色谱分析 在室温下采用圆二色普仪对蛋白质二级结构的变化进行测定。采用0.01 mol/L的磷酸盐缓冲液(pH7.0)配制浓度为0.2 mg/mL的样品溶液。以磷酸盐缓冲液为空白,记录190~250 nm下该样品的色谱图。每组样品的测定重复5次。将所得到的样品的色谱数据输入CDPro计算机软件中(http://lamar. colostate. Edu/sreeram/CDPro/main. Html),由此可以计算蛋白质各二级结构的含量。
1.2.9 蛋白质表面疏水性的测定 利用8-苯胺基-1-萘磺酸钠(ANS)作为荧光探针来测定表面疏水性[15]。用0.2 mol/L磷酸盐缓冲溶液(pH7.5)分别配制不同浓度(0.05~1.00 mg/mL)的样品溶液。然后,在4 mL样品溶液中加入20 μL ANS(0.008 mol/L)。采用荧光光谱仪测定样品的荧光强度,激发波长为390 nm,发射波长为470 nm。用荧光强度值与蛋白质浓度绘制曲线,求得曲线的斜率值,即为表面疏水性值。
1.2.10 蛋白质内源荧光光谱分析 采用0.01 mol/L的磷酸盐缓冲液中(pH7.0),配制蛋白质浓度为0.15 mg/mL的样品溶液。检测该样品在290 nm激发下300~400 nm之间的荧光光谱,扫描速率10 nm/s。
1.2.11 蛋白质的扫描电镜分析 蛋白质粉末经喷金处理后,采用扫描电镜观察其微观结构。
1.3 数据处理
每个样品平行测定3次,所获得的数据利用SPSS 17.0软件进行平均值计算和方差分析。
2 结果与分析
2.1 超声波处理对蜂王浆蛋白溶解度的影响
图1为超声波处理对蜂王浆蛋白质溶解度的影响。由图1可知,与对照组相比较,超声波处理可以显著(p<0.05)提高蜂王浆蛋白的溶解度。且蜂王浆蛋白经400 W处理后,呈现较高的溶解度,相比对照组增加了10.90%,而继续增加超声波功率(600 W),则会导致溶解度的下降,但仍显著高于对照组(p<0.05)。超声波处理可以改善蛋白质的溶解度,主要是由于超声波处理可以增加蛋白质表面的可溶性基团,继而增加了蛋白质与水分子之间的亲和力[16]。然而,较高功率(600 W)的超声波处理所导致的溶解度下降,主要是因为高功率的超声波处理可以诱导蛋白质之间发生非共价交联,产生大分子聚集体,继而降低蛋白质的溶解度[17]。

图1 超声波处理对蜂王浆蛋白质溶解度的影响Fig.1 Effect of ultrasound treatment on the solubility of royal jelly proteins注:不同字母表示差异显著(p<0.05);图2~图4、图7同。
2.2 超声波处理对蜂王浆蛋白乳化性的影响
图2为超声波处理对蜂王浆蛋白质乳化活性和乳化稳定性的影响。由图2所示,与对照组相比较,超声波处理可以显著(p<0.05)提高蜂王浆蛋白的乳化活性和乳化稳定性。这一结果与前人的研究相一致,即超声波处理(20 kHz,34~48 W/cm2,20/40 min)可以显著改善卵清蛋白的乳化性能[18]。此外,蜂王浆蛋白经400 W处理后,呈现较高的乳化活性和乳化稳定性,相比对照组,乳化活性增加了67.18%,乳化稳定性增加了15.87%,而继续增加超声波功率(600 W)则会导致乳化性的下降。超声波处理可以改善蛋白质的乳化特性,主要是由于超声波处理可以在蛋白质溶液中产生局部的极端温度和压力,继而诱导蛋白质的高级结构发生变化,使得蛋白质的结构向着更加无序化的方向发展,从而有利于蛋白质在油水界面形成吸附层[8]。此外,超声波处理所产生的机械效应和空穴效应可以增加蛋白质分子的流动性,从而有利于提高蛋白质在油水界面形成吸附层的速率[19]。较高功率(600 W)的超声波处理所导致的乳化特性的下降,可能与高功率的超声波处理所导致的溶解性的下降和大分子聚集体的产生有关。
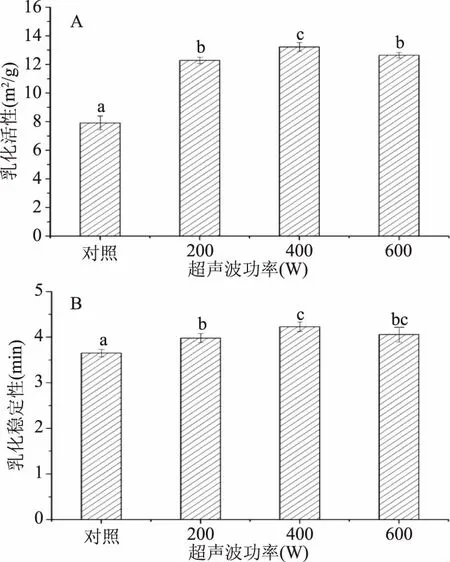
图2 超声波处理对蜂王浆蛋白质乳化活性(A)和乳化稳定性(B)的影响Fig.2 Effects of ultrasound treatment on the emulsifying activity index(A) and emulsion stability index(B)of royal jelly proteins
2.3 超声波处理对蜂王浆蛋白起泡性的影响
图3为超声波处理对蜂王浆蛋白质起泡性和起泡稳定性的影响。由图3可知,与对照组相比较,较低功率(200 W)的超声波处理对蜂王浆蛋白起泡性的影响不显著(p<0.05),较高功率(400、600 W)的超声波处理可以显著(p<0.05)提高蜂王浆蛋白的起泡性和起泡稳定性。此外,蜂王浆蛋白经400 W处理后,呈现较高的起泡性和起泡稳定性,相比对照组,起泡性增加了60.00%,起泡稳定性增加了118.75%,而继续增加超声波功率(600 W)则会导致起泡性能的下降。超声波处理可以改善蛋白质的起泡性能,主要是由于超声波处理可以降低蛋白质粒径分布,继而增强蛋白质在水/空气界面的吸附能力[20]。此外,超声波处理还可增强蛋白质所形成泡沫的内聚力,从而表现出较好的起泡稳定性[21]。较高功率(600 W)的超声波处理所导致的起泡性能的下降,可能与高功率的超声波处理所导致的蛋白分子聚集体的产生有关,这一结果与超声波处理对蜂王浆蛋白乳化性能的影响相一致。

图3 超声波处理对蜂王浆蛋白质起泡性(A)和起泡稳定性(B)的影响Fig.3 Effects of ultrasound treatment on the foaming property(A)and foaming stability(B)of royal jelly proteins
2.4 超声波处理对蜂王浆蛋白水解度的影响
图4为超声波处理对蜂王浆蛋白质水解度的影响。由图4可知,与对照组相比较,超声波处理可以显著(p<0.05)提高蜂王浆蛋白的水解度。此外,蜂王浆蛋白经400 W处理后,呈现较高的水解度,相比对照组增加了83.33%,而继续增加超声波功率(600 W)则会导致水解度的下降。超声波处理可以改善蛋白质的水解度,主要是由于在高水分活度的体系中,超声波的机械效应、热效应和化学效应可导致局部出现极高的压力和温度。而蛋白质在这种条件下容易发生去折叠化,从而暴露出更多的基团,继而提高与酶之间的亲和性[22]。较高功率(600 W)的超声波处理所导致的水解度的下降,可能与高功率的超声波处理所引起的蛋白质溶解性下降有关。

图4 超声波处理对蜂王浆蛋白质水解度的影响Fig.4 Effect of ultrasound treatment on the hydrolysis degree of royal jelly proteins
2.5 超声波处理对蜂王浆蛋白酶解物抗氧化活性的影响
图5为超声波处理对蜂王浆蛋白水解物清除ABTS自由基和还原力的影响。由图5可知,蜂王浆蛋白水解物在所测定的浓度范围内,其自由基清除能力和还原力随着浓度的增加而增强。与对照组相比较,超声波处理可以显著(p<0.05)改善水解物的抗氧化活性。这一结果说明,超声波处理有助于释放具有抗氧化活性的多肽。此外,蜂王浆蛋白经400 W处理后,所获得的水解物呈现较高的自由基清除能力和还原力,而继续增加超声波功率(600 W)则会导致水解物抗氧化能力的下降。这一规律与超声波处理对蜂王浆蛋白水解度的影响相一致,即蜂王浆蛋白经过400 W处理后呈现较高的水解度,从而表现出较好的抗氧化活性。这一结论与前人的研究结果相一致,即多肽的生物活性与其水解度之间呈现显著相关性[23-24]。

图5 超声波处理对蜂王浆蛋白水解物清除ABTS自由基(A)和还原力(B)的影响Fig.5 Effects of ultrasound treatment on the ABTS radical scavenging activity(A) and reducing power(B)of royal jelly proteins注:相同浓度下的不同字母表示差异显著(p<0.05)。
2.6 超声波处理对蜂王浆蛋白二级结构的影响
图6和表1为超声波处理对蜂王浆蛋白二级结构及其含量的影响。如图6和表1所示,与对照组相比较,超声波处理可以改变蜂王浆蛋白中α-螺旋、β-折叠、β-转角和无规则卷曲的含量,但是并未呈现特定的规律。总体而言,蜂王浆蛋白经超声处理后,α-螺旋含量降低,无规则卷曲含量增加。此外,蜂王浆蛋白经400 W处理后,其无规则卷曲含量(31.6%)高于其他样品。这一结果表明,蜂王浆蛋白经400 W处理后,其蛋白质呈现出较为松散的结构。而这种松散的结构则有助于提高蛋白质的溶解性、乳化性、起泡性以及水解度。

图6 超声波处理对蜂王浆蛋白二级结构的影响Fig.6 Effects of ultrasound treatment on the secondary structure of royal jelly proteins

表1 超声波处理对蜂王浆蛋白α-螺旋、β-折叠、β-转角和无规则卷曲的含量的影响Table 1 Effects of ultrasound treatment on the content of α-helix,β-sheet,β-turn and random coil in royal jelly proteins
2.7 超声波处理对蜂王浆蛋白表面疏水性的影响
图7为超声波处理对蜂王浆蛋白表面疏水性的影响。由图7可知,与对照组相比较,超声波处理可以显著(p<0.05)增加蜂王浆蛋白的表面疏水性。此外,蜂王浆蛋白经400 W处理后,拥有较高的表面疏水性,相比对照组增加了18.65%,而继续增加超声波功率(600 W)则会导致表面疏水性的下降。超声波处理可以增加蛋白质的表面疏水性,主要是由于超声波处理可以诱导蛋白质的去折叠化,从而使得内部疏水基团得以暴露[25]。而蛋白质内部疏水基团的暴露也是其乳化性得以改善的主要原因。较高功率(600 W)的超声波处理所导致的表面疏水性的下降,可能与高功率的超声波处理所引起的蛋白质聚集有关。

图7 超声波处理对蜂王浆蛋白表面疏水性的影响Fig.7 Effect of ultrasound treatment on the surface hydrophobicity of royal jelly proteins
2.8 超声波处理对蜂王浆蛋白内源荧光光谱的影响
图8为超声波处理对蜂王浆蛋白内源荧光光谱的影响。由图8可知,与对照组相比较,超声波处理可以降低蛋白质的荧光强度。蜂王浆蛋白经400 W处理后,呈现较弱的荧光强度,而继续增加超声波功率(600 W)则会导致荧光强度的增加。超声波处理可以降低蛋白质的内源荧光强度,主要是由于超声波处理可以诱导蛋白质分子内发色团的暴露。而内部基团的暴露可以进一步证明蛋白质构象的变化。此外,超声波处理使得蛋白质的λmax发生红移。这一结果可以进一步说明,超声波处理可以诱导蛋白质的三级结构发生变化[26]。较高功率(600 W)的超声波处理所导致的内源荧光强度的增加,可能与高功率的超声波处理所引起的蛋白质聚集有关。
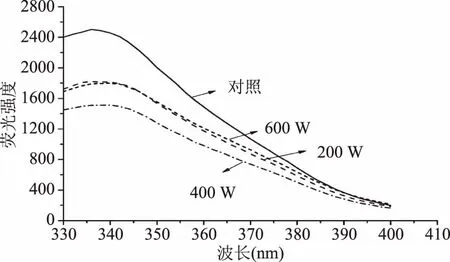
图8 超声波处理对蜂王浆蛋白内源荧光光谱的影响Fig.8 Effects of ultrasound treatment on the intrinsic fluorescence emission spectra of royal jelly proteins
2.9 超声波处理对蜂王浆蛋白微观结构的影响
图9为不同功率超声波处理对蜂王浆蛋白微观结构的影响。由图9可知,对照组的蜂王浆蛋白结构紧致,表面平整。经过超声波处理后,蛋白质结构呈现无序化,表面变得粗糙。这种无序和粗糙的结构增加了蛋白质的比表面积,同时暴露出更多的酶切位点,从而有利于提高其水解度。此外,蜂王浆蛋白经400 W处理后,其碎片化程度增加,从而有助于提高其溶解性。然而,继续增加超声波功率(600 W)则会导致聚集体的出现。这可能是因为蛋白质分子内部疏水基团的过度暴露,使得分子间通过疏水相互作用力形成聚集体,从而降低了蛋白质的溶解性和乳化性。

图9 不同功率超声波处理对蜂王浆蛋白微观结构的影响Fig.9 Effects of ultrasound treatment with different levels of power output on the microstructure of royal jelly proteins
3 结论
本研究发现,超声波功率明显影响蜂王浆蛋白的功能特性。蜂王浆蛋白经过400 W超声波处理后,溶解性增加了10.90%,乳化活性增加了67.18%,乳化稳定性增加了15.87%,起泡性增加了60.00%,起泡稳定性增加了118.75%,水解度增加了83.33%,表面疏水性增加了18.65%,表明其溶解性、乳化性、起泡性以及水解度均得到明显改善。与对照组相比较,超声波处理可以显著(p<0.05)改善水解物的抗氧化活性。以上功能特性的变化可能与超声波处理所导致的蛋白质的二级结构、三级结构和微观结构变化有关,即超声波处理可以诱导的蛋白质发生去折叠化。这些结果表明,超声波处理所诱导的蛋白质构象的变化,是其功能特性得以改善的主要原因。然而,本研究仅在固定频率下探讨不同功率对蛋白质功能及结构的影响。未来的研究还需要考虑不同频率下,超声波处理对蛋白质结构及功能的影响规律,从而为超声波技术在蜂王浆蛋白改性中的应用提供技术支撑。
