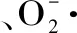梅鱼内脏酶解液美拉德反应工艺优化及挥发性物质分析
2019-07-10徐静馨邓尚贵
徐静馨,陈 静,2,*,唐 琪,邓尚贵,2
(1.浙江海洋大学食品与医药学院,浙江舟山 316022; 2.浙江省海产品健康危害因素关键技术研究重点实验室,浙江舟山 316000)
美拉德反应又称为“非酶棕色化反应”,是一种广泛存在于食品工业的非酶褐变,是羰基化合物和氨基化合物间的反应,所以又称羰氨反应。美拉德反应是食品加工过程中产生诱人色泽和各种芳香风味的主要原因,也是目前各种香精制备的主要工艺。目前,国内外有很多关于美拉德反应的报道[1-2]。近几年的研究发现,美拉德反应产物可以改善反应底物原有的生物活性,赋予其抗氧化、降血压、抗菌活性、抗癌、抗诱变等多种生物活性[3-5]。
梅鱼作为我国主要的海洋加工鱼类,产量和需求量相当大。在加工生产中,作为下脚料的鱼头、鱼骨和内脏往往被加工成鱼粉或直接作为废物被处理,造成大量的浪费,高值化利用程度较低。因此综合利用梅鱼下脚料,提高梅鱼下脚料高值化利用具有重要意义。目前,将水产品下脚料酶解液与适当的还原糖通过美拉德反应制备具有风味独特的调味品受到广泛关注。如刘安军等[6]以带鱼下脚料酶解液为原料,添加一定比例的还原糖和氨基酸,通过美拉德反应制备香精;董志俭等[7]以鱿鱼内脏酶解液为基料,利用美拉德反应制备鱿鱼味香精;从艳君等[8]将草鱼内脏蛋白酶解液与葡萄糖进行美拉德反应后制备出了风味良好的调味基料。目前,利用梅鱼内脏酶解液为基料,与还原糖进行美拉德反应制备风味物鲜有报道。
1 材料与方法
1.1 材料与仪器
梅鱼内脏 浙江兴业集团有限公司,冰藏条件下当日运至实验室进行实验;木瓜蛋白酶(酶活力1000 U/mg) 上海金穗生物科技有限公司;其它试剂 均为市售分析纯;实验用水 为蒸馏水。
HWS-12电热恒温水浴锅 上海齐欣科学仪器有限公司;CR21G型冷冻离心机 日本日立公司;DZF-6021型真空干燥箱 上海一恒科技有限公司;S-3C型pH计 上海虹益仪器仪表有限公司;高速低温离心机A1301019 上海艾测电子科技公司;TM-767型搅拌机 中山市海盘电器有限公司;AR124CN 电子天平 奥豪斯仪器有限公司;UV1100紫外分光光度计 上海美普达公司;75 μm CAR/PDMS/DVB萃取纤维头 美国SUPELCO公司;HP-INNOWAXS毛细管柱(30 m×0.25 mm×0.25 μm) 美国Agilent公司SHIMADZU;Agilent 7890A/5975C气-质联用仪 美国Agilent公司。
1.2 实验方法
1.2.1 梅鱼内脏的酶解 参考刘建伟等[28]的方法,改进后称取50 g梅鱼内脏放入烧杯中,按料液比1∶10 (m/v)加入蒸馏水,经高速匀浆后用氢氧化钠溶液调节pH至6.5,加入1 g木瓜蛋白酶后搅拌均匀,在55 ℃条件下恒温酶解5 h,酶解结束后,将酶解液在沸水浴中灭酶20 min,8000 r/min离心20 min,除去悬浮物,过滤,所得滤液即为梅鱼内脏酶解液。
1.2.2 梅鱼内脏酶解液美拉德反应的单因素实验
1.2.2.1 糖种类和比例对梅鱼内脏酶解液美拉德产物的影响 量取20 mL的上述酶解液于烧杯中,将酶解液用氢氧化钠溶液pH调至7,分别添加0.6、0.8、1.0、1.2、1.4和1.6 g的葡萄糖或木糖,或加入总量1 g的不同比例(葡萄糖和木糖的配比为4∶1、3∶2、1∶1、2∶3和1∶4)的混合糖,封口置于真空干燥箱中,在100 ℃下反应100 min,冷却后,用紫外分光光度计在420 nm[9]处测量吸光度,用以表示美拉德反应产物褐变程度,并进行感官评分。
1.2.2.2 pH对梅鱼内脏酶解液美拉德产物的影响 量取20 mL的上述酶解液于烧杯中,加入5%葡萄糖搅拌均匀,调节pH分别至5、6、7、8、9和10,封口置于真空干燥箱中,将酶解液在100 ℃下反应100 min,冷却后,用紫外分光光度计在420 nm处测量吸光度,用以表示美拉德反应产物褐变程度,并进行感官评分。
1.2.2.3 反应时间对梅鱼内脏酶解液美拉德产物的影响 量取20 mL的上述酶解液于烧杯中,将酶解液pH调至7,加入5%葡萄糖搅拌均匀,封口置于真空干燥箱中,在100 ℃下分别反应20、40、60、80、100和120 min,冷却后,用紫外分光光度计在420 nm处测量吸光度,用以表示美拉德反应产物褐变程度,并进行感官评分。
1.2.2.4 温度对梅鱼内脏酶解液美拉德产物的影响 量取20 mL的上述酶解液于烧杯中,将酶解液pH调至7,加入5%葡萄糖搅拌均匀,封口置于真空干燥箱中,分别在70、80、90、100、100和120 ℃下反应60 min,冷却后,用紫外分光光度计在420 nm处测量吸光度,用以表示美拉德反应产物褐变程度,并进行感官评分。
1.2.3 正交试验 在上述单因素实验的基础上,以感官评分作为考察指标,对pH、温度、时间和糖混合比例采用四因素三水平正交表对反应条件进一步优化,其因素水平表如表1。
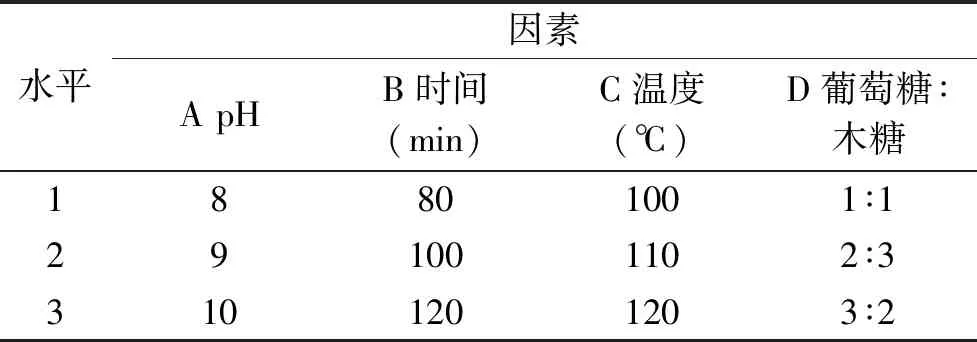
表1 正交因素及水平表Table 1 Factors and levels of orthogonal experiment
1.2.4 美拉德反应产物感官评定 感官评定采用评分检验法[10]。挑选食品专业的10名感官评定人员,评价指标用鱼腥味、香味、刺激气味等来表示(表2),对美拉德反应产物的样品逐个进行评分,最终得出感官综合评分。

表2 感官评分标准Table 2 The standard of sensory evaluation
1.2.5 美拉德反应产物的挥发性物质测定
1.2.5.1 顶空固相微萃取法(HS-SPME)提取挥发性成分 称取5 g最优条件下制得的样品置于20 mL顶空瓶中,密封,于50 ℃磁力搅拌器中加热平衡20 min,用活化后的75 μm CAR/PDMS/DVB萃取纤维头顶空吸附30 min后,将萃取头插入GC进样口解析,进入GC-MS 进行分离与分析[11]。
1.2.5.2 气相色谱-质谱(GC-MS)条件 色谱条件:色谱柱:HP-INNOWAXS毛细管柱(30 m×0.25 mm×0.25 μm);载气:高纯He;载气流速1.0 mL/min;进样口温度250 ℃;分流比5∶1进样;升温程序:起始温度为40 ℃,保持5 min,以8 ℃/min升至250 ℃,保持5 min。质谱条件:电离方式EI;电子能量70 eV;电压1800 V;连接口温度250 ℃;离子源温度230 ℃;四极杆温度150 ℃;质量扫描范围30~500 m/z;质量扫描速率10000 amu/s。
1.2.6 梅鱼内脏酶解液及其美拉德反应产物抗氧化活性的测定
1.2.6.1 羟自由基(·OH)清除率的测定 取一支10 mL试管,分别加入1 mL 0.75 mmol/L邻二氮菲溶液、2 mL磷酸缓冲液(pH7.4)和1 mL去离子水,混匀之后,再加入1 mL 0.75 mmol/L硫酸亚铁溶液,加入1 mL双氧水(0.12%,新鲜配制),混匀,在37 ℃水浴锅中60 min,用去离子水调零,在536 nm处测定吸光度值,记作Ap;将1 mL双氧水换做1 mL去离子水,记作Ab;将1 mL去离子水换做1 mL酶解液,记作As[12]。
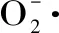
式中:Ao为空白的吸光度;Ai为样液的吸光度;Aj为酶解液的吸光度。
1.2.6.3 DPPH自由基(DPPH·)清除率的测定 1 mL DPPH无水乙醇溶液(10 mmol/L)+1 mL样液作为实验组;1 mL DPPH无水乙醇溶液+1 mL去离子水作为对照组;1 mL无水乙醇+1 mL样液作为空白组,混匀,30 ℃避光静置30 min,在535 nm处测定吸光度[14]。
式中:A1为样液的吸光度;A2为空白的吸光度;A3为DPPH溶液的吸光度。
1.3 数据处理
每个试验重复3次,采用Origin 8.5软件作图。采用SPSS V17.0软件进行ANOVA差异显著性分析,p<0.05 为显著性差异。
2 结果与分析
2.1 单因素实验结果
2.1.1 葡萄糖、木糖添加量和葡萄糖与木糖配比对梅鱼内脏酶解液美拉德产物的影响 糖种类及配比对梅鱼内脏酶解液美拉德产物的影响结果如图1所示。由图1中a、b可知,420 nm处的吸光度不断增加,说明两种还原糖参与了美拉德反应,并且随着还原糖含量的添加,美拉德反应逐渐进行,褐变程度随之逐渐加深。然而当葡萄糖、木糖添加量达到1.2 g时,感官评分达到最大,分别为7.4、8.4,超过1.2 g时,感官评分开始下降。与葡萄糖参与的反应相比,木糖添加量在0.6~1.6 g时,木糖美拉德反应产物的感官评分要高于葡萄糖,说明木糖参与美拉德反应的效果略优于葡萄糖,相较于六碳糖葡萄糖,作为五碳糖的木糖,对美拉德反应的进行更有利。如图1中c可知,随着葡萄糖/木糖的比例逐渐减小,木糖占总糖比例的增加,美拉德反应不断进行,褐变程度不断加深。当葡萄糖与木糖比例为1∶1时,感官评分达到最大8.8,之后随着葡萄糖/木糖比例减小,褐变程度的不断加深,感官评分急剧下降,可能是因为随着木糖含量的添加,美拉德反应产物会散发出不协调的酸味,干扰感官评分。
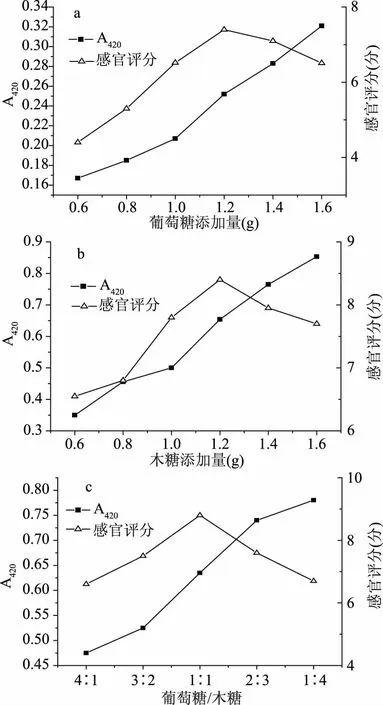
图1 还原糖及其配比对梅鱼内脏酶解液美拉德产物吸光值(420 nm)及感官评分的影响Fig.1 Effects of reducing sugars and their proportions on the absorption value(420 nm)and sensory score of plum visceral enzyme solution Maillard products
随着葡萄糖/木糖比例的减小,褐变程度加深,具有香味的小分子物质不断产生,而小分子物质又随着反应的不断深化,聚合成大分子物质,香味动态平衡的状态被减弱甚至打破,这也可能是由于在反应过程中产生了刺激性气味的物质或者焦苦味,掩盖了原有的香味,降低了感官效果,且基于成本考虑,葡萄糖低于木糖。最终确定以葡萄糖∶木糖为1∶1为混合糖。
2.1.2 pH对梅鱼内脏酶解液美拉德产物的影响 pH对梅鱼内脏酶解液美拉德产物的影响结果如图2所示。由图2可知,当pH为5时,吸光值较小,说明美拉德反应的程度较低,之后随着pH的增加,美拉德反应程度也随之增加,在pH为9时,酶解液美拉德反应的程度最强,之后随着pH的增加,美拉德反应产物褐变程度开始减轻。且在pH为9时,感官效果最佳(评分为6.8分)。一般来说,美拉德反应随pH的升高而加剧,pH越大,反应越强,速度越快。在酸性条件下,美拉德反应主要产生糠醛(戊糖)或者羟甲基糠醛(HMF)(己糖),美拉德反应受到抑制,碱性条件下,葡糖氨重排产生还原酮,如丙酮醇、丙酮醛等物质会进一步参与美拉德反应[15]。因此选定反应体系的pH为9。
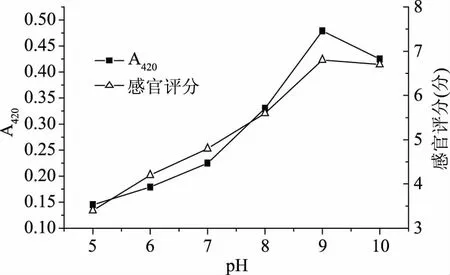
图2 pH对梅鱼内脏酶解液美拉德产物吸光值(420 nm)及感官评分的影响Fig.2 Effects of pH on the absorption value(420 nm)and sensory score of plum fish visceral enzyme solution Maillard products
2.1.3 反应时间对梅鱼内脏酶解液美拉德产物的影响 美拉德反应过程中,氨基酸和还原糖逐渐反应,形成大量褐色含氮色素,即类黑精色素,环化产生一系列吡啶、吡咯、吡嗪等含氮杂环化合物[16]。反应时间对梅鱼内脏酶解液美拉德产物的影响结果如图3所示。如图3所示,在20~120 min反应时间内,美拉德反应随着时间的延长而加深,感官效果也随之增强,然而其反应速率不断减小,有可能是因为葡萄糖随着反应进行而不断消耗。美拉德反应越彻底,褐变程度随之加深,感官评分也越高。在实验进行到100 min时,感官评分达到最高为7.6分,120 min时,感官评分略有下降。因此最终确定反应时间为100 min。
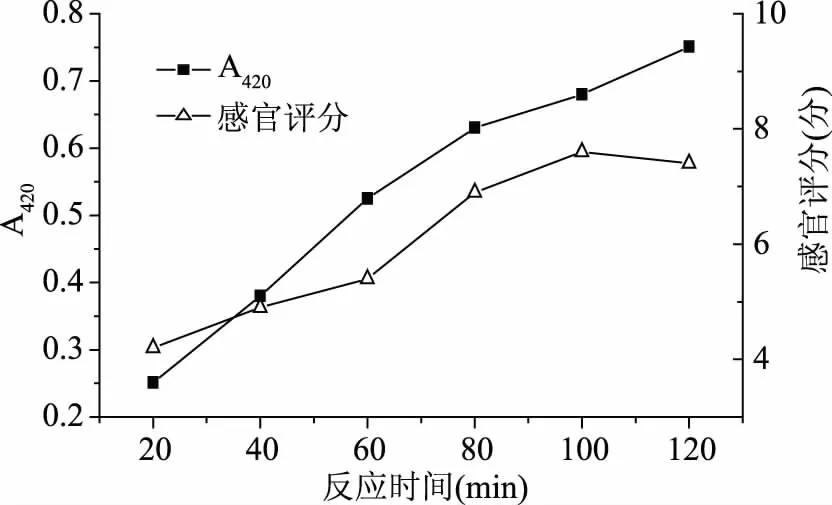
图3 反应时间对梅鱼内脏酶解液美拉德产物吸光值(420 nm)及感官评分的影响Fig.3 Effects of reaction time on the absorption value(420 nm)and sensory score of plum fish visceral enzyme solution Maillard products
2.1.4 温度对梅鱼内脏酶解液美拉德产物的影响 温度对梅鱼内脏酶解液美拉德产物的影响如图4所示。图4显示,当温度70 ℃时,美拉德反应程度较低,之后随着反应温度的上升,吸光度增大,美拉德反应程度也随之上升,在100 ℃后,温度变化对吸光值和感官评分影响较小,当温度达到120 ℃时,美拉德反应的程度最强,感官评分也随着温度的上升而不断增加,在120 ℃达到最佳感官评分。温度是影响美拉德反应程度的关键因素之一,升高温度将增加糖和氨基酸的相互作用,从而增加反应速率,同时,温度较高时会形成大量的挥发性物质。一般情况下,反应模式的温度不能超过180 ℃,温度过高,会产生较强烈的气味。综上,最终选取100、110、120 ℃作为正交水平。
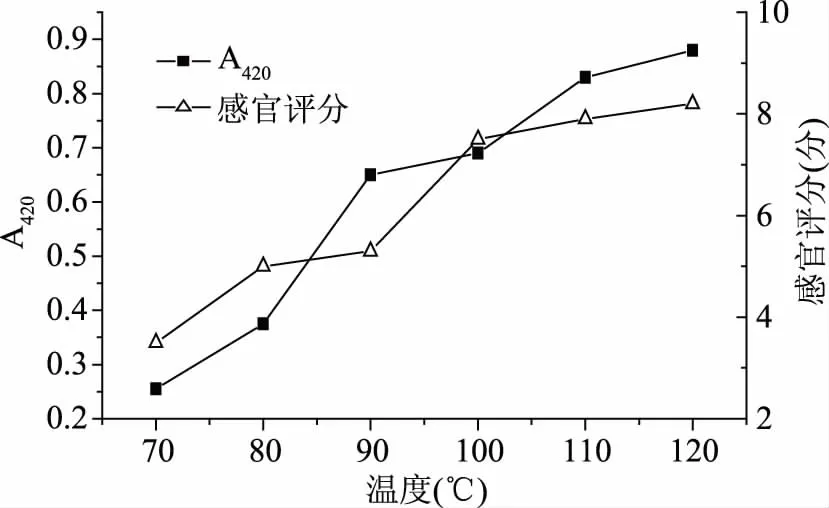
图4 反应温度对梅鱼内脏酶解液美拉德产物吸光值(420 nm)及感官评分的影响Fig.4 Effects of reaction temperatures on the absorption value(420 nm)and sensory score of plum fish visceral enzyme solution Maillard products
2.2 正交试验结果
2.2.1 美拉德反应条件的正交试验结果 在单因素实验的基础上,采用正交试验对美拉德反应进行优化,结果及分析见表3。表3所示,影响美拉德反应程度因素的主次顺序依次是C>A>B>D,即温度>pH>时间>葡萄糖/木糖。美拉德反应最佳条件为A2B2C3D1,恰好是正交试验中的一组,即当温度为120 ℃、pH为9、反应时间为100 min、葡萄糖/木糖为1∶1时,感官评分最佳结果为7.48分。
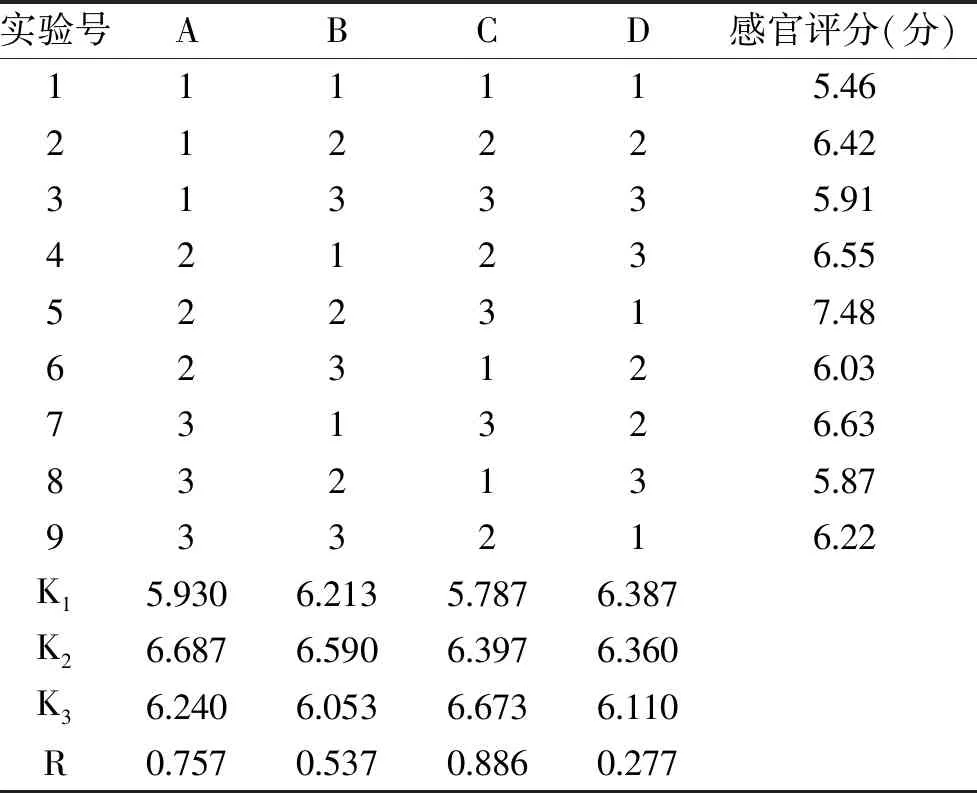
表3 四因素三水平正交试验结果Table 3 Results of orthogonal experiment of four factors and three levels
2.2.2 验证实验 按上述最佳工艺条件,即反应温度120 ℃、反应时间100 min、pH9.0、葡萄糖与木糖之比1∶1时进行3次平行实验,梅鱼内脏酶解液美拉德反应产物的感官评分的平均分为7.51±0.13。3次实验的稳定性较好、误差较小,说明正交实验结果正确可行。
2.3 美拉德反应产物挥发性成分分析
从表4~表5可知,从梅鱼内脏酶解液美拉德反应产物中总共检测出89种挥发性风味化合物,其中醛类16种、含量46.79%;烃类12种、含量1.89%;酸类5种、含量2.11%;醇类8种、含量7.26%;呋喃类5种、含量3.04%;噻唑类5种、含量1.62%;吡嗪类4 种、含量1.31%;酯类11 种、含量24.84%;酮类9种、含量5.93%;其他化合物14种、含量5.21%。
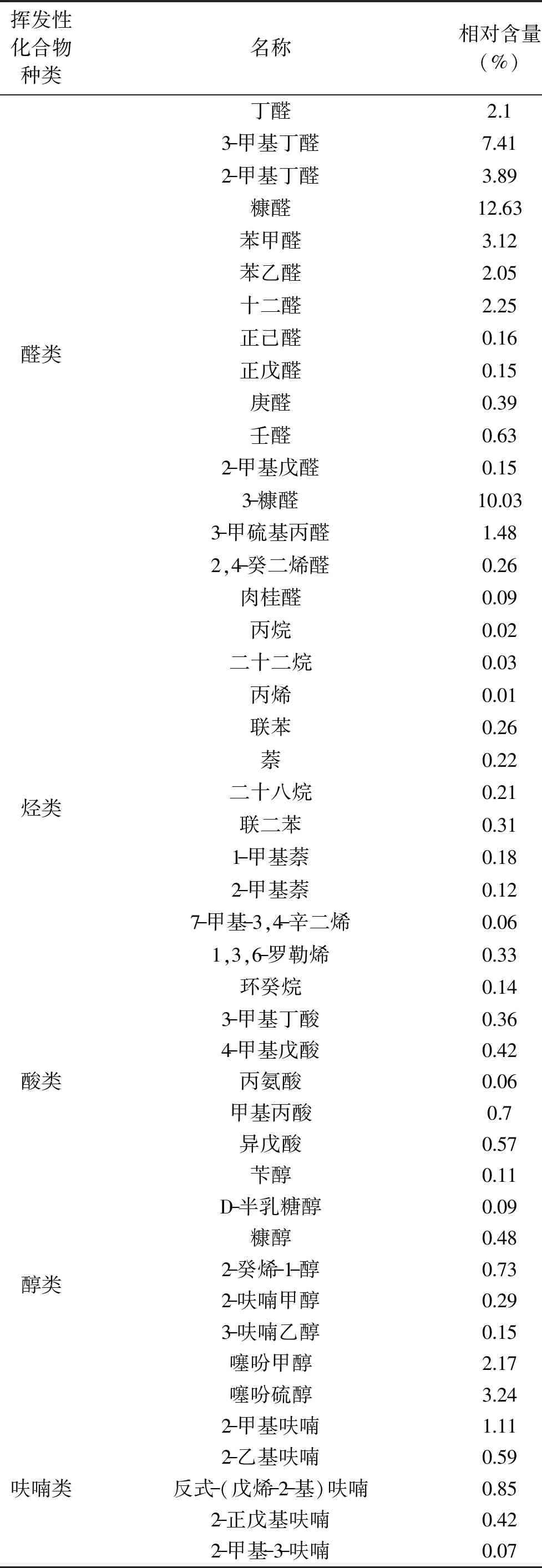
表4 美拉德反应产物的挥发性风味物质Table 4 Volatile flavor compounds of Maillard reaction products
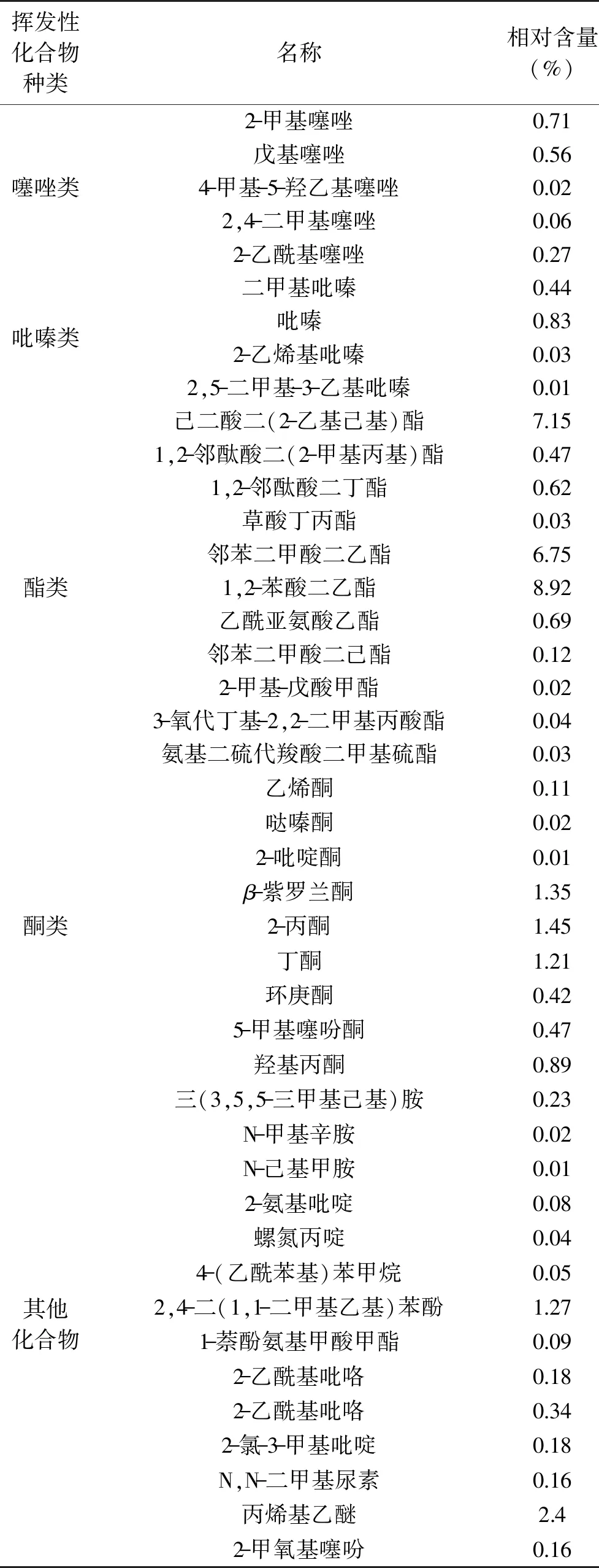
续表

表5 美拉德反应产物的挥发性风味物质种类及含量Table 5 Types and contents of volatile flavor substances in Maillard reaction products
占较高含量(46.79%)的醛类物质包含糠醛、3-糠醛、壬醛等,具有产生清香、果香和坚果香的特质[18],其中壬醛具有脂香味;糠醛具有独特的烤肉香味[19];3-甲硫基丙醛对海鲜味[20]和肉香味[21]具有贡献作用;己醛具有青草味[22]。
美拉德反应产物中检测出醇类、酯类、酮类和酸类等,这些物质本身都带有独特的香味,具有去腥增香的作用,对梅鱼内脏酶解液美拉德反应产物的风味形成具有重要的贡献。含量为24.84%的酯类包含1,2-苯酸二乙酯、邻苯二甲酸二乙酯等,具有显著香味特征对肉香味增加有贡献。酮类物质(含量5.93%)包含2-丙酮、β-紫罗兰酮等,对鱼肉气味的贡献相对较小,对腥味物质起增强作用[29]。呋喃类化合物及其衍生物会产生鱼香味、煮鱼香味等独特的芳香[23]。噻唑类对肉的总体风味具有最基本的贡献,它是美拉德反应的前期阶段生成的,高温是形成噻吩类物质的先决条件[24]。
噻唑类一般气味强烈,对肉香味以及海鲜味具有重要贡献意义[20]。吡嗪类化合物主要提供坚果味、烧烤味和甜味的产品[25],是风味化合物中重要的组成部分,也是美拉德反应的主要产物之一[26]。
2.4 美拉德反应产物的抗氧化活性
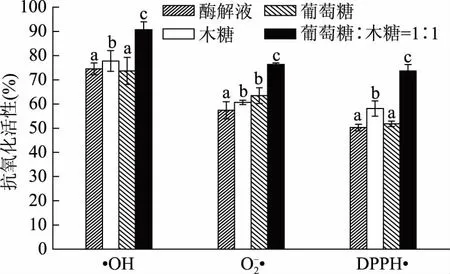
图5 梅鱼内脏酶解液及其美拉德反应产物的抗氧化活性Fig.5 Antioxidant activity of enzymatic hydrolysis solution of fish offal and its Maillard reaction product注:图中小写字母不同,表示显著差异(p<0.05)。
3 结论