大肠杆菌FtsZ蛋白原核表达及多克隆抗体的制备与鉴定
2019-07-10陈云雨牛夏忆李淼李霓刘晓平
陈云雨,牛夏忆,李淼,李霓,刘晓平
大肠杆菌FtsZ蛋白原核表达及多克隆抗体的制备与鉴定
陈云雨1,牛夏忆1,李淼1,李霓2,刘晓平1
1 皖南医学院 药物筛选与评价研究所,安徽 芜湖 241002 2 中国医学科学院-北京协和医学院 药物研究所 天然药物活性物质与功能国家重点实验室,北京 100050
为制备特异性抗大肠杆菌丝状热敏蛋白Z (filamentous thermosensitive protein Z,Ec-FtsZ)多克隆抗体,将基因进行化学合成后连接pET-22b(+) 表达载体,构建重组质粒Ec-FtsZ-pET-22b(+)。将重组质粒转化到大肠杆菌.BL21(DE3) 中进行Ec-FtsZ原核表达与表达条件优化,以HisTrap层析柱进行Ec-FtsZ的分离纯化,再以孔雀绿法进行Ec-FtsZ GTPase (Guanosine triphosphatase) 活性测定。使用纯化的Ec-FtsZ为抗原免疫大鼠制备多克隆抗体,经酶联免疫吸附测定实验 (Enzyme-linked immunosorbent assay,ELISA)、Western blotting实验和免疫荧光实验鉴定,抗Ec-FtsZ多克隆抗体效价可达1∶256 000且具有良好的抗原特异性。抗Ec-FtsZ多克隆抗体的成功制备为Ec-FtsZ生物学功能研究和生化检测奠定了实验基础。
大肠杆菌FtsZ蛋白,原核表达,孔雀绿法,免疫荧光,多克隆抗体
大肠杆菌细胞骨架蛋白FtsZ (filamentous thermosensitive protein Z,Ec-FtsZ) 是细菌细胞分裂所必需的调控蛋白,其生物学功能与微管蛋白极其相似,被认为是微管蛋白的同源蛋白[1-2]。Ec-FtsZ具有GTPase (Guanosine triphosphatase) 活性,在GTP存在条件下,Ec-FtsZ可在细菌内膜中心聚集形成多聚体,进而形成可收缩的Z环 (Z ring)。Z环形成后,其他分裂调控蛋白陆续结合到Z环骨架上形成分裂体。分裂体通过提供细菌细胞缢缩力和酶活力使Z环缩小以形成隔膜,完成细菌细胞的二分裂过程[3-7]。由于FtsZ在大多数致病菌细胞分裂过程中发挥高度保守的调控作用,细菌的FtsZ与真核生物微管蛋白结构差异较大且不易突变,其已成为抗感染药物开发的理想靶标之一[4,7-8]。因此,深入研究Ec-FtsZ在大肠杆菌Z环形成和定位中的调控功能对新型抗耐药菌药物研发具有重要意义。
Ec-FtsZ虽是组成细菌分裂体的核心蛋白,但目前对Ec-FtsZ如何调控其他分裂调控蛋白募集到Z环形成细菌分裂体的调控机制研究还不甚深入,尤其是Z环在细菌内膜精准定位的分子机制尚未明确。为了进一步探讨Ec-FtsZ上述生物学功能,本研究利用DNA重组技术原核表达和分离纯化了高活性的Ec-FtsZ,并制备了高效价和特异性的大鼠抗Ec-FtsZ多克隆抗体 (Polyclonal antibody,PcAb),为Ec-FtsZ生物学功能研究和生化检测奠定实验基础。
1 材料与方法
1.1 材料
pET-22b(+) 质粒由北京师范大学化学学院化学生物学系郑积敏教授惠赠;大肠杆菌感受态细胞.Rosetta(DE3)、.BL21(DE3)、.BL21(DE3) pLysS、Ⅰ、Ⅰ、Trans 2K®DNA Marker和ProteinRuler®Ⅱ购自北京全式金生物技术有限公司;酵母粉、琼脂粉、胰蛋白胨购自Oxoid公司;二辛可宁酸 (Bicinchoninic acid,BCA) 蛋白浓度测定试剂盒购自Thermo公司;异丙基硫代半乳糖苷 (Isopropyl β-D-thiogalactoside,IPTG)、GTP (Guanosine triphosphate)、氨苄西林、Freund完全佐剂和Freund不完全佐剂购自Sigma公司;小鼠抗组氨酸 (Histidine,His) 标签单克隆抗体、辣根过氧化物酶 (Horseradish peroxidase,HRP) 标记的山羊抗小鼠IgG、HRP-山羊抗大鼠IgG、异硫氰酸荧光素 (Fluorescein isothiocyanate,FITC) 标记的山羊抗大鼠IgG购自Boster公司;TanonTM化学发光液购自上海天能科技有限公司;牛血清白蛋白 (Bovine serum albumin,BSA)、四甲基联苯胺 (3,3ʹ,5,5ʹ-Tetramethylbenzidine,TMB) 溶液购自北京索莱宝科技有限公司;半底96孔透明板、96孔酶标板购自Corning公司;HisTrap层析柱购自GE公司;BIOMOL®GREEN购自Enzo Biochem公司;Wistar大鼠购自维通利华公司;其他生化试剂为国产分析纯试剂。
1.2 方法
1.2.1 Ec-FtsZ原核表达质粒的构建与鉴定
在NCBI数据库中检索大肠杆菌全长基因序列 (GenBank登录号:CP023258.1),在该基因序列两端分别设计Ⅰ和Ⅰ酶切位点后进行全基因合成。将合成的基因片段插入pET-22b(+)表达载体,构建重组质粒Ec-FtsZ-pET-22b(+),以双酶切法进行鉴定。基因片段合成和测序由General Biosystems公司完成。
1.2.2 Ec-FtsZ原核表达
将重组质粒Ec-FtsZ-pET-22b(+)转化到.BL21(DE3)感受态细胞,涂布于LB固体培养基 (含100 μg/mL氨苄西林),37 ℃培养过夜。随机挑取6个单菌落接种至含有100 μg/mL氨苄西林的LB液体培养基中,以1 mmol/L IPTG为诱导剂,30 ℃诱导10 h,诱导Ec-FtsZ表达。以10% SDS-PAGE检测Ec-FtsZ原核表达情况。
1.2.3 Ec-FtsZ最适诱导时间的确定
将上述工程菌接种至含有100 μg/mL氨苄西林的LB液体培养基,37 ℃培养至菌体600=0.8时,加入1.0 mmol/L IPTG,诱导温度分别设置为30 ℃、25 ℃和20 ℃诱导Ec-FtsZ表达,在2、4、6、8、10和12 h时间点等量收集菌体,以10% SDS-PAGE检测Ec-FtsZ表达情况,利用Clinx Image Analysis软件分析Ec-FtsZ表达量。
1.2.4 Ec-FtsZ最适诱导温度的确定
等量收集20 ℃、25 ℃和30 ℃条件下诱导培养6 h的菌体,收集的菌体用TBS (50 mmmol/L Tris、150 mmol/L NaCl,pH8.0) 溶液重悬,以超声波破碎菌体,离心收集裂解后的上清液和沉淀,以10% SDS-PAGE检测Ec-FtsZ的可溶性表达情况。
1.2.5 Ec-FtsZ最适IPTG诱导浓度的确定
工程菌于37 ℃培养至600=0.8时,加入不同浓度的IPTG分别于25 ℃诱导6 h,IPTG浓度设置为0.2、0.4、0.6、0.8和1.0 mmol/L。等量收集菌体,以10% SDS-PAGE检测不同IPTG诱导浓度对Ec-FtsZ表达的影响。
1.2.6 Ec-FtsZ分离纯化与鉴定
诱导后的工程菌经超声波破碎后取上清液,以25%饱和硫酸铵溶液沉淀制备粗提液。按照文献所述方法进行Ec-FtsZ的分离纯化[4]。纯化的Ec-FtsZ以TBS溶液透析,再以BCA法测定蛋白浓度。
纯化的Ec-FtsZ经10% SDS-PAGE后转膜,一抗为小鼠抗His标签单抗 (1∶2 000),二抗为HRP-羊抗小鼠IgG (1∶4 000),以TanonTM化学发光液成像。
1.2.7 Ec-FtsZ GTPase活性测定
参考相关文献[4,9-10],首先将0.1 mol/L GTP溶液以反应液 (50 mmol/L Tris、5 mmol/L MgCl2,pH 8.0) 进行2倍倍比稀释,共制备7个浓度梯度样品 (2–0.031 mmol/L)。上述GTP稀释液以25 μL/孔依次加入到含10 μmol/L Ec-FtsZ (25 μL/孔) 的半底96孔透明板中,每个浓度设置3组复孔,室温孵育20 min。依次加入孔雀绿试剂 (50 μL/孔),室温反应5 min,以多功能酶标仪检测620值 (CytationTM5,BioTek)。将10 μmol/L BSA反应组设为阴性对照组。根据磷酸标准曲线计算酶促反应中自由磷酸 (Pi) 的释放量和Ec-FtsZ GTPase活性 (nmol/(min·mg Ec-FtsZ))。
1.2.8 抗Ec-FtsZ多克隆抗体的制备
改进文献所述方法免疫大鼠制备抗Ec-FtsZ多克隆抗体[11-12]。首次免疫时,将Ec-FtsZ (200 μg/(次·只)) 与等体积Freund完全佐剂混合,充分乳化后进行Wistar大鼠皮下多点注射。首次免疫3周后进行第2次免疫,用Freund不完全佐剂充分乳化后的Ec-FtsZ进行皮下注射。第2次免疫后的第7 天,从大鼠尾尖部少量采血后分离血清,以ELISA法进行效价测定。当抗血清效价达到1∶70 000,则从全血中分离抗血清备用。
1.2.9 抗Ec-FtsZ多克隆抗体效价测定
按照文献所述方法进行抗Ec-FtsZ多克隆抗体效价测定[12]。首先将Ec-FtsZ (10 μg/mL) 以100 μL/孔包被至96孔酶标板,酶标板经10% BSA封闭后,依次加入以2倍倍比稀释法稀释的共11个浓度梯度的大鼠抗血清 (1∶1 000–1∶1 024 000;100 μL/孔),每组3个复孔,以相同稀释倍数的大鼠免疫前血清作为阴性对照组,室温孵育1 h。酶标板经HRP-羊抗大鼠IgG (1∶4 000) 孵育和TMB显色后,以多功能酶标仪测定450值。S/N=稀释抗血清/阴性对照组,判定S/N≥3.0的样品为阳性样品。
1.2.10 抗Ec-FtsZ多克隆抗体抗原特异性鉴定
纯化的Ec-FtsZ (1、2、4 μg) 经10% SDS-PAGE后转膜,一抗为大鼠抗Ec-FtsZ多克隆抗体 (1∶10 000),二抗为HRP-羊抗大鼠IgG (1∶4 000),以TanonTM化学发光液成像。
以煮沸法裂解大肠杆菌.BL21(DE3)、.BL21(DE3) pLysS和.Rosetta (DE3)细胞,同法检测细胞裂解液中的内源Ec-FtsZ。
1.2.11 免疫荧光实验分析Ec-FtsZ亚细胞定位
将大肠杆菌.BL21(DE3)细胞以2.5%多聚甲醛和0.04%戊二醛固定后,以含0.3% Tween-20的PBS (Phosphate buffered saline) 溶液 (PBST) 洗涤3次。经10% BSA封闭2 h后,依次加入大鼠抗Ec-FtsZ多克隆抗体 (1∶10 000) 和FITC-山羊抗大鼠IgG (1∶100),室温孵育45 min,PBST洗涤3次,以荧光显微镜 (Life EVOS) 观察Ec-FtsZ的亚细胞定位。
2 结果与分析
2.1 Ec-FtsZ原核表达质粒的鉴定
用Ⅰ和Ⅰ酶切构建的重组质粒Ec-FtsZ-pET-22b(+),得到了约1 152 bp的基因片段,其大小与基因片段理论值一致 (图1),表明成功构建了重组质粒Ec-FtsZ-pET-22b(+)。

图1 重组质粒Ec-FtsZ-pET-22b(+)的双酶切鉴定
2.2 Ec-FtsZ的原核表达
6株工程菌经IPTG诱导培养后,收集的菌体经10% SDS-PAGE分析表明,在Ec-FtsZ理论分子量位置 (42 kDa) 可见明显的蛋白表达条带 (图2),这说明成功进行了Ec-FtsZ原核表达。
2.3 Ec-FtsZ最适诱导时间的确定
工程菌以不同的诱导时间培养后,等量收集菌体,以10% SDS-PAGE鉴定Ec-FtsZ表达情况。在诱导温度为30 ℃ (图3A)、25 ℃ (图3B) 和20 ℃ (图3C) 时,Ec-FtsZ均明显表达。以上述诱导温度分别诱导工程菌6 h,Ec-FtsZ表达量均达30%,趋于蛋白表达量最高峰。因此确定Ec-FtsZ在30 ℃、25 ℃和20 ℃诱导时,其最适诱导时间为6 h。
2.4 Ec-FtsZ最适诱导温度的确定
等量收集30 ℃、25 ℃、20 ℃诱导6 h的菌体,菌体裂解上清液和沉淀经10% SDS-PAGE分析表明,与30 ℃诱导6 h时相比,25 ℃和20 ℃诱导6 h时,Ec-FtsZ包涵体量明显减少,目的蛋白大部分在上清中呈可溶表达 (图4)。因此确定Ec-FtsZ最适诱导温度为25 ℃。

图2 Ec-FtsZ的原核表达
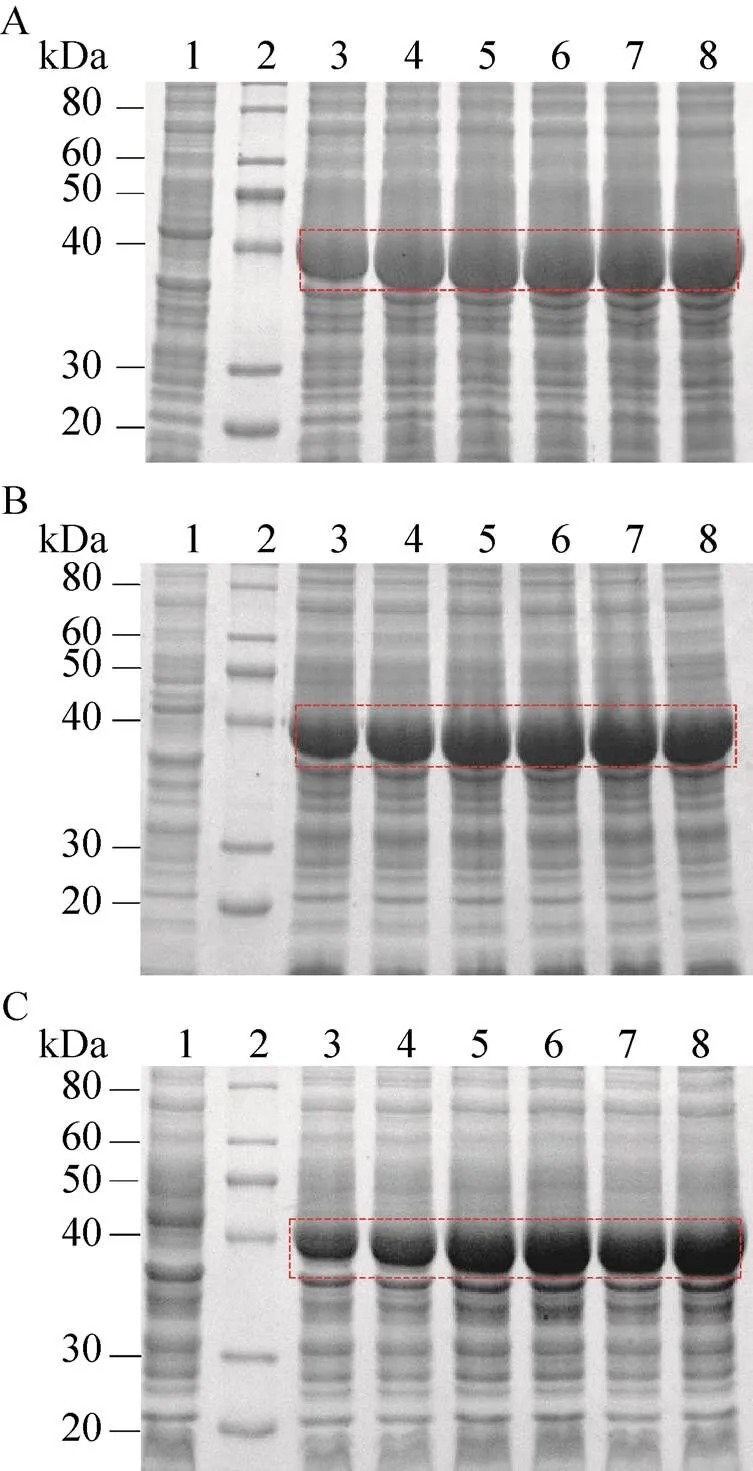
图3 Ec-FtsZ最适诱导时间的确定
2.5 Ec-FtsZ最适IPTG诱导浓度的确定
SDS-PAGE结果表明,IPTG对Ec-FtsZ表达的诱导效率较高,0.2 mmol/L IPTG即可诱导Ec-FtsZ大量表达 (图5)。
综上所述,以0.2 mmol/L IPTG于25 ℃诱导6 h作为Ec-FtsZ最适表达条件。
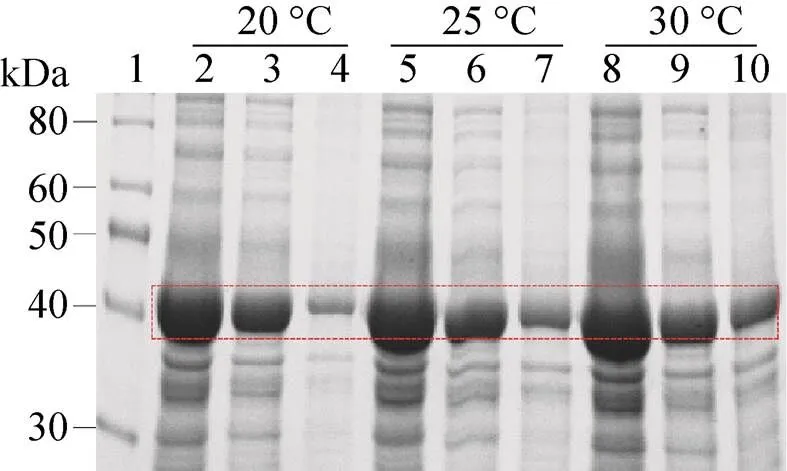
图4 Ec-FtsZ最适诱导温度的确定

图5 Ec-FtsZ最适IPTG诱导浓度的确定
2.6 Ec-FtsZ的分离纯化与鉴定
工程菌菌体裂解上清液首先用25%饱和硫酸铵溶液沉淀后制备粗提液,粗提液经过滤后再以HisTrap层析柱进行分离纯化。SDS-PAGE结果显示,在相对分子量42 kDa左右呈单一蛋白条带,说明获得了具有较高纯度的Ec-FtsZ (图6A)。Western blotting实验证实了Ec-FtsZ的正确表达 (图6B)。BCA法测定纯化的Ec-FtsZ浓度为1.3 mg/mL。
2.7 Ec-FtsZ GTPase活性测定
Ec-FtsZ具有GTPase活性,能够水解GTP为GDP和自由磷酸 (Pi)。孔雀绿试剂能与Pi结合形成绿色复合物,且复合物量与620值呈正相关,故此可以用反应体系Pi释放量反映Ec-FtsZ GTPase活性[4,9]。孔雀绿法酶活性测定实验表明,与BSA对照组相比,随着GTP浓度的不断升高,Ec-FtsZ GTPase活性越来越强,最大酶活力可达6 nmol/ (min·mg Ec-FtsZ) (图7)。

图6 Ec-FtsZ的分离纯化与鉴定
2.8 抗Ec-FtsZ多克隆抗体的制备与效价测定
以纯化的Ec-FtsZ为抗原免疫大鼠,在第2次加强免疫后第7天抗体滴度基本达到峰值。当抗血清稀释至256 000倍时,S/N值为3.15,抗Ec-FtsZ多克隆抗体效价可达1∶256 000 (图8),这表明纯化的Ec-FtsZ具有良好的免疫原性,制备的抗Ec-FtsZ多克隆抗体具有较高的滴度。
2.9 抗Ec-FtsZ多克隆抗体的抗原特异性鉴定
将抗Ec-FtsZ多克隆抗体 (1∶10 000) 作为一抗,分别与纯化的Ec-FtsZ和大肠杆菌内源Ec-FtsZ反应,以Western blotting实验检测其抗原特异性。结果显示,纯化的Ec-FtsZ在相对分子量42 kDa左右显现特异条带,条带亮度与Ec-FtsZ剂量呈正相关 (图9A)。另外,在大肠杆菌BL21(DE3)、BL21(DE3) pLysS 和Rosetta (DE3)细胞裂解液中也同样检测到了相同分子量的特异条带 (图9B)。综上所述,抗Ec-FtsZ多克隆抗体不仅可以识别纯化的Ec-FtsZ,还可以特异性结合大肠杆菌内源Ec-FtsZ,其具有良好的抗原特异性。

图8 ELISA检测抗Ec-FtsZ多克隆抗体效价
2.10 大肠杆菌Ec-FtsZ的亚细胞定位
通过荧光显微镜观察,使用大鼠抗Ec-FtsZ多克隆抗体为一抗,以免疫荧光实验分析大肠杆菌Ec-FtsZ亚细胞定位。结果表明,绿色荧光 (Ec-FtsZ) 主要分布于大肠杆菌细胞内膜的中心,这说明Ec-FtsZ主要定位于细菌细胞内膜中心即Z环位置,参与大肠杆菌细胞分裂的调控 (图10)。
3 讨论
大肠杆菌FtsZ是细菌分裂过程中重要的调控蛋白,其通过GTP依赖的自组装形成多聚体,促进细菌分裂体和Z环结构形成以调控细菌细胞分裂、FtsZ相对保守的细菌分裂调控模式已成为新型抗感染药物开发的理想靶标之一[4,7-10,13-16]。深入研究Ec-FtsZ在大肠杆菌分裂过程中的调控功能,尤其是调控细菌分裂体形成和Z环内膜定位的分子机制,对未来新型抗耐药菌细胞分裂抑制剂研发具有重要意义。特异性抗体对研究蛋白质生物学功能和生化检测具有重要作用,但目前还未有抗Ec-FtsZ抗体商品化销售,因此制备特异性抗Ec-FtsZ抗体对Ec-FtsZ生物学功能深入研究和生化检测具有重要意义。

图9 Westernblotting鉴定抗Ec-FtsZ多克隆抗体的抗原特异性

图10 免疫荧光实验分析Ec-FtsZ的亚细胞定位(×60)
多克隆抗体虽特异性不如单克隆抗体,但其生产过程简便、成本低廉且产量较大,因此是抗体制备的重要选择之一。诸多研究者将大肠杆菌原核表达的重组蛋白作为抗原免疫实验动物 (如大鼠、小鼠、新西兰大白兔等),成功制备了多种特异性多克隆抗体用于实验研究[11-12,17-20]。本研究将基因片段克隆至pET-22b(+) 表达载体中,构建了重组质粒Ec-FtsZ-pET-22b(+)。利用pET-22b(+) 的His标签羧基端融合表达策略,成功进行了Ec-FtsZ原核表达与分离纯化。由于诱导时间、诱导温度与IPTG浓度是影响重组蛋白原核表达的重要因素[21-24],为了提高Ec-FtsZ表达量并节约实验成本,笔者对其原核表达条件进行了系统优化。Ec-FtsZ原核表达优化实验显示,不同的诱导温度对其原核表达的影响较大。30 ℃诱导时,Ec-FtsZ易于形成包涵体;25 ℃和20 ℃低温诱导时,大部分Ec-FtsZ以可溶形式表达,这可能与低温状态下蛋白表达速度缓慢并促进其正确折叠有关[24-25]。25 ℃诱导6 h时,Ec-FtsZ表达量可达30%并趋于稳定,故此以25 ℃诱导 6 h作为Ec-FtsZ最适表达条件。IPTG作为原核表达的诱导剂,其对Ec-FtsZ表达的诱导效率很高,0.2 mmol/L IPTG即可诱导Ec-FtsZ大量表达。
高活性的Ec-FtsZ制备对于多克隆抗体制备和体外生物学功能研究具有重要意义。孔雀绿法是FtsZ GTPase活性检测的经典方法[4,9-10],主要通过检测反应体系中自由磷酸浓度以反映酶的活性。该方法具有一步反应、操作简便、检测灵敏和成本低廉等诸多优点,不仅可以用于酶活性检测,还可以用于Ec-FtsZ GTPase抑制剂的高通量筛选。文中利用上述方法对Ec-FtsZ GTPase活性进行了测定,证实了纯化的Ec-FtsZ具有良好的GTPase活性。
将纯化的Ec-FtsZ作为抗原免疫大鼠制备多克隆抗体,以ELISA实验、Western blotting实验和免疫荧光实验进行了抗Ec-FtsZ多克隆抗体效价和抗原特异性鉴定。ELISA实验表明抗Ec-FtsZ多克隆抗体效价可达1∶256 000,其具有较高的滴度。Western blotting实验证实了抗Ec-FtsZ多克隆抗体具有良好的抗原特异性,不仅可以识别纯化的Ec-FtsZ,还可以特异性结合大肠杆菌内源Ec-FtsZ。免疫荧光实验表明Ec-FtsZ主要分布于大肠杆菌细胞内膜中心并形成了Z环,其亚细胞定位与文献报道基本一致[5,13,26],这也再次证实了抗Ec-FtsZ多克隆抗体具有良好的抗原特异性。
目前,笔者将制备的抗Ec-FtsZ多克隆抗体成功应用于以Ec-FtsZ/ZipA (FtsZ-interacting protein A,ZipA) 相互作用为靶标的ELISA高通量筛选模型中的Ec-FtsZ生化检测。通过应用建立的ELISA筛选模型对本室天然产物化合物库进行了高通量筛选,已初步获得了若干新型苗头化合物。
综上所述,文中成功进行了Ec-FtsZ原核表达和抗Ec-FtsZ多克隆抗体的制备与鉴定,为进一步研究Ec-FtsZ生物学功能和生化检测奠定了实验基础。
致谢:衷心感谢北京师范大学化学学院化学生物学系郑积敏教授、中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室林媛副研究员和军事科学院军事医学研究院十一所基因工程全军重点实验室岳玉环研究员在Ec-FtsZ原核表达、活性测定和多抗制备技术方面给予的悉心指导和无私帮助!
[1] Zhang W, Yang ZJ, Chen DJ. The research progress of FtsZ inhibitor, a target for bacteria cell-division. Chin Bull Life Sci, 2012, 22(1): 94–101 (in Chinese). 张雯, 杨志钧, 陈代杰. 靶向FtsZ的细胞分裂抑制剂的研究进展. 生命科学, 2012, 22(1): 94–101.
[2] Krupka M, Margolin W. Unite to divide: oligomerization of tubulin and actin homologs regulates initiation of bacterial cell division. F1000Res, 2018, 7: 235.
[3] Sang Y, Tao J, Yao YF. Regulation of the Z ring positioning in bacterial cell division-A review. Acta Microbiol Sin, 2013, 53(4): 321–327 (in Chinese). 桑昱, 陶晶, 姚玉峰. 细菌分裂Z环定位的调控方式. 微生物学报, 2013, 53(4): 321–327.
[4] Lin Y, Zhu NY, Jiang JD, et al. The establishment and application of a high-throughput screening (HTS) assay for inhibitors ofFtsZ. Chin J Antibiot, 2015, 40(3): 166–170, 212 (in Chinese). 林媛, 朱宁屿, 蒋建东, 等. 以FtsZ为靶点的抗结核药物筛选模型的建立及应用. 中国抗生素杂志, 2015, 40(3): 166–170, 212.
[5] Erickson HP, Anderson DE, Osawa M. FtsZ in bacterial cytokinesis: cytoskeleton and force generator all in one. Microbiol Mol Biol Rev, 2010, 74(4): 504–528.
[6] Ortiz C, Natale P, Cueto L, et al. The keepers of the ring: regulators of FtsZ assembly. FEMS Microbiol Rev, 2016, 40(1): 57–67.
[7] Yang SY, Zhu J, Wu Y, et al. Purification and crystallization of MinC/FtsZ complex in. Chemistry, 2017, 80(1): 89–93 (in Chinese). 杨少媛, 朱嘉, 吴彦, 等. 大肠杆菌MinC/FtsZ蛋白复合物的纯化和结晶. 化学通报, 2017, 80(1): 89–93.
[8] Kapoor S, Panda D. Targeting FtsZ for antibacterial therapy: a promising avenue. Expert Opin Ther Targets, 2009, 13(9): 1037–1051.
[9] Lin Y, Zhu NY, Han YX, et al. Identification of anti-tuberculosis agents that target the cell-division protein FtsZ. J Antibiot (Tokyo), 2014, 67(9): 671–676.
[10] Lin Y, Zhang HJ, Zhu NY, et al. Identification of TB-E12 as a novel FtsZ inhibitor with anti-tuberculosis activity. Tuberculosis, 2018, 110: 79–85.
[11] Zhang QS, Yuan RL, Jing SR. Expression and purification of Norovirus capsid protein VP1 and preparation of the polyclonal antibodies. Chin J Microecol, 2017, 29(8): 896–899, 905 (in Chinese). 仉秋实, 苑荣亮, 井申荣. 诺如病毒NV衣壳蛋白VP1表达纯化及多克隆抗体的制备. 中国微生态学杂志, 2017, 29(8): 896–899, 905.
[12] Chen YY, Niu XY, Lin Y, et al. Prokaryotic expression, purification and preparation of rat polyclonal antibody againstZipA. Chin J Cell Mol Immunol, 2018, 34(10): 942–948 (in Chinese).陈云雨, 牛夏忆, 林媛, 等. 大肠杆菌丝状热敏蛋白Z相互作用蛋白A (Ec-ZipA) 原核表达、纯化与大鼠多克隆抗体的制备. 细胞与分子免疫学杂志, 2018, 34(10): 942–948.
[13] Ray S, Jindal B, Kunal K, et al. BT-benzo-29 inhibits bacterial cell proliferation by perturbing FtsZ assembly. FEBS J, 2015, 282(20): 4015–4033.
[14] Artola M, Ruiz-Avila LB, Vergoñós A, et al. Effective GTP-replacing FtsZ inhibitors and antibacterial mechanism of action. ACS Chem Biol, 2015, 10(3): 834–843.
[15] Xiao J, Goley ED. Redefining the roles of the FtsZ-ring in bacterial cytokinesis. Curr Opin Microbiol, 2016, 34: 90–96.
[16] Panda D, Bhattacharya D, Gao QH, et al. Identification of agents targeting FtsZ assembly. Future Med Chem, 2016, 8(10): 1111–1132.
[17] Wu FF, Cao ZG, Wang Q, et al. Prokaryotic expression of Zaire Ebola virus GP and the preparation of polyclonal antibody. Chin J Vet Sci, 2018, 38(3): 496–501 (in Chinese). 吴芳芳, 曹增国, 王琪, 等. 扎伊尔型埃博拉病毒糖蛋白的原核表达及多克隆抗体的制备. 中国兽医学报, 2018, 38(3): 496–501.
[18] Sun T, Yang GW, Zhang JY, et al. Prokaryotic expression of Hepatitis C Virus (HCV) NS3 protein and preparation of polyclonal antibody. Chin J Biotech, 2015, 31(5): 711–721 (in Chinese). 孙涛, 杨光文, 张金阳, 等. 丙型肝炎病毒NS3蛋白的原核表达及多克隆抗体制备. 生物工程学报, 2015, 31(5): 711–721.
[19] Wang H, Yang B, Zhao KS, et al. Preparation and identification of polyclonal antibodies againstUspA1. Chin J Biotech, 2018, 34(1): 102–109 (in Chinese). 王辉, 杨波, 赵可胜, 等. 卡他莫拉菌UspA1蛋白多克隆抗体的制备及鉴定. 生物工程学报, 2018, 34(1): 102–109.
[20] Qin YJ, Zhang TH, Ye X. Preparation and detection of anti-influenza A virus polymerase basic protein 1 polyclonal antibody. Chin J Biotech, 2016, 32(1): 105–113 (in Chinese). 秦玉洁, 张廷虹, 叶昕. 抗A型流感病毒聚合酶碱性蛋白1多克隆抗体的制备和鉴定. 生物工程学报, 2016, 32(1): 105–113.
[21] Hayat SMG, Farahani N, Golichenari B, et al. Recombinant protein expression in(.): What we need to know. Curr Pharm Des, 2018, 24(6): 718–725.
[22] Baeshen MN, Al-Hejin AM, Bora RS, et al. Production of biopharmaceuticals in.: Current scenario and future perspectives. J Microbiol Biotechnol, 2015, 25(7): 953–962.
[23] Papaneophytou CP, Kontopidis G. Statistical approaches to maximize recombinant protein expression in: A general review. Protein Expr Purif, 2014, 94: 22–32.
[24] Su P, Gong GL. Research progress on optimizing the expression of exogenous proteins in. Biotechnol Bull, 2017, 33(2): 16–23 (in Chinese). 苏鹏, 龚国利. 优化大肠杆菌表达外源蛋白的研究进展. 生物技术通报, 2017, 33(2): 16–23.
[25] Overton TW. Recombinant protein production in bacterial hosts. Drug Discov Today, 2014, 19(5): 590–601.
[26] Haranahalli K, Tong S, Ojima I. Recent advances in the discovery and development of antibacterial agents targeting the cell-division protein FtsZ. Bioorg Med Chem, 2016, 24(24): 6354–6369.
Bacterial expression, preparation and identification of polyclonal antibody againstFtsZ
Yunyu Chen1, Xiayi Niu1, Miao Li1, Ni Li2, and Xiaoping Liu1
1 Research Institute for Pharmaceutical Screening & Evaluation, Wannan Medical College, Wuhu 241002, Anhui, China 2 State Key Laboratory of Bioactive Substances and Function of Natural Medicine, Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
To prepare polyclonal antibody (PcAb) againstfilamentous thermosensitive protein Z (Ec-FtsZ), the artificially synthesized gene fragment coding Ec-FtsZ was subcloned into pET-22b(+) plasmid, and Ec-FtsZ protein was expressed in.BL21(DE3) cell under an optimal bacterial expression condition. Then Ec-FtsZ protein was purified by HisTrap affinity chromatography, and the GTPase (Guanosine triphosphatase) activity of purified Ec-FtsZ protein was further analyzed by malachite green assay. Subsequently, the purified Ec-FtsZ protein was used to immunize rat subcutaneously for preparation of anti-Ec-FtsZ PcAb. The results of enzyme-linked immunosorbent assay (ELISA), Western blotting analysis and immunofluorescence assay showed that the titer of PcAb was 1:256 000, and PcAb exhibited a perfect antigenic specificity against purified and endogenous Ec-FtsZ protein. All these data indicated that the anti-Ec-FtsZ PcAb is successfully prepared, which can be used for further cellular function study and biochemical analysis of Ec-FtsZ protein.
FtsZ protein, bacterial expression, malachite green assay, immunofluorescence assay, polyclonal antibody
January 6, 2019;
March 11, 2019
National Natural Science Foundation of China (Nos. 81503065, 81703546), Anhui Provincial Natural Science Foundation (No. 1808085QH265), Jilin Scientific and Technological Development Program (No. 20160520045JH), The Doctoral Starting-up Fund of Wannan Medical College (No. RCQD201617), College Student Innovation Fund of Wannan Medical College (No. WK2018S54).
Xiaoping Liu. Tel: +86-553-3932601; Fax: +86-553-3932622; E-mail: liuxiaoping@wnmc.edu.cn
Ni Li. Tel: +86-10-83162728; Fax: +86-10-63180604; E-mail: linineon@126.com
国家自然科学基金 (Nos. 81503065,81703546),安徽省自然科学基金 (No. 1808085QH265),吉林省科技发展计划 (No. 20160520045JH),皖南医学院博士科研启动基金 (No. RCQD201617),皖南医学院大学生科研资助金 (No. WK2018S54) 资助。
2019-03-19
http://kns.cnki.net/kcms/detail/11.1998.q.20190318.1733.004.html
10.13345/j.cjb.190011
陈云雨, 牛夏忆, 李淼, 等. 大肠杆菌FtsZ蛋白原核表达及多克隆抗体的制备与鉴定. 生物工程学报, 2019, 35(6): 1117–1125.
Chen YY, Niu XY, Li M, et al. Bacterial expression, preparation and identification of polyclonal antibody againstFtsZ. Chin J Biotech, 2019, 35(6): 1117–1125.
(本文责编 陈宏宇)
