夏梢生长条件下树干供糖对‘砂糖橘’幼果糖代谢及脱落的影响
2019-07-09黄永敬吴文曾继吾陈杰忠张瑞敏朱从一
黄永敬 吴文 曾继吾 陈杰忠 张瑞敏 朱从一


摘 要 为探讨碳素营养在柑橘坐果中的作用,以7年生‘砂糖橘(Citrus reticulata Blanco)为材料,在夏梢生长期采用树干注射蔗糖溶液的方式进行树体供糖处理,分析供糖对幼果糖含量、糖代谢相关酶活性及其脱落的影响。结果表明:夏梢生长促进幼果大量脱落,树干注射蔗糖可促进幼果发育和抑制幼果脱落,花后85 d(夏梢生长15 d)累积落果率为73.35%,比留梢对照下降10.05%。树干注射蔗糖溶液明显促进幼果中蔗糖、淀粉含量的积累,显著抑制幼果中酸性转化酶(AI)、中性转化酶(NI)活性,而对蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)活性影响不明显。据此认为,夏梢生长条件下树干供应蔗糖溶液,通过抑制幼果中蔗糖分解酶(AI和NI)活性的方式促进蔗糖积累,从而有利于坐果。树干供糖并没有显著降低落果率,仅部分抵消夏梢生长对幼果脱落的影响,说明除糖代谢外,同时还存在其他因子参与幼果脱落的调控。
关键词 柑橘;夏梢;供糖;糖代谢;脱落
中图分类号 S666 文献标识码 A
Abstract In order to reveal the roles of carbon nutrition on the fruitlet set under summer shoot growth condition of citrus, the experiment of trunk injection sucrose was carried out in 7-year old ‘Shatangju mandarin (Citrus reticulata Blanco) trees, and the effects of sugar accumulation, sucrose-related enzyme activities and abscission of the fruitlet were studied during the new shoot period. The results showed that, summer shoot obviously increased abscission of fruitlet, and the injecting of sucrose promoted the growth of fruitlet and decreased abscission. At the 85th day after full blossom(15th day of summer shoot growth), the accumulative abscission rate (AAR) in trunk injection sucrose was 73.35%, which was 10.05% lower than that in the control. Trunk-injected sucrose obviously increased the contents of sucrose and starch in the fruitlet, accompanied with the inhibition of the activities of acid invertase (AI) and neutral invertase (NI), but no significant difference was observed for the activities of sucrose phosphate synthase (SPS) and sucrose synthase (SS). It suggested that the increased accumulation of sucrose by the inhibited activities of sucrose degradation enzymes (AI and NI) during injecting sucrose contributed to the fruitlet set in ‘Shatangju mandarin. The injection of sucrose inhibited the fruitlet abscission during shoot growth, but the exogenous sugar couldnt fully offset the impact of summer shoot on the fruitlet abscission. Sugar metabolism was not the only factor involved in the fruitlet abscission process caused by summer shoot growth.
Keywords citrus (Citrus reticulata Blanco); summer shoot; injection sugar; sugar metabolism; abscission
DOI 10.3969/j.issn.1000-2561.2019.08.010
碳素营养由植物成熟叶片通过光合作用而合成,经韧皮部运输至幼叶、茎、花、果实和根中加以贮藏和利用[1]。碳素营养在植物代谢中主要是充当糖信号[2]、碳架和能量[3]等功能角色。果树中,碳素營养对幼果生长发育至关重要,是坐果的重要限制性因子[4]。大量研究结果表明,植株中碳素营养含量的丰缺是调控幼果脱落的一个重要因素,树干环割可中断树体光合同化物的向根运输[5]、疏果则减少营养代谢库数量[6],均缓解幼果间碳素营养竞争而有利于坐果;相反,去叶减少树体光合源[7]、树冠遮阴抑制了叶片光合作用能力[8],均造成树体碳素营养供应不足而促进幼果脱落。
果树的新梢生长常导致幼果大量脱落,已有的研究认为主要是由于新梢的代谢库极其强大,其营养生长消耗树体大量碳素营养,因此与幼果的碳素营养竞争中处强势地位,幼果遭受碳素营养胁迫后导致脱落[4, 9]。‘砂糖橘(Citrus reticulata Blanco)幼果期的新梢(俗称夏梢)生长诱导幼果脱落现象尤为突出,笔者前期研究了‘砂糖橘夏梢生长过程中糖代谢与落果的关系,发现夏梢生长促进幼果蔗糖分解方向的酶活性增加,从而加速幼果中蔗糖分解是导致幼果脱落的重要原因[10],进一步说明碳素营养在新梢调控幼果脱落中的重要性。果树的幼果生长期,增加树体碳素营养储备有利于坐果,而碳素营养的增加如何调控糖代谢和幼果脱落,相关研究尚未见报道。本研究在‘砂糖橘夏梢生长期,通过树干注射蔗糖溶液的方式直接为树体供应碳源,研究供糖后幼果中糖含量、糖代谢酶活性以及幼果脱落的变化,以便为进一步揭示果树新梢生长诱导落果的机理提供理论依据。
1 材料与方法
1.1 材料
试验于2012年4—7月在广州市增城区中新镇‘砂糖橘园进行。试验柑橘品种为7年生‘红橘(Citrus tangerina Hort. ex Tanaka)砧‘砂糖橘(Citrus reticulata Blanco cv. Shatangju),试验树的立地条件一致。
1.2 方法
1.2.1 试验设计 随机选取42株树势、夏梢生长及结果量基本一致的结果树,其中21株树进行树干注射100 g/L蔗糖溶液(此浓度能有效控制柑橘幼果脱落[11]),其余注射蒸馏水作对照。每7株树为一个小区,随机区组排列,3次重复。试验采用的塑料输液袋由四川国光农化股份有限公司提供,大小规格为7.0 cm×29.0 cm,输液袋具有插头2个,输液袋与插头间由长度120 cm的塑料软管连接,试验前每个输液袋中均已灌入蔗糖溶液或蒸馏水(CK)各1000 mL。
于花后40 d进行树干注射处理,每株树均选周径15 cm以上的二级分枝2条,每条分枝于距地面约40~60 cm处用电钻斜向下打注射孔,注射孔与孔水平夹角约为30~45°,孔深2.5 cm。将输液袋的2个插头分别插入注射孔后旋紧、塞实,涂适量凡士林防止病虫感染。灌输液袋统一挂在离地面约1.5~1.7 m的树干上,每株处理树挂1袋。所有的试验树于注射孔下方2~3 cm处进行树干环割处理,以切断碳素营养的向根运输。
于试验树的树冠外围挑选挂果量较一致的7条结果枝进行挂牌、编号,其中3条果穗枝作调查幼果脱落情况,其余果穗枝留作取样分析。每天检查、人工抹除零星抽生的夏芽。花后70 d停止抹梢,让夏梢自然生长。于花后70、73、76、79、82、85 d进行调查落果率及取幼果样。样品用液氮冻存后带回实验室,80 ℃保存备用。
1.2.2 测定方法 (1)树干吸收溶液量的调查方法。花后70 d(已供液30 d),用量筒量取出各试验树输液袋中剩余的溶液体积(V1),剩余溶液重新灌入输液袋后继续供液;花后85 d(已供液45 d),相同方法量取各试验树输液袋中剩余的溶液体积(V2)。花后70 d树体吸收的溶液体积(mL)=V0V1,花后85 d树体吸收的溶液总体积(mL)=V0V2,V0为溶液初始总体积(1000 mL)。
(2)落果率调查。参照Wang等[12]的方法,分别统计相对落果率和累积落果率。
式中,N0为初始坐果数量,Nt1和Nt分别表示前后相邻两个时期的坐果数量,d是调查的间隔天数。以每天计算相对落果量的方式反映相对落果率。
(3)幼果生长发育的调查。采样后立即用电子游标卡尺测量幼果的纵、横径,每重复随机测定幼果2个。
(4)生理指标的测定。蔗糖、还原糖含量分别采用间苯二酚比色法及3,5-二硝基水杨酸比色法测定[13],用酸解法测定淀粉含量[14]。酸性转化酶(AI)、中性转化酶(NI)、蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS)的测定均参照杨子琴等[7]的方法。生理指标的结果值均以鲜重计。
1.3 数据处理
利用Excel 2003软件和SPSS 17.0软件进行数据统计分析和差异显著性检验。
2 结果与分析
2.1 试验树吸收溶液量的比较
如图1所示,花后70 d,平均每株试验树吸收的蔗糖、蒸馏水溶液体积分别为106.1、149.3 mL,花后85 d则分别为137.2、199.1 mL,树体对蒸馏水的吸收量显著大于蔗糖溶液,表明树体更易于吸收蒸馏水。进一步分析发现,前阶段(花后40~70 d)、后阶段(花后71~85 d)吸收的蔗糖分别为3.54、2.07 mL/d,吸收的蒸馏水溶液分别为4.98、3.32 mL/d,表明树体对蔗糖溶液、蒸馏水的吸收规律均为前期大于后期。
2.2 供糖对幼果脱落的影响
如图2A所示,供糖及对照幼果的相对落果率均表现为先升后降的变化趋势。花后73 d(夏梢生长3 d)开始,供糖处理的相对落果率就一直低于对照的,花后82 d时出现落果高峰,相对落果率為6.74%/d,是对照的85.64%。此后落果率有所下降,至花后85 d(夏梢生长15 d)时处理间的落果率下降到同一水平。树干供糖对幼果的累积落果率的影响如图2B所示,花后76 d开始,供糖处理幼果的累积落果率一直低于对照,花后85 d供糖处理幼果的累积落果率为73.35%,比对照降低10.05%,但处理间差异未达到显著水平。
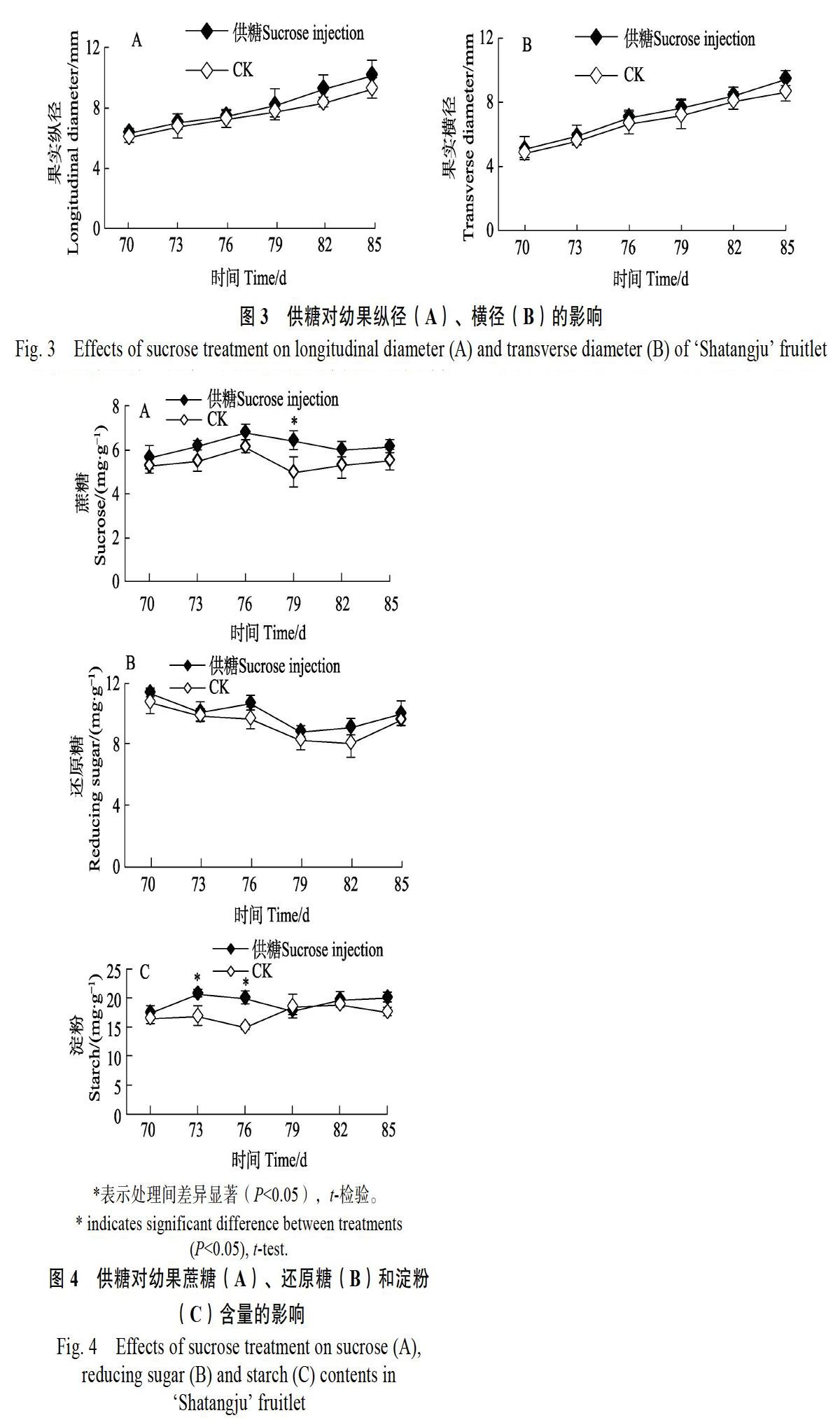
2.3 供糖对幼果生长发育的影响
如图3所示,试验期间,供糖、对照幼果的纵、横径变化均表现为缓慢持续增大的变化趋势。整个试验期间供糖处理幼果的纵径、横径均大于对照的,其中花后76 d开始,幼果生长加速,与对照的差异有逐渐增加趋势,花后85 d幼果的纵径、横径分别比对照增加9.42%和9.17%,表明树体供应蔗糖有利于幼果的生长发育。
2.4 供糖对蔗糖、还原糖和淀粉含量的影响
由图4A可知,供糖、对照幼果的蔗糖含量变化规律总体一致,均表现为先升高后逐渐下降的变化趋势。试验前期幼果的蔗糖含量一度得到升高,花后76 d达到高峰值后逐渐下降,花后82 d后逐渐趋于平稳。整个试验期间,供糖处理幼果中的蔗糖含量均高于对照,其中在花后79 d时蔗糖含量是对照的1.29倍,显著高于对照的,表明树体供应蔗糖有利于幼果蔗糖含量的提高。
试验期间供糖、对照幼果的还原糖含量总体上均表现为先持续下降、后于花后82 d时缓慢回升的变化趋势。整个试验期间,供糖处理幼果中的还原糖含量均高于对照,但差异没有达到显著水平(图4B)。
如图4C所示,树干供应蔗糖溶液一度促进幼果淀粉含量的迅速升高,其中在花后73 d和花后76 d,淀粉含量分别比对照增加22.91%和33.28%,处理间差异达到显著水平。随后供糖处理幼果的淀粉含量有所稳定,而对照有所上升,处理间差异不明显。
2.5 供糖对糖代谢酶活性的影响
由图5A可知,供糖幼果的AI活性变化与对照的总体一致,均表现为先升高后持续下降的变化趋势。于花后76 d时出现酶活性高峰值,峰值出现时间比对照的提前3 d;此时酶活性为16.76 mg/(g?h),略高于对照的15.11 mg/(g?h);整个试验期间的AI活性,除了在花后76 d外,其余时段均低于对照。
幼果的NI活性规律性变化明显,趋势与AI的基本一致。花后70~79 d处理间酶活性持续不断上升,均在花后79 d时出现活性峰值。该时期供糖处理的酶活性均比对照低,其中花后76 d时其酶活性仅为对照的75.66%,处理间达到显著性差异水平;从花后82 d开始,处理间的NI活性有所下降,但供糖处理的降幅相对缓慢,此阶段的酶活性水平反而略高于对照(图5B)。
供糖处理幼果的SPS活性变幅较稳定,具体为试验初始阶段一度引起酶活性水平的下降,但花后76 d后酶活性维持1.1 mg/(g?h) 上下波动,相对而言对照的升降幅度较大,但处理间差异并没有达到显著水平。供糖及对照幼果的SS活性在整个试验期间变化平稳,说明供糖对幼果的SPS、SS活性影响不明显(图5C,图5D)。
3 讨论
树干注射的液体进入树体后快速传导至标靶部位,具有精准、高效以及低污染等优点,在果树的增产、提质和病虫害防控等方面均有应用[15-16]。本研究发现,植株吸收的蔗糖溶液总体积仅为蒸馏水的75.0%,原因可能与糖溶液的渗透势较高,导致树体难以吸收有关[17]。此外,后阶段(花后71~85 d)平均每天吸收的蔗糖、蒸馏水量分别为前阶段(花后40~70 d)的58.5%和66.7%,均表现为后阶段明显小于前阶段的吸收规律。试验后期液体吸收率有所下降,可能与随着输液时间的增加,树体的输液口产生愈伤组织或者侵填体,液体输入受障碍有关[18]。
幼果、新梢均是异养型“库”器官,其生长发育所需的碳素营养主要依赖叶片光合供应。幼果、新梢从外源获取光合同化物的能力取决于自身的库强,幼果的代谢库极弱,其与新梢(强库)的碳素营养竞争中处于劣势地位而导致落果[19]。提高树体碳素营养储备可减缓幼果与新梢间的碳素营养竞争,最终有效控制幼果脱落。Iglesias等[11]对柑橘结果枝进行去叶的同时树干注射蔗糖溶液,发现幼果的落果率比单独去叶的下降36.91%,证明碳素营养在柑橘坐果中的重要性。本研究在砂糖橘夏梢生长的同时进行树干注射100g/L蔗糖溶液,幼果的累积落果率为73.35%,比对照下降10.05%。方差分析显示,与对照间差异不显著,表明树体供应碳素营养仅部分抵消了夏梢生长对落果的影响,暗示在夏梢生长条件下,除碳素营养外,还有其他因素也参与了幼果脱落的调控。
糖类是植物营养生长和生殖生长的基础。树干注入的蔗糖溶液通过筛管向上运输,增加了树体碳素营养总量而有利于植株生长[20]。本研究中,供糖促进夏梢的伸长生长、使新梢提早进入转绿期和自剪期(顶芽自行凋落)的同时,也有利于幼果的生殖生长,果实纵、横径分别比对照增加9.42%和9.17%。树干供糖还有利于幼果中蔗糖和淀粉含量的提高。结合落果规律发现,供糖使花后76~82 d时幼果的蔗糖含量维持在较高水平,同时则相应地抑制了该时期幼果的相对落果率,再次证明了蔗糖在柑橘坐果中重要性[11]。
果实的库强大小常决定于其糖代谢关键酶的活性水平[21]。酸性转化酶(AI)、中性转化酶(NI)、蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS)是糖代谢的主要调控酶,其中AI、NI起分解蔗糖作用,而SPS不可逆地催化蔗糖的合成,SS则可合成也可分解蔗糖,幼果中以分解蔗糖为主。幼果生长发育过程中,可自我调节其糖代谢水平,以应对外界环境、碳素营养胁迫等条件的变化。枸杞幼果遮光[22]、葡萄果实套袋[23]处理使果实的光合作用受到抑制,自身产生的光合产物减少,促进了幼果中AI、NI酶活性的提高,以增强幼果库强而有利于叶片光合产物的向幼果运输。杨子琴等[7]对龙眼结果枝进行摘叶处理,减少树体营养源,幼果遭受饥饿胁迫后,蔗糖分解方向的酶活性一度增强,但随着蔗糖含量的持续降低,蔗糖分解代谢酶活性转而减弱。笔者前期通过人工抹除‘砂糖橘夏梢的方式減轻新梢对幼果脱落的影响,发现新梢生长明显促进幼果AI、NI活性的提高,从而加速幼果中蔗糖的损耗,相反去梢后幼果间碳素营养胁迫下降,幼果AI、NI活性因而受到抑制[10]。本研究发现,幼果中AI和NI的活性远高于SPS和SS,表明调控‘砂糖橘幼果糖代谢的关键酶是AI和NI。测定结果显示,树体供应蔗糖溶液后,幼果中NI活性最先(花后70~79 d)受到抑制,其中在花后76 d,酶活性仅为对照的75.66%;随后(花后79~85 d)AI活性亦受到抑制,其中在花后79 d,酶活性仅为对照的81.72%。据此认为,供糖条件下幼果转化酶活性被抑制,可能与供糖增加了树体碳素营养、减轻了幼果与新梢或幼果间的碳素营养竞争,致使其转化酶活性有所降低有关。AI、NI活性的下降,降低蔗糖的分解速度并有利于幼果中蔗糖的积累,而幼果期蔗糖对柑橘坐果是至关重要的[11]。此外,树体供糖对幼果SPS、SS活性影响不明显,再次证明了‘砂糖橘夏梢诱导幼果脱落过程中,SPS、SS在参与调控幼果脱落调控中处次要地位。
综上所述,‘砂糖橘夏梢生长条件下,树干供应蔗糖可抑制转化酶活性,进而影响幼果中糖的积累,从而有利于坐果。树干供应蔗糖虽然在一定程度上减轻落果,但不能全部抵消新梢生长对落果的影响,证明糖代谢不是调控幼果脱落的唯一因素。
参考文献
Rolland F, Moore B, Sheen J. Sugar sensing and signaling in plants[J]. The Plant Cell, 2002, 14: S185-S205.
Ruan Y L, Jin Y, Yang Y J, et al. Sugar input, metabolism, and signaling mediated by invertase: roles in development, yield potential, and response to drought and heat[J]. Molecular Plant, 2010, 3(6): 942-955.
Cheng L L, Fuchigami L H. Growth of young apple trees in relation to reserve nitrogen and carbohydrates[J]. Tree Physiology, 2002, 22(18): 1297-1303.
McFadyen L M, Robertson D, Sedgley M, et al. Post-pruning shoot growth increases fruit abscission and reduces stem carbohydrates and yield in macadamia[J]. Annals of Botany, 2011, 107: 993-1001.
Roussos P A, Tassis A. Effects of girdling, nitrogen, zinc and auxin foliar spray applications on mandarin fruit ‘Nova quality characteristics[J]. Emirates Journal of Food and Agriculture, 2011, 23(5): 431-439.
Lakso A N, Robinson T L, Greene D W. Integration of environment, physiology and fruit abscission via carbon balance modeling-implications for understanding growth regulator responses[J]. Acta Horticulture, 2006, 727: 321-326.
杨子琴, 李 茂, 章笑赟, 等. 饥饿胁迫对龙眼果实脱落及糖代谢的影响[J]. 果树学报, 2011, 28 (3): 428-432.
Zhu H, Dardick C D, Beers E P, et al. Transcriptomics of shading-induced and NAA-induced abscission in apple (Malus domestica) reveals a shared pathway involving reduced photosynthesis, alterations in carbohydrate transport and signaling and hormone crosstalk[J]. BMC Plant Biology, 2011, 11: 138.
Nicolás E, Lescourret F, Genard M, et al. Does dry matter partitioning to fruit in early- and late-ripening peach (Prunus persica) cultivars confirm the branch autonomy theory[J]? The Journal of Horticultural Science and Biotechnology, 2006, 81(3): 444-448.
黄永敬, 马培恰, 吴 文, 等. 砂糖橘夏梢生长对果实糖代谢及脱落的影响[J]. 园艺学报, 2013, 40(10): 1869-1876.
Iglesias D J, Tadeo F R, Primo-Millo E, et al. Fruit set dependence on carbohydrate availability in citrus trees[J]. Tree Physiology, 2003, 23: 199-204.
Wang Y C, Li T L, Meng H Y, et al. Optimal and spatial analysis of hormones, degrading enzymes and isozyme profiles in tomato pedicel explants during ethylene-induced abscission[J]. Plant Growth Regulation, 2005, 46(2): 97-107.
湯章城. 现代植物生理学实验指导[M]. 北京: 科学出版社, 1999.
张志良, 瞿伟菁, 李小方. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2009.
VanWoerkom A H, A?imovi? S G, Sundin G W, et al. Trunk injection: An alternative technique for pesticide delivery in apples[J]. Crop Protection, 2014, 65: 173-185.
宋锋惠, 张 萍, 史彦江. 树干注射铁肥对新疆灰枣产量和品质的影响[J]. 西北农业学报, 2013, 22(6): 102-107.
Abdin O A, Zhou X M, Coulman B E, et al. Effect of sucrose supplementation by stem injection on the development of soybean plants[J]. Journal of Experimental Botany, 1998, 49(329): 2013-2018.
Zhou X M, Smith D L. A new technique for continuous injection into stems of field-grown corn plants[J]. Crop Science, 1996, 36(2): 452-456.
Racskó J, Leite G B, Petri J L, et al. Fruit drop: the role of inner agents and environmental factors in the drop of flowers and fruits[J]. International Journal of Horticultural Science, 2007, 13 (3): 13-23.
Martínez-Trinidad T, Watson W T, Arnold M A, et al. Carbohydrate injections as a potential option to improve growth and vitality of live oaks[J]. Arboriculture & Urban Forestry, 2009, 35(3): 142-147.
Sun J D, Loboda T, Sung S J, et al. Sucrose synthase in wild tomato, Lycopersicon chmielewskii, and tomato fruit sink strength[J]. Plant Physiology, 1992, 98 (3): 1163-1169.
羅 宵, 郑国琦, 郑紫燕, 等. 宁夏枸杞果实遮光处理对果实糖积累和相关酶活性的影响[J]. 西北植物学报, 2008, 28(5): 984-989.
周兴本, 郭修武. 套袋对红地球葡萄果实发育过程中糖代谢及转化酶活性的影响[J]. 果树学报, 2005, 22(3): 207-210.
