刺梨、桑叶、苦瓜饮料对糖尿病小鼠的降糖作用
2019-07-09陈小敏谭书明宋长军
陈小敏,谭书明*,黄 颖,陈 萍,宋长军
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州大学 生命科学学院贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025)
糖尿病主要是由于胰岛素缺乏或分泌不足引起的糖代谢紊乱疾病[1]。目前治疗糖尿病主要采用口服降糖类药物或注射胰岛素等,然而往往低效且缺乏安全性[2]。近年来,许多研究者逐渐将天然植物应用于糖尿病的治疗,因其具有毒副作用小且应用广泛等优点[3-4]。
刺梨(Rosa roxburghii Tratt)又名茨梨,为蔷薇科缫丝花的果实[5]。广泛分布于我国的云南、四川、贵州等地[6]。刺梨果实中含有丰富的维生素C、矿物质元素、有机酸、黄酮类等营养物质[7]。有研究报道,刺梨中的黄酮类物质具有预防糖尿病的作用[8]。
苦瓜(Momordica charantia L.)又名“锦荔枝”、“癞瓜”等,是一种药食两用植物[9]。苦瓜中含有丰富的多糖、多肽、皂苷、类黄酮等活性成分[10],被广泛的应用于糖尿病的辅助治疗。
桑叶(Morus alba L.)是桑科桑属植物桑的叶子,中国的桑叶资源丰富,品种繁多[11]。桑叶中含有丰富的多糖、黄酮类化合物、多种氨基酸等活性成分,具有降血糖、抗衰老、降低胆固醇等功效[12-13]。该研究以刺梨、桑叶、苦瓜为原料制作饮料,并研究该配方饮料对糖尿病小鼠的降糖作用,旨在为降糖饮料的研究提供参考。
1 材料与方法
1.1 材料与试剂
刺梨汁(100%):市售;苦瓜汁(料水比1∶1榨汁)、桑叶汁(料水比1∶4榨汁):贵州省农畜产品贮藏与加工重点实验室自制。
无特定病原体(specific pathogen free,SPF)级昆明种小鼠(kunming mice,KM)(雄性,体质量18~22 g):辽宁长生生物技术股份有限公司[生产许可证:SCXK(辽)2015-0001]。
葡萄糖、柠檬酸、柠檬酸钠(AR):成都金山化学试剂有限公司;盐酸二甲双胍(纯度≥98%):源叶生物科技有限公司;链脲佐菌素(streptozotocin,STZ)(纯度98%):美国Sigma公司;586型鱼跃血糖仪与配套血糖试纸:江苏鱼跃医疗设备股份有限公司;糖化血清蛋白(glycated serum protein,GSP)试剂盒、糖化血红蛋白(glycosylated hemoglobin,GHb)试剂盒、血清胰岛素(serum insulin,INS)酶联免疫分析试剂盒、肝糖原试剂盒:上海桥杜生物科技有限公司。
1.2 仪器与设备
SpectraMax190连续波长多功能酶标仪:美国Molecular Devices公司;H1-16KR高速冷冻离心机:湖南可成仪器设备有限公司;R-201旋转蒸发器、L5S紫外-可见分光光度计:上海仪电分析仪器有限公司;DY89-II电动玻璃匀浆机:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 配方提取液制备
根据感官评定确定刺梨桑叶苦瓜饮料的最优配比为桑叶汁20%、苦瓜汁6%、刺梨汁74%,混合后4℃保存,备用[14-15]。
1.3.2 I型糖尿病小鼠模型的建立
小鼠适应性喂养7 d后,随机选取8只作为空白组(NC);其余24只小鼠经过12 h禁食,不禁水,腹腔注射STZ 150 mg/kg体质量诱导I型糖尿病小鼠模型。建模期间自由饮食饮水,建模后第3天小鼠禁食10 h后剪尾采血测定空腹血糖值(fasting blood glucose,FBG),当FBG值>11.1 mmol/L(200 mg/100 mL),视为建模成功[16]。
1.3.3 糖尿病小鼠的分组及喂养
建模成功的小鼠随机分组(n=8),分别为空白组(NC)、模型组(MC)、阳性组(PC)、配方饮料组(CS)。模型组、空白组灌胃0.1 mL/10 g体质量柠檬酸钠缓冲液;阳性组灌胃0.1 mL/10 g体质量盐酸二甲基双胍溶液;配方饮料组灌胃0.1 mL/10 g体质量配方饮料。灌胃4周。
1.3.4 测定方法
小鼠饮食饮水量:每隔24 h测定小鼠的饮食饮水量,连续4周,每周的数据以平均值表示。
体质量:每隔1周测量体质量一次,连续4周。
空腹血糖(FBG)的测定:每隔1周进行1次剪尾采血,测定FBG(禁食不禁水6 h),连续4周。
口服糖耐量:灌胃结束后小鼠禁食不禁水16 h进行葡萄糖耐量实验,每只小鼠按2 g/kg体质量剂量灌胃给予葡萄糖,测定给予葡萄糖后0、0.5 h、1 h和2 h时的血糖值。血糖曲线下面积(area under curve of glucose,AUCG)根据以下公式计算:
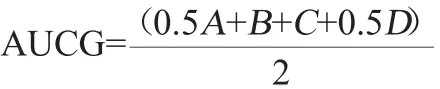
式中:AUCG表示白糖曲线下面积,mmol/(L·h),A、B、C、D分别代表给予葡萄糖后0、0.5 h、1.0 h和2.0 h的血糖值。
糖化血红蛋白(GHb)和糖化血清蛋白(GSP):灌胃结束后禁食不禁水12 h,通过摘眼球取血,室温条件下静置1 h,3 500 r/min离心15 min,分离血清与血浆,按试剂盒说明书的操作步骤进行GHb和GSP的测定。
血清胰岛素:具体操作步骤按试剂盒说明书进行测定。
小鼠肝糖原:灌胃结束后小鼠脱颈处死,解剖取其肝脏,生理盐水漂洗干净,吸水纸吸干肝脏表面的水分,转入-80℃冰箱保存备用,测定时具体操作步骤按试剂盒说明书进行。
小鼠脏器指数:小鼠取血处死前称量体质量并记录,快速解剖取其肝脏、心脏、肾脏、脾脏等组织。用生理盐水洗净,吸水纸擦干后精确称量各组织器官质量并记录,各器官质量与体质量的比值即为脏器指数。
1.3.5 数据分析
实验结果以平均值±标准差(x¯±s)表示,采用 SPSS 22.0进行统计分析。
2 结果与分析
2.1 各组小鼠饮食饮水量的变化
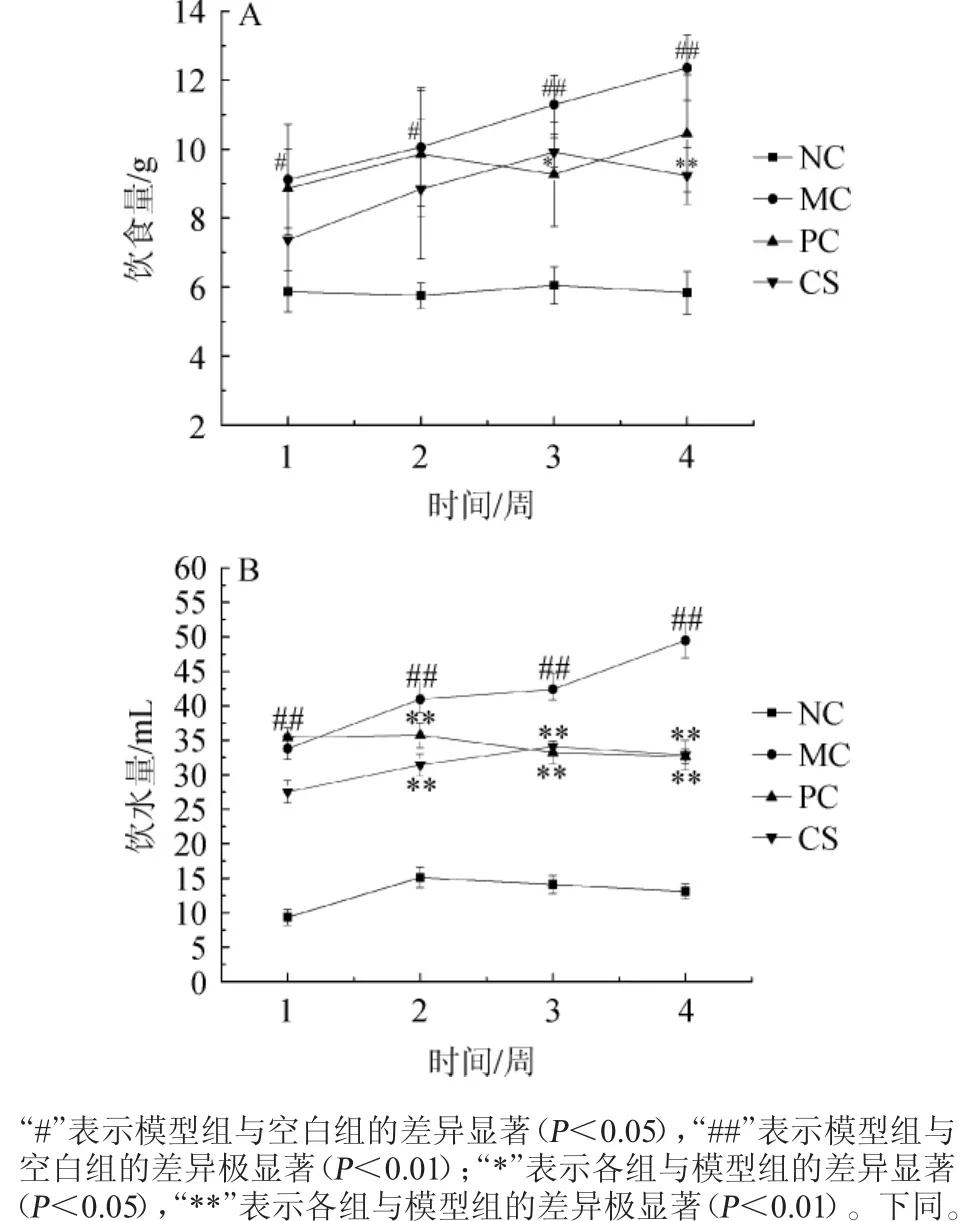
图1 配方饮料对糖尿病小鼠饮食量(A)、饮水量(B)的影响Fig.1 Effect of formula beverage on food intake(A)and water intake(B)of diabetic mice
由图1可知,空白组小鼠饮食、饮水量无明显变化,其他组与空白组相比,饮食、饮水量均有不同程度的上升,第4周时,空白组小鼠饮食量为(5.84±0.61)g,模型组为(12.36±0.95)g,差异性极显著(P<0.01),阳性组、配方饮料组与模型组比较,饮食量分别下降了15.45%、25.32%。与空白组比较,模型组小鼠的饮水量一直呈现上升趋势,第4周时,空白组小鼠饮水量为(13.06±1.12)mL,模型组小鼠为(49.5±2.52)mL,差异性极显著(P<0.01),阳性组、配方饮料组与模型组比较,饮水量分别下降了34.06%、33.60%,差异性极显著(P<0.01)。说明模型组小鼠经造模后胰岛细胞被破坏,分泌胰岛素的能力下降,导致糖尿病症状越来越严重;与模型组相比,阳性组和配方饮料组能有效改善糖尿病小鼠多饮多食症状。
2.2 配方饮料对糖尿病小鼠体质量的影响
糖尿病小鼠体质量下降主要是由于血糖过高引起葡萄糖、蛋白质等能量物质吸收受到阻碍,不能被吸收的物质只能从尿液中排出,导致体质量下降,尿液增加。由图2可知,第1周时,其他组与空白组比较,体质量明显下降,特别是模型组体质量极显著下降(P<0.01),说明建模成功。经治疗4周后,空白组小鼠体质量上升趋势明显,增长率为8.82%;模型组与空白组比较体质量极显著下降(P<0.01),降低了11.43%;与模型组比较,阳性组和配方饮料组小鼠体质量呈现缓慢上升趋势,差异性显著(P<0.05),增长率分别为3.54%、4.06%。说明配方饮料能通过促进葡萄糖的吸收利用,减少能量的流失。
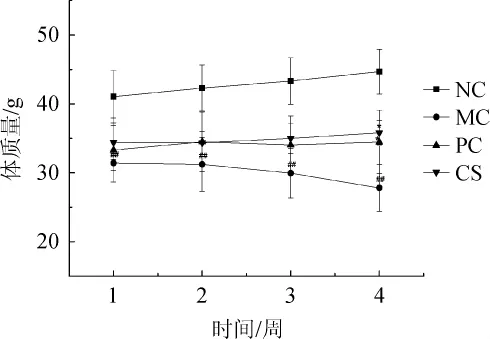
图2 配方饮料对糖尿病小鼠体质量的影响Fig.2 Effect of formula beverage on body mass of diabetic mice
2.3 配方饮料对糖尿病小鼠空腹血糖(FBG)的影响
FBG是目前临床上判断糖尿病的常用检测手段之一,当FBG值>11.1 mmol/L(200 mg/100 mL)视为糖尿病患者。各组小鼠的FBG值如图3所示。由图3可知,第1周时,空白组小鼠FBG值为(8.14±1.04)mmol/L,模型组为(25.48±2.24)mmol/L,模型组与空白组相比,FBG值显著升高,差异性极显著(P<0.01),说明由STZ诱导的糖尿病小鼠胰岛细胞受损严重,胰岛素分泌降低,导致血糖水平显著上升;而阳性组和配方饮料组连续治疗4周后,FBG值不断下降,特别是第4周时,与模型组相比,差异性极显著(P<0.01),血糖值分别降低了46.87%、51.02%,而配方饮料组与造模时相比,血糖值下降了45.58%,达到了(13.90±1.56)mmol/L,虽未到达正常的血糖值,但配方饮料能一定程度降低糖尿病小鼠的FBG值。说明配方饮料可能对胰岛细胞具有修复作用,能促进胰岛素的分泌,缓解血糖的升高。
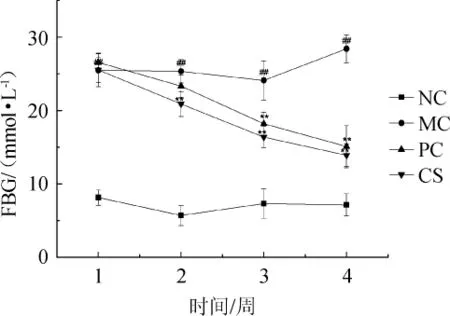
图3 配方饮料对糖尿病小鼠空腹血糖的影响Fig.3 Effect of formula beverage on fasting blood glucose in diabetic mice
2.4 配方饮料对糖尿病小鼠糖耐量的影响
糖耐量试验可以检测机体对血糖浓度的调控,如果服葡萄糖2 h后血糖值介于7.8~11.1 mmol/L,表明机体糖耐量能力减低[17]。各组小鼠糖耐量实验结果如表1所示。
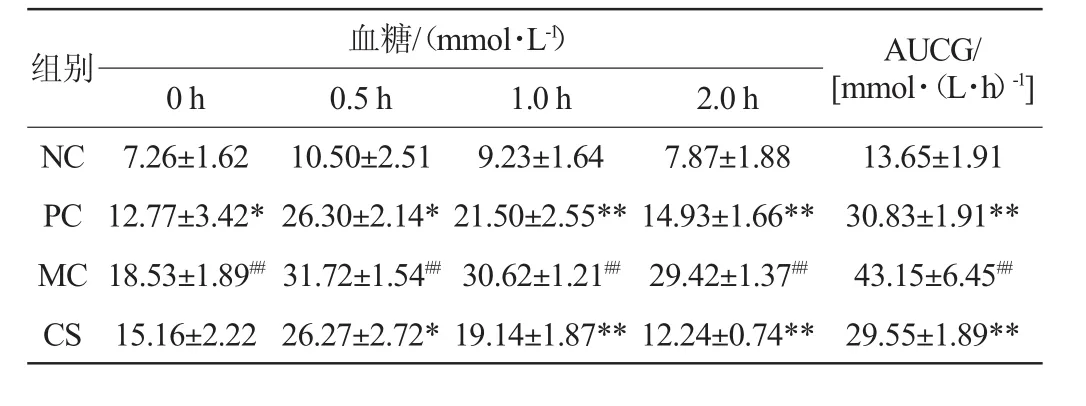
表1 配方饮料对糖尿病小鼠糖耐量的影响Table 1 Effect of formula beverage on glucose tolerance of diabetic mice
由表1可知,口服葡萄糖溶液0.5 h时,各组小鼠的血糖值均达到最大值,模型组小鼠血糖值与空白组相比,差异性极显著(P<0.01)。2.0 h时空白组小鼠血糖值达到正常水平(7.87±1.88)mmol/L,模型组小鼠的血糖值仍保持在较高值(29.42±1.37)mmol/L,是空白组的3.74倍,差异性极显著(P<0.01),说明模型组小鼠糖耐量受损严重,阳性组与配方组较模型组分别降低了49.25%、58.40%,差异性极显著(P<0.01),而配方组血糖值降至(12.24±0.74)mmol/L,未达到正常值范围,但能一定程度上有效改善小鼠的高血糖水平。空白组小鼠白糖曲线下的面积(AUCG)较模型组下降了68.37%,差异性极显著(P<0.01),阳性组和配方组白糖曲线下的面积(AUCG)较模型组分别下降了28.55%、31.52%,差异性极显著(P<0.01),表明配方饮料组能有效增强糖尿病小鼠对葡萄糖的耐受能力,调控血糖水平。
2.5 配方饮料对糖尿病小鼠GHb、GSP和INS的影响
GHb和GSP能准确反映机体过去1~2个月内的血糖变化情况,是目前常用来测定血糖的指标。由表2可知,模型组的GHb和GSP分别是空白组的2.87倍和3.67倍,血糖水平极显著升高(P<0.01),说明糖尿病症状严重。而阳性组与配方饮料组的GHb含量比模型组降低了18.83%、29.53%,差异极显著(P<0.01)。GSP含量与模型组相比,阳性组降低了10.89%、差异显著(P<0.05);配方饮料组降低了14.81%,差异极显著(P<0.01)。表明配方饮料能一定程度上改善由于胰岛细胞受损导致胰岛素的分泌不足而引起的血糖水平升高情况,对降低糖尿病小鼠血糖水平具有辅助治疗效果。

表2 配方饮料对糖尿病小鼠血糖指标的影响Table 2 Effects of formula beverage on blood glucose indexes of diabetic mice
INS是机体内唯一降低血糖的激素。由表2可知,空白组小鼠的血清胰岛浓度为(47.45±0.15)mU/L,模型组小鼠的血清胰岛浓度为(35.05±0.34)mU/L,模型组与空白组相比,INS含量降低了26.13%,差异性极显著(P<0.01),说明胰岛细胞受损,STZ干扰了小鼠体内胰岛素的分泌,造模成功。而阳性组和配方饮料组与模型组比较,INS含量分别升高了20.94%、24.82%,差异性极显著(P<0.01),说明二甲双胍和配方饮料可以通过修复胰岛细胞促进糖尿病小鼠血清胰岛素的分泌。
2.6 配方饮料对糖尿病小鼠肝糖原的影响
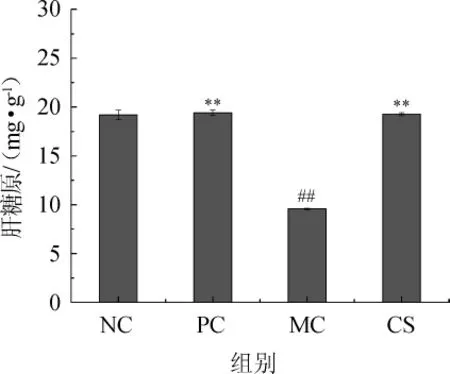
图4 配方饮料对糖尿病小鼠肝糖原的影响Fig.4 Effect of formula beverage on hepatic glycogen of diabetic mice
糖原是体内葡萄糖的重要储存形式,糖原异生和合成是血糖的重要来源和去路,糖原合成减少或者分解增加均能引起血糖水平的升高,所以糖原含量与糖尿病的发展密切相关[18]。由图4可知,模型组与空白组相比,肝糖原含量极显著降低(P<0.01),是空白组的50%,说明模型组小鼠肝脏受损,合成糖原能力减弱。而阳性组和配方饮料组肝糖原含量比模型组显著增高(P<0.01),分别是模型组的2.03倍和2.01倍,表明盐酸二甲双胍和配方饮料能增加糖尿病小鼠的肝糖原合成能力,降低肝糖原的分解,抑制血糖水平的升高。
2.7 配方饮料对糖尿病小鼠脏器指数的影响
脏器指数可以反映机体的健康情况。由表3可知,模型组的肝脏指数与空白组相比,增高了28.33%,差异极显著(P<0.05),模型组小鼠的肝脏出现明显的肿大现象;阳性组与配方饮料组的肝脏指数比模型组分别降低了13.02%、9.25%,说明盐酸二甲双胍和配方饮料能有效的改善糖尿病小鼠肝脏肿大现象。由表3可知,模型组的肾脏指数比空白组极显著增高了56.76%(P<0.01),说明模型组小鼠后期可能伴随有肾病的产生,阳性组与配方饮料组的肾脏指数比模型组下降了24.14%、26.29%,差异极显著(P<0.01),说明配方饮料对糖尿病小鼠的肾脏具有一定的保护作用。脾脏指数一定程度上可以反映机体的免疫能力,模型组的脾脏指数比空白组极显著升高了52.17%(P<0.01),配方饮料组比模型组极显著下降了22.86%(P<0.01),表明配方饮料能增强小鼠的免疫力。
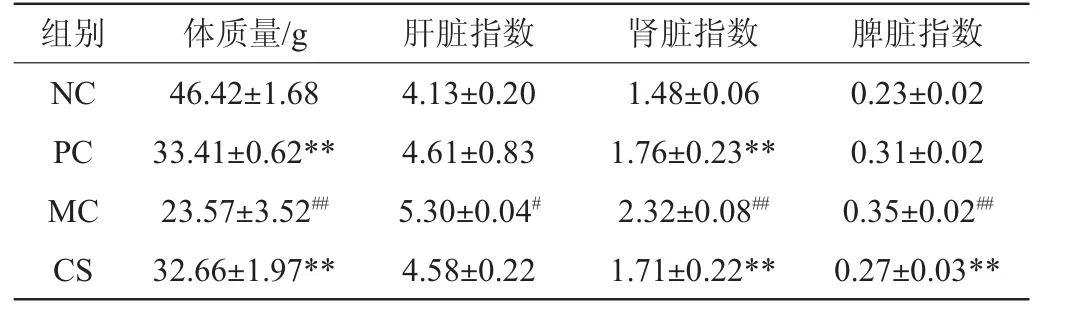
表3 连续灌胃4周后小鼠的脏器指数Table 3 Organ indexes of mice after continuous gavage for 4 weeks
3 结论
本实验从天然植物中选取无毒副作用且具有降糖效果的苦瓜、桑叶与刺梨汁进行复配研发一款降糖配方饮料。通过一次性高剂量腹腔注射STZ诱导Ⅰ型糖尿病小鼠模型,连续灌胃给与配方饮料4周后观察小鼠的降糖效果。结果发现,与模型组比较,配方饮料组多饮多食的症状明显好转,体质量增长率为4.06%,FBG下降了45.58%、白糖曲线下的面积(AUCG)下降31.52%,GHb和GSP分别降低29.53%、14.81%,INS含量升高24.82%,肝糖原含量升高101%,表明该配方饮料对糖尿病小鼠具有辅助降糖效果。
