2015—2017年陕西省药品不良反应报告表质量评价*
2019-07-08牛瑞向玉芳白军锋赵楠樊瑞姚雪林冯变玲
牛瑞,向玉芳,白军锋,赵楠,樊瑞,姚雪林,冯变玲
(1.西安交通大学药学院药事管理与临床药学系,西安 710061;2.西安交通大学药品安全与政策研究中心,西安 710061;3.陕西省食品药品监督检验研究院,西安 710065)
自1988年我国试行药品不良反应(adverse drug reaction,ADR)监测制度至今,ADR监测在保证药品上市后安全性方面发挥了不可替代的作用[1-2]。目前我国ADR报告收集模式仍然以自发报告为主,仅2017年,国家ADR监测网络就收到《药品不良反应/事件报告表》142.9万份[3],每百万人口年均1068份,远超世界卫生组织(WHO)要求的每百万人口年均300份。自发报告在检测药品新的安全问题方面具有很大的优势[4],但也有其公认的局限性和缺陷,其中报告的质量是影响报告系统发挥风险预警、信号挖掘等作用的重要的基础性因素[5]。因此在保证ADR数据稳步上升的同时,不断提高报告质量、提高数据可利用性成为我国面临的一项艰巨而又重要的任务。对ADR报告质量进行评价与分析,提高报告质量刻不容缓。笔者在本文通过对陕西省2015~2017年ADR报告质量进行评价,分析影响ADR报告质量的因素,以期为ADR上报工作的规范化和科学化提供参考依据。
1 数据来源与方法
1.1数据来源 本研究以陕西省药品不良反应监测中心2015—2017年收集到的ADR/不良事件(adverse event,AE)报告为主要研究对象。以陕西省每年总ADR/AE报告为样本框,运用统计学公式1计算所需样本量,再对每年数据进行系统抽样,抽取最终样本[6]。
公式1:N=P(1-P)/(e2/Z2+P(1-P)/N)
其中P:样本变异度,取最大值0.5;e:调查结果的精度值百分比(5%);N:样本总量;Z:取值为1.96 (置信范围95%)。
运用笔者所在课题组前期已构建的质量评分体系,由一位课题组成员依据已有的评价标准和分值,对最终所选样本报告逐条进行评价、赋分,完成之后,由本课题组另一位成员进行分数复核。统计分析ADR/AE报告65项指标的得分情况。按照五级制分级方法,将ADR/AE报告质量分为以下5个等级(总分1000分):
优秀:ADR/AE报告质量评价总分≥900分;良好:ADR/AE报告质量评价总分在800~<900分;中等:ADR/AE报告质量评价总分在700~<800分;合格:ADR/AE报告质量评价总分在600~<700分;不合格:ADR/AE报告质量评价总分<600分。
笔者认为,报告质量达到良好和优秀水平,ADR/AE报告可利用性较高。
1.2统计学方法 应用EXCEL工作表格对评价结果进行描述性统计分析。运用SPSS19.0版统计软件进行卡方检验,对不同职业上报人员和不同性质报告对ADR/AE报告项目填写准确情况的差异性进行比较,P<0.05为差异有统计学意义。
2 结果
2.1ADR/AE报告 抽样结果陕西省2015年共收集到ADR/AE报告36 715份,即N=36 715,通过公式1计算得到最终抽取样本量379。同理,2016和2017年最终抽取样本量均为380。
2.2ADR/AE报告质量评价结果
2.2.12015—2017年ADR/AE报告质量分级 对1139份ADR/AE报告进行质量评价,平均成绩692.6分,达到合格水平。具体来看,其中“优秀”报告占0.00%(n=0),“良好”报告占1.40%(n=16),“中等”报告占44.51%(n=507),“及格”报告占49.60%(n=565),“不及格”报告占4.48%(n=51),详见表1。进一步分析ADR/AE报告质量状况变化情况,发现2015—2017年,“良好”ADR/AE报告数量较稳定,“中等”ADR/AE报告数量逐年增长,“中等”以下(“及格”和“不及格”)报告数量逐年下降。
2.2.2报告性质与质量分级 对2015—2017年陕西省不同性质ADR/AE报告的质量情况进行统计分析,详见表2。结果表明,ADR/AE报告质量普遍存在缺陷,无论是一般ADR/AE报告,新的ADR/AE报告,还是严重的ADR/AE报告,质量评估分数达到优秀的均为0。其中,新的、严重的ADR/AE报告在相应类别中的中等水平报告占比更高,分别达53.47%,50.00%,一般报告占42.38%。
2.2.3报告单位类别与质量分级 对2015—2017年陕西省不同报告单位ADR/AE报告的质量情况进行统计分析,见表3。结果表明,医疗机构上报的ADR/AE报告质量较佳,其中等报告占比更高,达49.44%,经营企业、生产企业分别占34.11%,22.22%。
2.2.4报告人职业与质量分级 对2015—2017年陕西省不同职业上报的ADR/AE报告质量情况进行统计分析,详见表4。结果表明,护士上报的ADR/AE报告质量较佳,其中等报告占比更高,达58.16%,医生、药师分别占比48.20%,38.74%。
2.2.5项目扣分概况统计 对2015—2017年样本ADR/AE报告中的9大项内容、56条具体项目进行逐条评价赋分,结果见表5。
由表5可见,报告基本信息、ADR分析、报告人信息、报告单位信息、警戒性这5项内容填写完整规范,质量较高。而患者基本信息、涉及药品信息、ADR基本信息这3大项中,仅小部分具体项目填写质量较高,多数项目填写扣分比例大,整体质量较差。
具体看,在患者基本信息中,扣分报告数目较多的是病历号/门诊号和相关重要信息缺失,占比分别高达40.21%,83.58%;在涉及药品信息的项目中,怀疑药品的商品名称和用药原因缺失扣分报告数所占比较高,分别达到65.32%,43.72%;在ADR基本信息中,信息缺失最严重的为干预ADR时间、ADR终止时间以及ADR体征描述,分别占比高达58.91%,67.08%,30.55%,并且ADR名称作为ADR报告中的重要一项,其规范性扣分达到39.33%。此外,在所有项目中扣分最多的是报告人邮箱缺失,占比高达91.92%。
根据ADR/AE报告质量评分表中各条目的权重值,将各项目按照所占权重由大到小以及扣分占比由高到低排序,筛选出权重较大且扣分情况严重的项目共计12条:ADR体征描述、上报时限、原患疾病、既往ADR/AE、用药原因、ADR终止时间、家族ADR/AE、怀疑药品批准文号、干预ADR时间、ADR干预措施、相关重要信息、ADR名称规范性。结合文献查阅结果,从报告人职业、报告性质两个方面对报告完整性影响进行进一步分析。结果见表6,7(仅显示有差异性的项目)。
表6结果表明,不同人员对ADR的上报时限、ADR干预时间、终止时间以及干预措施这4个项目填写的质量差异有统计学意义(P<0.01),护士填写质量显著高于医师、药师和其他人员;不同上报人员对原患疾病(P=0.01)和用药原因(P<0.01)的填写规范性差异有统计学意义,医师和护士的报告优于药师和其他人员。
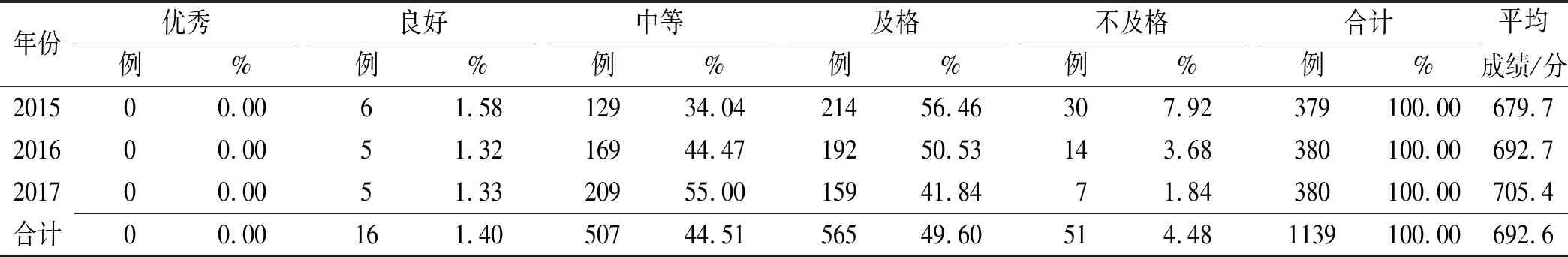
表1 陕西省2015—2017年ADR/AE报告质量分级
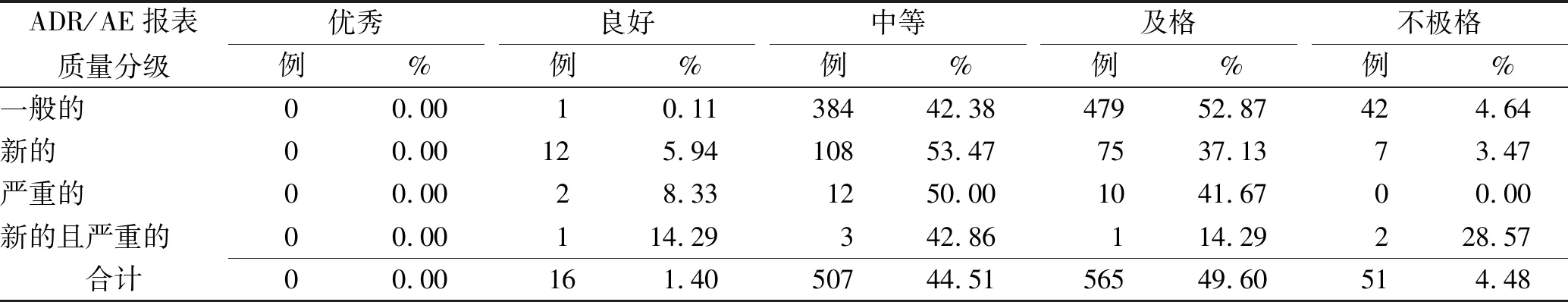
表2 陕西省2015—2017年ADR/AE报告性质与质量分级

表3 陕西省2015—2017年ADR/AE报告单位类别与质量分级
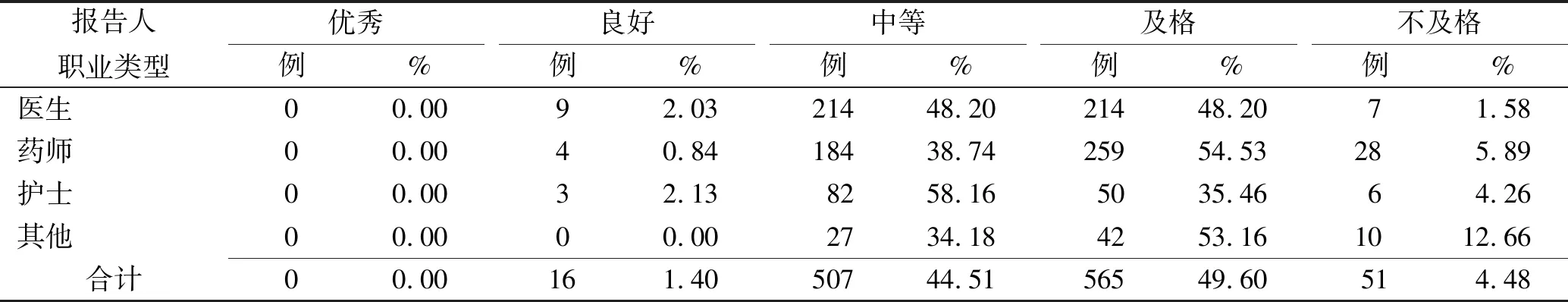
表4 陕西省2015—2017年ADR/AE报告人职业与质量分级
表5 陕西省2015—2017年ADR/AE报告中具体项目质量评分结果
Tab.5SpecificprojectqualityofADR/AEreportinShaanxiprovincefrom2015to2017
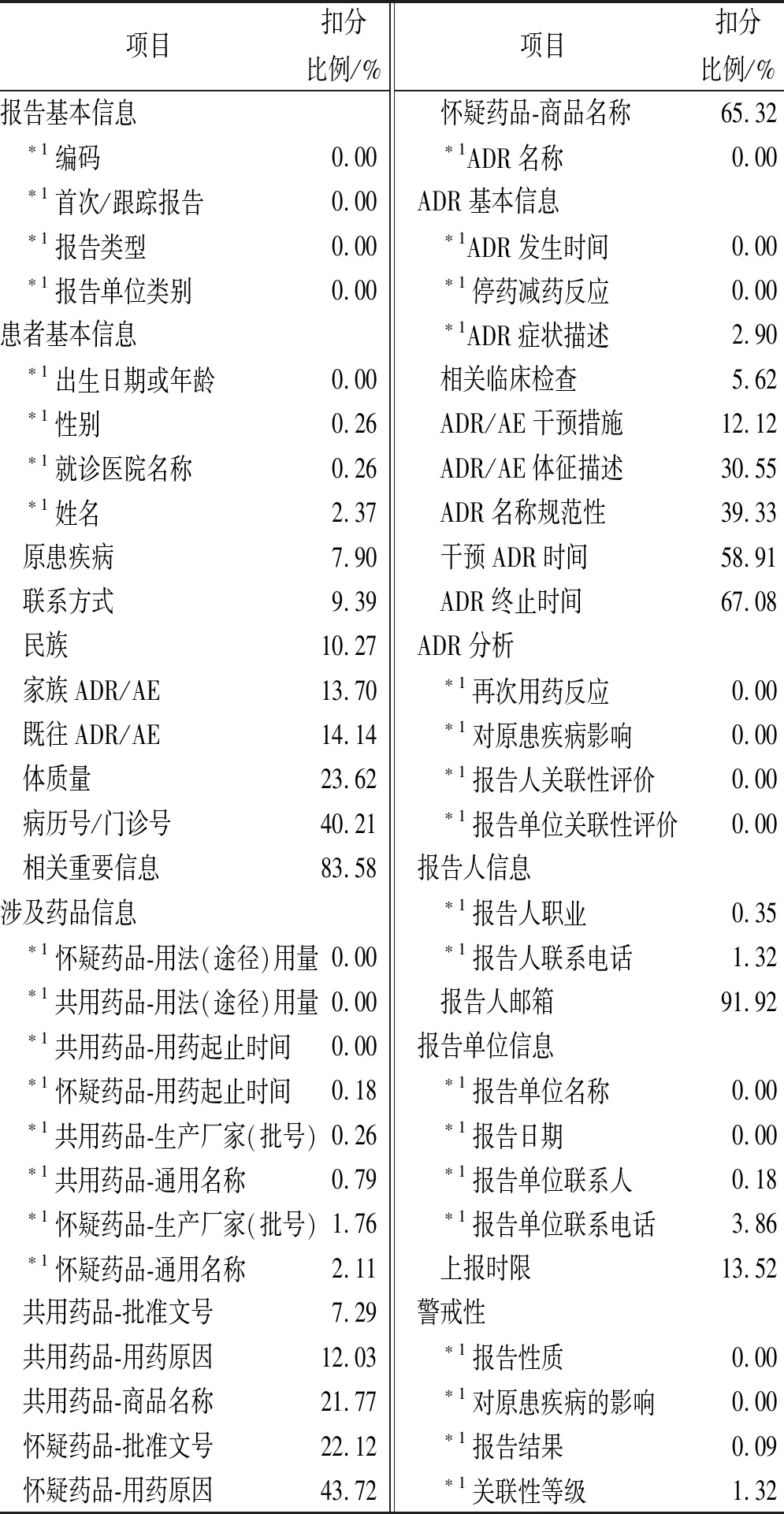
项目扣分比例/%报告基本信息 ∗1编码0.00 ∗1首次/跟踪报告0.00 ∗1报告类型0.00 ∗1报告单位类别0.00患者基本信息 ∗1出生日期或年龄0.00 ∗1性别0.26 ∗1就诊医院名称0.26 ∗1姓名2.37 原患疾病7.90 联系方式9.39 民族10.27 家族ADR/AE13.70 既往ADR/AE14.14 体质量23.62 病历号/门诊号40.21 相关重要信息83.58涉及药品信息 ∗1怀疑药品-用法(途径)用量0.00 ∗1共用药品-用法(途径)用量0.00 ∗1共用药品-用药起止时间0.00 ∗1怀疑药品-用药起止时间0.18 ∗1共用药品-生产厂家(批号)0.26 ∗1共用药品-通用名称0.79 ∗1怀疑药品-生产厂家(批号)1.76 ∗1怀疑药品-通用名称2.11 共用药品-批准文号7.29 共用药品-用药原因12.03 共用药品-商品名称21.77 怀疑药品-批准文号22.12 怀疑药品-用药原因43.72项目扣分比例/% 怀疑药品-商品名称65.32 ∗1ADR名称0.00ADR基本信息 ∗1ADR发生时间0.00 ∗1停药减药反应0.00 ∗1ADR症状描述2.90 相关临床检查5.62 ADR/AE干预措施12.12 ADR/AE体征描述30.55 ADR名称规范性39.33 干预ADR时间58.91 ADR终止时间67.08ADR分析 ∗1再次用药反应0.00 ∗1对原患疾病影响0.00 ∗1报告人关联性评价0.00 ∗1报告单位关联性评价0.00报告人信息 ∗1报告人职业0.35 ∗1报告人联系电话1.32 报告人邮箱91.92报告单位信息 ∗1报告单位名称0.00 ∗1报告日期0.00 ∗1报告单位联系人0.18 ∗1报告单位联系电话3.86 上报时限13.52警戒性 ∗1报告性质0.00 ∗1对原患疾病的影响0.00 ∗1报告结果0.09 ∗1关联性等级1.32
*1项目的扣分比例<5%,填写质量较高
*1The deduction ratio of project is less than 5%, and the filling quality is high
表7结果表明,不同性质的报告上报时限差异有统计学意义(P<0.001),其中严重的、新的且严重的ADR报告填写质量更差,分别占比41.67%,57.14%;不同性质报告的怀疑药品批准文号完整性差异有统计学意义(P=0.013),新的ADR报告完整性较高;ADR名称规范性信息准确率差异有统计学意义(P=0.046),一般报告ADR名称填写规范性显著高于其他3类。
3 讨论
3.1ADR/AE报告整体质量评价结果分析 据2015—2017年陕西省药品不良反应报告质量总体评估结果显示,ADR/AE报告质量达到良好水平以上的报告数量极少,占比1.4%,报告质量多数集中于及格与中等水平,平均692.6分(满分1000分),仅达到及格水平,可见ADR/AE报告数据质量较差,亟需改进提升。
在对不同ADR/AE性质的报告质量分析中,新的、严重的ADR/AE报告数量在中等水平占比更高,新的、严重药品不良反应报告质量较好,可能由于上报主体对于新的、严重ADR/AE报告更重视。在对不同单位上报的ADR/AE报告质量分析中,发现医疗机构上报的ADR/AE报告质量水平较高,可能与医疗机构本身专业性较强有关;生产企业、经营企业的不良反应报告主要来源于患者自诉不良反应记录或通过电话记录整理,因此会出现信息不完整、不及时等因素影响质量。在对不同职业人员上报的ADR/AE报告质量分析中,发现护士上报的ADR/AE报告质量较高,因为护士通常是接触患者的一线卫生专业人员,能够直接接触患者进而完整地上报ADR。
3.2ADR/AE报告具体项目质量评价结果分析 在ADR/AE报告表中,填写质量较高的项目有以下特点,一是均为基本信息,如报告基本信息、报告人信息、报告单位信息等;二是在报告表中有固定选项,上报人员可以直接选择。专业性不强,易于填写。
填写质量较差的项目主要有两类,一是这些项目需要运用医药相关的专业知识进行判断,而上报人员可能专业知识有所欠缺,或者对某些项目的理解认知有缺失。如对ADR过程描述不完整,ADR过程描述主要包括ADR发生、干预、终止时间、体征描述等内容。但对于干预时间和终止时间两项重要的时间点,其信息缺失率分别达到58.91%,67.08%,对于ADR体征描述的信息缺失率也达30.55%,说明上报人员只填写对症状的描述,容易忽视体征的进一步记录;ADR名称书写不规范,主要表现为所记录的ADR有标准名称却没有填写相应的标准名称,或者是描述中口语化严重,说明报告人对于ADR名称术语规范性掌握的专业程度不够;此外在评价过程中还发现,报告人在用药原因项目中填写了原患疾病,说明上报人对原患疾病和用药原因的认知不够清晰,容易产生混淆。分析发现,由护士和医生填写的这类项目的质量优于其他类型上报人员,进一步说明具有一定专业知识更易于填写此类项目。

表6 不同职业上报人员对ADR/AE报告项目填写准确情况的差异性比较

表7 不同性质ADR/AE报告项目填写准确情况的差异性比较
第二类质量较差的项目,通常内容较简单,但上报人对其不够重视因而不填或填写不具体造成。如既往史、家族ADR/AE史、相关重要信息等作为ADR报告中有关患者信息的重要项目,其报告信息缺失是较普遍的问题,其中相关重要信息的缺失率达到80%。主要表现为信息缺失和信息不具体,如过敏史,没有具体填写因何过敏,既往(家族)ADR/AE的信息中,只填写有,没有具体信息;再如上报人邮箱漏填,扣分比例最高,药品的商品名称和批准文号等漏填扣分比例也较高。探究分析发现,此类项目质量情况与报告人职业和ADR性质无明显关联,表明这是普遍存在的问题,可能是报告人对此项信息不够重视。
此外,ADR上报时限的扣分比例达到13.52%,且发现一般ADR报告时限准确率显著高于新的、严重的ADR报告。而我国《药品不良反应报告和监测管理办法》中规定,新的、严重的药品不良反应应于发现或者获知之日起15 d内报告,死亡病例须立即报告,其他药品不良反应30 d内报告[7]。可能由于一般报告上报时限较长,因而其准确率较高,而新的、严重ADR并不能按要求及时上报。
4 建议
4.1提高上报主体对ADR上报重要性的认知 要提高ADR报告的质量,首先要提高报告的源头即上报主体对ADR上报重要性的认知。相关部门应在各上报主体中开展多形式的ADR危害性和ADR上报重要性的相关宣传。尤其是生产企业作为药品质量安全第一责任人,在ADR监测工作中的主体地位应大力加强,应尽快提高生产经营企业的ADR上报质量。首先可在法律法规层面进一步明确细化生产企业的监测工作要求,同时监管部门要加强对企业履责情况的监督检查。其次,企业自身按照要求配备专业监测人员,设置监测机构,对收集到的ADR报告本企业相关工作人员应定期进行质量审核。同时向群众宣传药品不良反应的相关知识与信息,提高他们的ADR识别能力与自我保护意识,自觉上报药品不良反应。
4.2提高上报人员的专业水平 上报人员与报告质量的关系密切相关,因此应定期对各级ADR上报人员进行专业培训,内容可包括如何发现和上报ADR及报表各项信息的具体含义。并且可以结合平时审核工作中工作人员遇到的实际问题进行针对性讲解,如对本研究中扣分比例较高的项目进行重点讲解,强调各项目规范填写的重要性,保证上报人员认真对待ADR报告填报。
4.3设置严格的ADR报告审查评估制度 各上报主体聘请有专业知识的人员负责审查评估收集到的ADR报告。对上报人提交的ADR报告进行严格审查,判断其真实性、完整性和准确性。如果发现有缺项或内容不规范不详细则及时与上报人员沟通完善,以保证上报信息有效性。设置相应的奖惩制度,对上报质量高的工作人员给予一定奖励。
4.4改善ADR报告在线提交功能 目前,我国ADR报告上报主要采取网络直报的方式。可对电子报表填写页面进行改善,如在完整性项目填写中,设置必须填写、否则无法提交的功能,这样可以在一定程度上减少漏报情况;对于填写中出现的逻辑错误,如出生日期晚于ADR发生日期、体质量值异常等,信息录入后系统自动提示,待录入者对错误信息修改完成后方可提交;对规范性项目的填写,可以在系统内录入相应数据库信息,录入者在填写时可以得到相应的提示,根据提示进行选择,从而在一定程度上减少信息规范性错误。
