伊曲康唑凝胶的制备及体外透皮性考察*
2019-07-08夏爱晓周鹏林忠孙渊章艳蒋正立
夏爱晓,周鹏,林忠,孙渊,章艳,蒋正立
[1.台州恩泽医疗中心(集团)浙江省台州医院药剂科临床药学实验室,台州 317000;2.温州医科大学药学院,温州 325035]
婴幼儿血管瘤(infantile hemangioma,IH)是目前婴幼儿中最常见的良性生长肿瘤,可累及皮肤或内脏器官[1]。IH发病率8.7%~12.7%,早产儿高达30%[2]。可自行消退的IH占较大比例,但对于复杂难治性IH需采用外科手术或药物治疗才能彻底缓解。目前临床治疗IH的方法多样。在药物治疗方法中,普萘洛尔为目前治疗IH的一线药物[3]。但口服普萘洛尔治疗IH存在安全隐患和不良反应,并有减缓心率作用。故临床考虑局部外用药物治疗IH,以提高患者依从性,特别是针对口服给药困难的婴幼儿,目前主要局部外用治疗IH的药物有噻吗洛尔、咪喹莫特和中草药制剂。
伊曲康唑(itraconazole,ITZ)是近年来发现具有抗血管瘤作用的药物[4-5],口服伊曲康唑对血管瘤改善率达80%~100%,安全性较好。研究表明,伊曲康唑具有抑制血管及血管内皮细胞增生作用,但具体机制尚不清楚,可能与其抑制内皮细胞胆固醇运转、抑制 hedgehog 信号传导通路等有关。
伊曲康唑几乎不溶于水,因此其口服制剂生物利用度低,全身大剂量给药易导致不良反应,局部外用制剂可避免全身性不良反应。笔者在本实验制备伊曲康唑凝胶外用制剂,该制剂可长时间停留于瘤体表面,使药物与皮肤充分接触,发挥良好药效,降低毒性,并具有缓释效果,提高用药依从性,对于开发治疗IH的伊曲康唑外用制剂具有一定应用前景。
1 仪器与试药
1.1仪器 Waters高效液相色谱系统,包含:Waters717自动进样器,1525四元泵,2487紫外检测器,breeze数据获取处理系统(美国Waters公司);Waters ODS2(250 mm×4.6 mm,5 μm)色谱柱(美国Waters公司);TP-2A/3A型智能药物透皮扩散实验仪(上海互佳仪器设备有限公司);PHS-3CPH计(上海精密科学仪器有限公司),XY-80A涡旋混合器(上海医大仪器厂),XMTD-204数显式电热恒温水浴锅(常州诺基仪器有限公司),SB25-12D超声波清洗机(宁波新芝生物科技有限公司),AL104电子分析天平[梅特勒-托利多仪器(上海)有限公司,感量:0.1 mg]。
1.2试药 伊曲康唑原料药(武汉东康源科技有限公司,含量:99.7%,批号:20161101),卡波姆940(德国BASF公司,批号:WPOG565B,含量:99%),三乙醇胺(分析纯,天津市东丽区天大化学试剂厂,批号:20171015);二甲亚砜(DMSO,分析纯,天津市登丰化学品有限公司,批号:20170901),聚乙二醇(PEG,北京市海淀会友精细化工,批号:FA7030291,含量:99.9%),噻酮(南京龙潭精细化工有限公司,批号:20170412,含量:99%),甘油(郑州祖辉化工产品有限公司,批号:20171217011,含量:99.7%),甲醇(色谱纯,天津四友精细化妆品有限公司,批号:533776-08616)。
2 方法与结果
2.1伊曲康唑凝胶的制备
2.1.1伊曲康唑凝胶基质与辅料的选择 卡波姆940是一类非常重要的流变调节剂,三乙醇胺中和卡波姆等酸性高分子凝胶后可得到优质凝胶基质,低浓度即可形成高黏度凝胶[6]。以卡波姆940为基质制得的凝胶易涂展,无油腻性,黏附性和均匀性良好,对皮肤和黏膜无刺激性,不污染衣物,药物呈零级或近似零级释放[7]。用卡波姆制备的凝胶浓度一般为0.5%~2.0%[8]。
伊曲康唑为脂溶性药物,在水中几乎不溶,油水分配系数(lgP)为5.66,lgP在1~3的药物具有良好的透皮潜能,需用三乙醇胺作为pH值调节剂。PEG-400为液体,与各种溶剂广泛相容,是很好的溶剂和增溶剂。DMSO有“万能溶剂”之称,是最常用的溶剂,集溶剂和渗透促进剂的优点于一身,是最早和最广泛研究的渗透促进剂之一,具有高渗透性[9]。
噻酮是近年来发现的新型外用制剂促渗剂。其高效促渗作用得到广泛关注,将1%噻酮作为药物促渗剂可提高临床疗效[10]。
2.1.2正交设计优选处方 经查阅文献,结合预实验,确定处方为伊曲康唑含量1%、DMSO含量5%、噻酮含量1%、三乙醇胺适量。根据2015年版《中华人民共和国药典》对凝胶的要求优选处方,确定影响凝胶形成的3个重要因素,分别为卡波姆用量(A,0.5%~2.0%)、甘油用量(B,5%~10%)、PEG-400用量(C,10%~15%),利用L9(34)正交表进行处方设计优化,见表1。凝胶综合评分为考察指标,满分为10分,见表2(均匀度考察:各取上、中、下部位凝胶0.1 g,配制成10 μg·mL-1样品溶液,比较样品中伊曲康唑含量,最大值与最小值差异越小越均匀。热稳定性考察:取样品1 g,密封,50 ℃恒温条件下放置1周,每日测定一次样品中伊曲康唑含量,最大值与最小值的差异越小热稳定性越好)。
表1 正交实验的因子水平
Tab.1Factorsandlevelsintheorthogonaldesign%

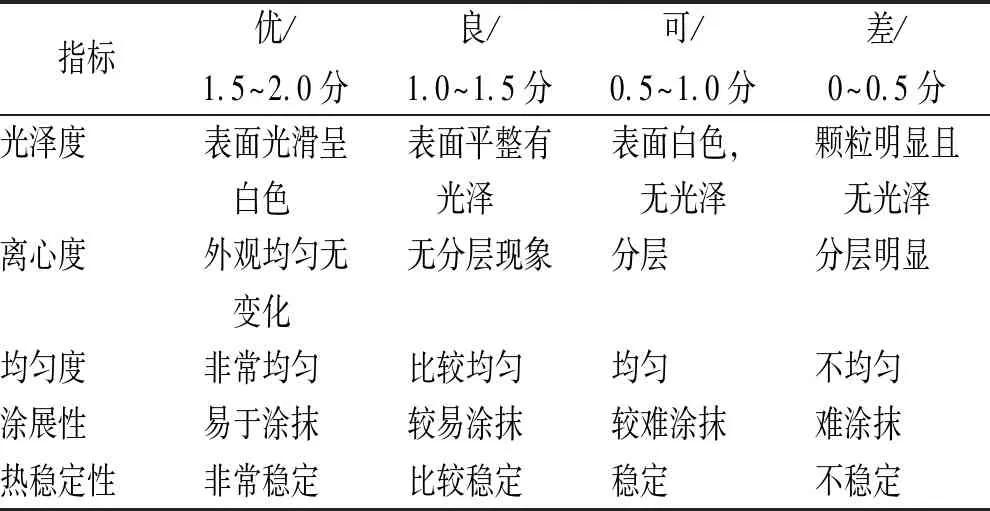
表2 评分标准
正交设计方案和结果见表3,根据极差大小,判断因素主次,RA>RB>RC,因此因素A是影响实验指标的主要因素,最优工艺条件为A2B3C3。图1说明各因素水平之间存在主效应,凝胶评分随因子水平而变化。图2说明三者之间存在相互作用,响应均值的变化取决于另一因子的水平,如A与B的交互作用,行1列2图表示在A的2水平,横坐标B的3水平凝胶评分值最大,这个组合最好。因此,处方的最佳配比为卡波姆(A2)1.0%,甘油(B3)10%,PEG-400(C3)15%。根据最佳配比,按照伊曲康唑 1 g,波姆940 1 g,甘油10 mL,PEG-400 15 mL,DMSO 5 mL,噻酮1 mL,三乙醇胺适量,加纯化水至100 g,制备伊曲康唑凝胶样品3批。制成的凝胶细腻均匀,涂展性良好。

表3 正交实验方案与结果
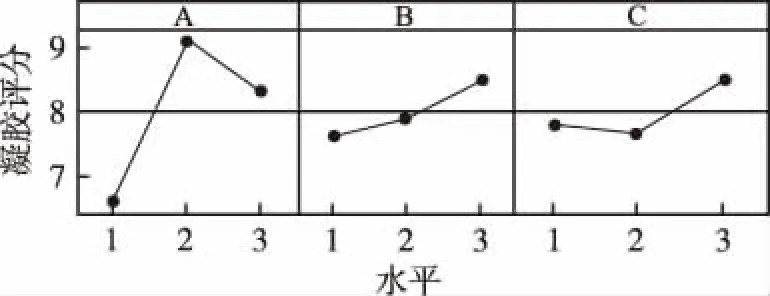
图1 主效应图

图2 交互作用图
2.1.3稳定性实验 取优选后的同一批样品,分别在室温放置0,2,4,6,8,12,24 h,测得其峰面积分别为467 834,455 697,455 987,462 025,455 127,449 879,450 120,计算得RSD为1.4%(n=7),表明该伊曲康唑凝胶在24 h内稳定性良好。
取3批已放置一周的伊曲康唑凝胶样品各3 g,置于离心管,以10 000 r·min-1离心20 min,凝胶无分层。
2.2液相测定方法的建立
2.2.1色谱条件与溶液的配制 色谱柱:迪玛ODSC18柱(4.6 mm×250 mm,5 μm);流动相:甲醇-水(体积比90:10);流速:1.0 mL·min-1;检测波长:261 nm;柱温:25 ℃;进样量:20 μL。
供试品溶液:精密称取伊曲康唑凝胶0.1 g,置烧杯中,加入适量甲醇溶解,摇匀,超声10 min溶解完全后,转移至100 mL量瓶,用甲醇定容,摇匀,得10 μg·mL-1的溶液。经孔径0.45 μm微孔滤膜过滤,取续滤液为供试品溶液。
对照品溶液:精密称取干燥至恒重的伊曲康唑原料药0.02 g于100 mL量瓶,加适量甲醇溶解并定容,摇匀,稀释后得10 μg·mL-1对照品溶液。
2.2.2标准曲线的绘制 精密称取伊曲康唑25.00 mg于25 mL量瓶,加适量甲醇,超声溶解,再用甲醇定容至刻度,摇匀。精密量取上述溶液1.00 mL至25 mL量瓶,加甲醇定容至刻度,摇匀,得40 mg·L-1伊曲康唑储备液。分别精密量取该储备液0.5,1.0,2.0,3.0,4.0,5.0 mL至10 mL量瓶,加甲醇定容至刻度,摇匀,得一系列标准液,分别进样,采用HPLC法测定,得标准曲线方程A=41 559C+38 110,R2=0.999。结果显示伊曲康唑在2.00~20.00 μg·mL-1浓度范围内与峰面积线性关系良好。
2.2.3精密度实验 取供试液20 μL进样,测定。取峰面积积分值计算得日内精密度RSD值为1.11%。连续3 d每天测定6份样品的精密度,方法同上。得日间RSD为1.47%。结果表明精密度良好。
2.2.4回收率实验 按处方量配制3份不含伊曲康唑的空白凝胶基质,分别加入80%,100%,120%处方量的伊曲康唑原料药,按“2.1.1”项方法配制溶液,测定其峰面积,计算得回收率分别为96.5%,100.4%,95.3%。平均回收率为97.4%,RSD为1.99%。
2.3体外透皮实验 取处理好的大鼠皮,剪成适当大小,将鼠皮固定于改进的Franz立式扩散池接受器上口,表皮层在上。其中扩散池的有效渗透面积(A)为3.4 cm2。一般用0.9%氯化钠溶液作为接受液来模拟人体皮肤生理环境,由于伊曲康唑水溶性很差,故在0.9%氯化钠溶液中加入PEG-400增加其溶解度,加入PEG-400体积分数为20%。在接受室中加入接受液15 mL,使接受液与处理好的大鼠皮充分接触。称取凝胶1.0 g均匀涂在皮肤表面,固定装置。将此装置置于温度为(32.0±0.5)℃TP-2A/3A型智能药物透皮扩散实验仪上,磁力搅拌,并开始计时。分别于1,2,4,6,8,10,12,24 h抽取接受液3 mL,并同时加入等体积同温度空白接受液。取出的接受液过孔径0.45 μm滤膜,弃去初滤液,取续滤液20 μL进样,记录峰面积,求药物浓度,计算累积释药量。
样品的制备:取凝胶0.1 g,加适量含20%PEG-400的0.9%氯化钠溶液溶解,超声10 min,再转移至100 mL量瓶,用20%PEG-400的0.9%氯化钠溶液定容即得10 μg·mL-1样品溶液。
Q=(CnVn+ΣCi·Vi)∕A
式中:Q为单位皮肤累积渗透量,Cn为第n次取样时药物浓度,Vn为接受室的总体积,Ci为第n-1次取样时药物浓度,Vi为每次取样的体积,A为有效渗透面积。
伊曲康唑凝胶在大鼠皮肤上的累积渗透量结果, 其24 h皮肤累积渗透量Q为(6.88±0.10) μg·(cm2)-1(n=3)。将样品各时间点渗透量的均数与时间的关系,分别采用零级动力学、一级动力学、Higuchi方程3种数学模型进行拟合,分析其体外渗透性。以单位面积累积渗透量(Q)对时间(t)分别进行一级、零级、Higuchi方程拟合,结果分别为lgQ=0.015t+0.520(R2=0.899)、Q=0.016t+0.317(R2=0.949)、Q=0.102t1/2+0.188(R2=0.977)。结果表明伊曲康唑凝胶的体外释放符合Higuchi方程,随着时间的增加其累积释放量也逐步增加,在前1 h经皮渗透比较明显,之后透过较缓慢,分析原因,可能是前1 h由于浓度差的快速透过皮肤,使皮下迅速达到治疗浓度,之后就缓释透过,维持一定治疗浓度后药物缓慢释放,达到较久的治疗作用。
3 讨论
伊曲康唑为脂溶性药物,在水中几乎不溶,故考虑先将伊曲康唑溶于有机溶剂,再与基质混合均匀。根据2015年版《中华人民共和国药典》,结合实际凝胶评选标准,利用正交设计进行处方优化,最后筛选出处方最佳配比为卡波姆1.0%,PEG-400 15%,甘油用量10%,制得的凝胶均匀细腻,性质稳定。选择合适的体外透皮实验条件是反映药物透皮吸收特征的重要因素[12]。由于伊曲康唑为脂溶性药物,故在0.9%氯化钠溶液中加入PEG-400来增加其溶解度。体外渗透实验结果表明伊曲康唑凝胶体外释放率高,该药物具有缓释作用效果,有部分伊曲康唑贮存在皮肤中,随着时间的累积其贮存量也越来越多,这将有利于IH的治疗。
目前国内外伊曲康唑的上市制剂有伊曲康唑胶囊、伊曲康唑软膏、伊曲康唑口服液,用于治疗真菌性疾病,HIV阳性或免疫系统损伤患者的口腔或食道念珠菌病[13]。伊曲康唑暂无适于治疗IH的制剂,将其制成凝胶有利于药物充分吸收,且安全性良好,可提高患者依从性,用于治疗IH具有价值。后期将对伊曲康唑的药效学及作用机制做进一步的探索。
