注射用艾塞那肽在中国健康人体的安全性评价*
2019-07-08李忠芳刘亚妮曾繁典师少军
李忠芳,刘亚妮,曾繁典,师少军
(1.华中科技大学同济医学院附属协和医院妇产科,武汉 430022;2.华中科技大学同济医学院附属协和医院药剂科,武汉 430022;3.华中科技大学同济医学院临床药理研究所,武汉 430030)
胰高血糖素样肽(肠促胰素)-1(glucagon-like peptide 1,GLP-1)受体激动剂是新一代糖尿病治疗药物,临床用于1型和2型糖尿病的治疗,可显著降低血糖和糖化血红蛋白(hemoglobin A1c,HbA1c)[1-2]。其通过促进葡萄糖依赖的胰岛素分泌,抑制胰高血糖素分泌,减少食物摄取,抑制胃排空,促进胰岛β细胞增生,增加外周组织对胰岛素的敏感性等机制起到调节血糖作用。该类药物还具有减轻体质量、降低血压和改善其他心血管危险因素的潜在作用[3-4]。艾塞那肽(exenatide)由美国Amylin公司和美国礼来公司共同研发,是由39种氨基酸组成的多肽,与人GLP-1具有53%同源性,其通过GLP-1受体介导发挥降血糖作用[5]。艾塞那肽注射液(Byetta公司生产,商品名:百泌达)于2005年4月获美国食品药品监督管理局(FDA)批准在美国上市,2006年11月获欧盟委员会授予在欧盟各国的销售许可,是国际上第一个GLP-1类药品[6]。本品临床用于二甲双胍、磺酰脲类或二甲双胍和磺酰脲类联合应用不能充分控制血糖的2型糖尿病患者的辅助治疗,以改善血糖控制,临床效果显著[7-8]。与艾塞那肽注射液有关的不良反应常较轻,最常见为剂量依赖性消化道症状(恶心、呕吐和腹泻等),但随着治疗继续,不良反应发作次数和严重程度均下降,耐受性良好[9]。但艾塞那肽在中国人群的安全性研究笔者少见报道。本研究以中国健康受试者为研究对象,评价中国健康人群单次和多次皮下注射给予注射用艾塞那肽的安全性和耐受性,以期为该药临床合理给药提供依据。
1 材料与方法
1.1受试者选择
1.1.1入选标准 ①性别:男女各半;②年龄:18~45岁,同一批受试者年龄相差不宜>10岁;③体质量指数(BMI)19~24 kg·(m2)-1;④全面健康体检合格,血常规、尿常规、血生化、心电图、胸部X线片检查无异常或异常无临床意义;⑤自愿参加本试验,并签署知情同意书。
1.1.2排除标准 ①妊娠期妇女、哺乳期妇女、经期妇女;②体检不符合上述受试者健康标准者;③试验前2周内曾应用其他药物者(包括中药);④有精神疾病史、药物依赖史、滥用药物史、有明显烟酒嗜好者;⑤有慢性心血管、肝、肾、消化道、内分泌、免疫、呼吸系统疾病史者;⑥已知对试验药物及同类药物有过敏史者;⑦采血有困难者;⑧最近3个月献血者及参加其他临床试验采血者。
1.1.3退出和剔除标准 ①受试者依从性差,研究者认为其不能完成临床试验者;②受试者不愿意继续进行临床试验,向研究者提出退出者;③无任何记录者;④采样时间错误;⑤用药剂量与方法错误;⑥采样后处理、储藏、运输方法失误;⑦使用了影响试验结果的药物。
1.1.4终止标准 ①在拟用受试剂量下,出现重度不良反应,应终止全部试验;②在拟用受试剂量下,半数以上受试者发生中度不良反应,应终止全部试验。
1.2试验药物 注射用艾塞那肽,规格:每瓶100 μg,批号:20100101-1;研制单位:长春百克生物科技有限公司。遮光、密封,2~8 ℃保存。
注射用艾塞那肽专用溶媒,每瓶2.0 mL,批号:20100101-0,研制单位:长春百克生物科技有限公司。遮光、密封,2~8 ℃保存。
用药方法:将艾塞那肽100 μg用专用溶媒2 mL稀释,不同组別分别给予0.1 mL(5 μg)、0.2 mL(10 μg),上臂三角肌部位皮下注射,15 s内注射完毕。
1.3试验设计 采用单中心、开放、随机分组试验。选择符合入选标准的健康成年受试者24例,随机分为小、大剂量组,每组12例,男女各半。分别单次及多次皮下注射受试制剂。
1.4试验过程 单次给药:2组剂量分别为5,10 μg。受试者试验前1 d禁食10 h,受试当天早晨7:00上臂皮下注射给药,8:00统一清淡饮食。
多次给药:小、大剂量组受试者单次给药结束后进入多次给药,连续皮下注射给药5 d,于第2~4天每天上臂皮下注射给药2次。给药方法:每日7:00和17:00各上臂皮下注射给药1次(餐前1 h)。
试验期间受试者均应在Ⅰ期临床研究室内接受临床监测,避免剧烈运动,亦不得长时间卧床,禁服茶、咖啡及其他含咖啡和醇类的饮料。
1.5实验室监测
1.5.1生命体征 单次给药受试者在用药前,皮下注射用药后1,4和8 h测定生命体征和耐受性指标(症状、体征);给药前及给药后24 h进行实验室检查。多次给药前及给药后30 min测定生命体征和耐受性指标(症状、体征);给药前及给药结束后1 h记录心电图;给药前及给药后24 h进行实验室检查。
1.5.2心电图(electrocardiograms,ECG) 分别于给药前及给药结束后1 h记录十二导联心电图。
1.5.3血糖 单次皮下注射给药前(0 h)及皮下注射给药后0.25,0.50,0.75,1.00,1.25,1.50,2.00,2.50,3.00,4.00,5.00,6.00和8.00 h采血测定血糖。分别于多次给药第3,4,5天上午用药前及用药后0.25,0.50,0.75,1.00,1.25,1.50,2.00,2.50,3.00,4.00,5.00,6.00 和8.00 h采集血样测定血糖。
1.5.4实验室检查 血常规、尿常规、血电解质(Ca、P),肝功能[总胆红素(T-BiL)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)等],肾功能[血清尿素氮(BUN)、血清肌酐(Cr)]。
1.5.5不良反应 询问并记录受试者用药后神经、循环、呼吸、泌尿、消化等系统自我感觉和变态反应。
1.6统计学方法 采用SPSS 11.5版软件进行统计分析。计量资料以均数±标准差、最大值、最小值、中位数描述;计数资料以频数表、百分率或构成比描述。统计受试者入选数量、脱落和剔除病例情况,人口学统计和其他基线特征及安全性分析。所有统计学检验均采用双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1受试者一般情况 24例受试者平均(23.63±1.53)岁;身高(1.64±0.06) m;体质量(55.86±5.58) kg;体质量指数(20.66±1.14) kg·(m2)-1。按照分组,24例受试者中22例受试者完成了2个剂量组单次和多次耐受性试验临床观察,2例受试者中途退出(未给予其他药物,因恶心、呕吐、食欲不振等不良反应退出试验)。注射用艾塞那肽耐受性试验受试者分布情况见表1。
表1 注射用艾塞那肽单次和多次给药耐受性试验受试者分布情况
Tab.1Subjectsdistributioninthetolerancestudyaftersingle-andmultiple-dosesubcutaneousadministrationofexenatideforinjection例

2.2实验室监测
2.2.1生命体征 给药前后受试者体温、脉搏、呼吸、血压等生命体征均无异常改变,给药后30 min各组受试者体温36.1~36.7 ℃;呼吸频率16~24次·min-1;心率61~98次·min-1;血压91~121/60~80 mmHg(1 mmHg=0.133 kPa)。
2.2.2ECGs 给药前后均未出现异常ECGs。各组受试者心电图给药后各时间点与给药前比较及各组间比较,均差异无统计学意义。
2.2.3血糖 健康受试者单次、多次皮下注射艾塞那肽5 μg后0.25 h即可监测到血糖开始降低,给药后0.75~1.25 h血糖降低最明显,低于血糖正常值范围(P<0.01)。然后开始缓慢上升,给药后约2.5 h血糖值恢复至给药前水平。多次给药后0.25~4 h血糖降低较单次给药更明显(P<0.05或P<0.01)。结果见图1。
同样观察到,健康受试者单次、多次皮下注射艾塞那肽10 μg后0.25 h即可监测到血糖值开始降低,给药后0.75~1.25 h血糖降低最明显,低于血糖正常值范围(P<0.01)。然后开始缓慢上升,给药后3~4 h血糖值恢复至给药前水平。多次给药后0.5~1.5 h血糖降低较单次给药更为明显(P<0.05或P<0.01)。结果见图2。

与单次该药比较,*1P<0.05,*2P<0.01

Compared with single-dose group,*1P<0.05,*2P<0.01


与单次该药比较,*1P<0.05,*2P<0.01
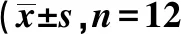
Compared with single-dose group,*1P<0.05,*2P<0.01

2.2.4实验室检查结果 健康受试者皮下注射艾塞那肽后实验室检查(血常规、尿常规、血电解质、肝功能、肾功能)指标无异常。
2.2.5不良反应 注射用艾塞那肽单次给药5 μg组12例受试者均未出现不良反应,而多次给药5 μg组1例受试者出现轻度不良反应(头晕、头痛)。
注射用艾塞那肽单次给药10 μg组3例受试者(3/12)出现不良反应;多次给药后12例健康受试者中有11例出现不良反应(未给予其他药物),其中消化道症状(恶心、呕吐、食欲不振)为最常见不良反应。以上不良反应均为轻度,未作处理,最终自行缓解和消失。临床观察发现,注射用艾塞那肽10 μg组不良反应发生率明显高于5 μg组。结果见表2。
表2 健康受试者单次和多次皮下注射艾塞那肽5,10 μg后不良反应统计结果
Tab.2Resultsofadversedrugreactionsaftersingle-andmultiple-dosesubcutaneousadministrationof5and10μgexenatideinhealthyvolunteers

组别时间受试者编号(性别)不良反应处理与药物关系5 μg 组第1天25(女)头晕未作处理肯定有关头痛未作处理肯定有关10 μg 组第1天11(女)恶心继续用药肯定有关食欲不振继续用药肯定有关28(女)恶心继续用药肯定有关呕吐继续用药肯定有关13(女)恶心继续用药肯定有关10 μg 组第2天11(女)恶心肯定有关呕吐肯定有关食欲不振退出试验肯定有关15(男)恶心肯定有关呕吐肯定有关食欲不振退出试验肯定有关12(男)恶心继续用药肯定有关呕吐继续用药肯定有关17(男)恶心继续用药肯定有关28(女)恶心继续用药肯定有关3(女)恶心继续用药肯定有关头晕继续用药可能有关10 μg组第3天12(男)恶心继续用药肯定有关食欲不振继续用药肯定有关恶心继续用药肯定有关头晕继续用药可能有关14(男)恶心继续用药肯定有关头晕继续用药可能有关食欲不振继续用药肯定有关13(女)恶心继续用药肯定有关头晕继续用药可能有关食欲不振继续用药肯定有关17(男)恶心继续用药肯定有关头晕继续用药可能有关呕吐继续用药肯定有关食欲不振继续用药肯定有关28(女)恶心继续用药肯定有关食欲不振继续用药肯定有关
续表2 健康受试者单次和多次皮下注射艾塞那肽5,10 μg后不良反应统计结果
Tab.2Resultsofadversedrugreactionsaftersingle-andmultiple-dosesubcutaneousadministrationof5and10μgexenatideinhealthyvolunteers

组别时间受试者编号(性别)不良反应处理与药物关系呕吐继续用药肯定有关10 μg 组第4天28(女)恶心继续用药肯定有关食欲不振继续用药肯定有关呕吐继续用药肯定有关18(女)食欲不振继续用药肯定有关17(男)恶心继续用药肯定有关食欲不振继续用药肯定有关12(男)恶心继续用药肯定有关食欲不振继续用药肯定有关13(女)恶心继续用药肯定有关食欲不振继续用药肯定有关14(男)恶心继续用药肯定有关食欲不振继续用药肯定有关31(男)食欲不振继续用药肯定有关33(男)食欲不振继续用药肯定有关3(女)呕吐继续用药肯定有关皮疹继续用药可能有关10 μg 组第5天28(女)恶心未作处理肯定有关食欲不振未作处理肯定有关呕吐未作处理肯定有关17(男)恶心未作处理肯定有关3(女)食欲不振未作处理肯定有关18(女)食欲不振未作处理肯定有关
3 讨论
笔者在本研究系统评价了注射用艾塞那肽在中国健康人体内的耐受性和安全性,对受试者服药后不良反应和实验室检测结果等进行严密监测,本研究对该类药物的临床合理安全应用具有重要借鉴意义。
本研究临床观察发现,健康受试者单次、多次皮下注射艾塞那肽5和10 μg后血糖显著降低,低于血糖正常值范围。注射用艾塞那肽5 μg安全性良好,单次给药无不良反应发生,多次给药组仅1例受试者出现轻度不良反应(头晕、头痛)。注射用艾塞那肽大剂量(10 μg)不良反应发生率明显高于小剂量(5 μg),其中消化道症状(恶心、呕吐、食欲不振)为最常见不良反应,与文献报道一致[9-10]。文献研究表明,不同GLP-1受体激动剂之间的临床疗效和胃肠道等不良反应存在一定差异[11]。临床上艾塞那肽推荐起始剂量为一次5 μg,bid,分别在早餐和晚餐前1 h注射,治疗1个月后,可根据临床反应调整剂量至一次10 μg或5 μg维持给药,这样将有效减少药物不良反应发生率。此外,为提高患者用药依从性,GLP-1受体激动剂周制剂已在国内外上市,其可大大降低给药频率,同时可降低胃肠道不良反应[12]。而本研究高剂量组没有应用剂量递增给药方案,这也是该剂量组发生不良反应较多原因之一。
总之,本研究观察表明健康受试者对注射用艾塞那肽的耐受性较好,但胃肠道反应发生率高。由于Ⅰ期临床耐受性试验是以小样本量健康青年受试者为受试对象进行的观察,研究结果可能存在一定局限性。因此,尚需在后续临床试验和临床应用中进一步重点监测患者个体差异及可能出现的药品不良反应(包括恶心、呕吐和食欲不振等)。
