试论金属氧化物@石墨相氮化碳复合材料的制备、表征及性能探讨
2019-07-08王晓雪张合平
王晓雪,张合平
(中南林业科技大学,长沙 410004)
1 试验仪器与方法
1.1 试验仪器
试验仪器包括恒温磁力搅拌器、高速离心机、电热鼓风干燥箱、超声波清洗器、数显恒温水浴锅、电化学工作站、冻干机、管式炉、手动切片机、暗箱式紫外分析仪、电池性能测试系统。
1.2 锂离子电池性能参数指标
锂离子电池容量单位为mA·h/g。充放电倍率计算公式为:

式中,I为更定放电电流,mA;m为活性材料质量,g;t为放电时间,h。
1.3 电化学性能测试
进行电池组装,测试恒流充放电、交流抗阻。
1.4 催化制氢性能测试
催化制氢比速率(rB)计算公式为:

式中,t140为氢气体积140 mL制作所需时间,min; wc为催化剂质量,g;140为氢气体积,mL。
催化制氢催化反应计算公式为:

式中,k0为速率常数;A为前因子;Ea为活化性能;R为摩尔气体常数;T为热力学温度。
2 材料的制备、表征及性能
CCN纳米复合材料本身具备较高的活性,可加速催化反应,实现催化剂的重复应用(一般可使用8次以上)。在室温条件下,催化硼氢化钠水解制氢速率为710左右,活性等级较好。有效结合金属氧化物@石墨相氮化碳纳米复合材料,可提升复合材料产氢催化效率,同时提升超顺磁性的应用性[1]。
2.1 试验部分
2.1.1 制备催化剂
加热三聚氰胺去离子溶液(30 mL),将其加热到40℃,促使其完全溶解。四水合乙酸钴去离子溶液 (10 mL)搅拌状态下逐步滴入三聚氰胺去离子溶液,在80℃温度下,均匀搅拌2 h,接着冷冻干燥,将得到的固体放入研钵内进行研磨,接着放在管式炉中焙烧。在氮气氛围下20 min内将温度上升到600℃,保持此温度4 h,自然冷却到室温。最后将材料全部倒入乙醇溶液中,干燥40℃获得黑色固体粉末,以此得到金属氧化物@石墨相氮化碳复合材料 (即CNN-1-1)。
活化:取200 mg制备的金属氧化物@石墨相氮化碳复合材料(即CNN-1-1),放置在50 mL的单口烧瓶内,使用恒压滴漏滴入0.10 mol/L硼氢化钠水溶液,一般滴入30 mL,30 min后使用去离子水洗5次,制备出湿催化剂,命名为CNN-1-2。调整金属氧化物@石墨相氮化碳复合材料(即CNN-1-1)比例,保持三聚氰胺、乙酸钴、其他条件,得到CNN-2-1,活化为CNN-2-2,如图1所示。
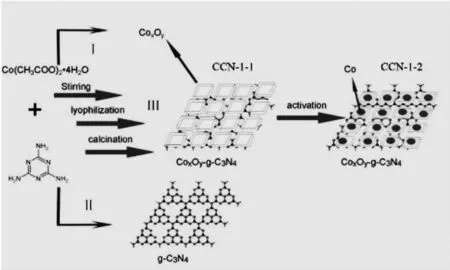
图1 催化剂制备过程
2.1.2 催化制氢
将20 mg催化剂放置在50 mL的单口烧瓶内,配置80 mg的硼氢化钠(氨硼烷)水溶液,溶液为20 mL, 借助恒压滴液漏斗将溶液滴入烧瓶内。CCN复合材料自身可传递能量,进行磁性搅拌,也就是自搅拌。使用排水法测量产氢体积。
2.2 结构表征与外貌表征
2.2.1 X射线衍射分析
对金属氧化物@石墨相氮化碳纳米复合材料进行X射线衍射分析,结果表明,活化后的催化硼氢化钠水解产氢效果较为明显,可能与钴元素存在形式有关。
2.2.2 投射电子显微镜分析
金属氧化物@石墨相氮化碳纳米复合材料,在投射电子显微镜下分析,边缘透明的属于石墨相氮化碳,金属氧化物负载在石墨相氮化碳材料上,钴氧化物以纳米片的形式存在[2-3]。其中存在两种晶格条纹,表明未活化的材料钴氧化物具备两种形态,即氧化亚钴与氧化三钴。活化阶段,纳米片上的金属氧化物未能得到全部还原,生成的钴纳米颗粒嵌入到剩余的氧化钴纳米片表面。活化后的CCN-1-2复合材料,金属氧化物整体形貌为纳米片,但其中仍旧存在很多团簇纳米片,为典型的纳米颗粒,尺寸在 3 nm左右。研究结果表明,活化后的材料钴结晶度明显提升,并且分散更加均匀。
2.2.3 比面积孔结构分析
通过观察CNN-1-2材料氮气吸附等温线、NN-1-2材料孔径分布图,人们可以发现在77 K条件下CNN-1-2复合材料氮气吸附曲线与孔径情况,等温线属于Ⅳ型曲线,在相对压力为0.40~0.97时存在滞后环,表明CNN材料具备介孔结构。
应用曲线吸附支,借助BET算法得到CNN1-2材料表面积为29m2/g。使用BJH计算,CNN1-1-2材料孔体积为0.04cm3/g,孔径分布较为集中。由此可见,大面积对催化性质而言有十分重要的作用。
2.2.4 X射线光电子能谱分析
XPS谱图可有效证明金属氧化物@石墨相氮化碳复合材料中的钴元素氧化形态,通过分析XPS谱图可知,火化后材料钴一般以二价或零价的形式存在,活化前,以三价、二价、零价形式存在。
2.2.5 磁性分析
通过深入分析CCN-1与CCN-2复合材料300 K下测试的磁滞回线图,人们可以发现,3 nm钴颗粒尺寸较小,并且CNN复合材料磁性较好。这导致CNN易于从液体混合体系中分离,可为后期重复应用提供条件。
2.3 催化产氢性能
2.3.1 材料影响
如果材料不同,硼氢化钠催化的制氢曲线和产氢速率也会发生变化。测试条件如下:20.0 mL去离子水,20 mg催化剂,8 mg硼氢化钠,选择磁性材料自搅拌方式+其他磁子搅拌方式,温度为室温。硼氢化钠水解反应如下:

CNN材料活化前,产氢速率明显低于活化后的CNN材料,因为活化后,钴的存在形式发生了变化(多为钴单质、氧化亚钴),若不加醋酸钴,虽说也会形成g-C3N4,但在反应的前十几分钟内不会产生氢气。若不加三聚氰胺也会生成Co、CoO,但20 min只会产生30 mL氢气,产氢效果明显低于CNN材料。原因在于石墨相氮化碳片未能制作g-C3N4截体,导致单质钴、氧化物大量聚集,进而降低催化剂活化面积。研究发现,CCN复合材料催化活性高于工业催化剂,并且CNN材料磁性较强,可为工业应用提供便利,提升硼氢化钠的活化性能。
2.3.2 搅拌影响
如果采用不同的搅拌方式,CNN-1-2材料催化硼氢化钠水解具有不同的效果。测试条件为:20.0 mL去离子水,20 mg催化剂,8 mg硼氢化钠,选择催化剂自驱动搅拌方式,温度为室温,转速为500 r/min。
催化剂作为磁子磁力转动,产氢速率明显提升。与磁力搅拌与磁力不搅拌相比,磁子磁力转动制备的钴基催化剂具备超顺磁性,在磁力搅拌器的作用下,催化剂磁力驱动自搅拌,可促使固体颗粒在产氢阶段随着氢气气泡的带动均匀分散,提升产氢速率。
搅拌磁子,可将大量磁性催化剂黏附在磁子上,降低催化剂在水溶液中的扩散速度,低转速时更为显著。不搅拌时,随着时间的增长,产氢速率降低较为明显,原因是水解生产的BO2-1会增加溶液中的pH值,导致反应速率减慢。
2.3.3 浓度影响
随着浓度发生变化,CNN-1-2材料催化硼氢化钠得到的氢气体积和产氢速率也会改变。本研究分别测试了硼氢化钠初始浓度为0.05 mol/L、0.10 mol/L、0.20 mol/L时的氢气体积。结果表明,当反应温度一定时,初始浓度不同,水解速率差异不大,表现出典型的零级反应动力学特征。在浓度为0.10 mol/L时,产氢转化率在97.12%,制氢速率为715 mL/(min·g)。
2.3.4 转速影响
如果转速不同,CNN-1-2材料催化硼氢化钠得到的氢气体积也会出现变化。测试条件为:20.0 mL去离子水,20 mg催化剂,8 mg硼氢化钠,选择催化剂自驱动搅拌和自搅拌,温度为室温。
当转速分别为100 r/min、200 r/min、300 r/min、400 r/min、500 r/min、600 r/min、700 r/min时,CNN-1-2材料催化硼氢化钠得到的氢气体积也会发生变化。随着转速的不断降低,产氢速率逐渐下降。转速较高时,磁性催化剂在硼氢化钠水溶液中可实现均匀分散运动,并且运动较为剧烈,因此可以提升产氢速率。低转速则与之相反。
2.3.5 温度影响
如果温度改变,CNN-1-1材料催化硼氢化钠得到的氢气体积也会出现变化。测试条件为: 20.0 mL去离子水,20 mg催化剂,8 mg硼氢化钠,选择催化剂自驱动搅拌方式,温度在30~55℃。
温度对水解速率的影响较为明显,随着温度的不断提高,硼氢化钠水解速率逐渐上升。一旦温度升高,分子间的电子传输速率不断增加。简单地说,提升反应温度,可提升副产物NaBO2的溶解度,最大程度避免副产物NaBO2过度溶解而影响催化剂的催化活性。在温度达到330 K时,产氢速率为 2 413 mL/(min·g),高于室温速率。
3 结论
本文借助简单的固态方式,制作出具备高催化活性的金属氧化物@石墨相氮化碳纳米复合材料。借助投射电镜表征,可确定其形貌,石墨相氮化碳片上有钴纳米颗粒、钴氧化物及纳米片负载,钴纳米颗粒尺寸为2~5 nm。借助X射线衍射分析、X射线光电子能谱分析,笔者确定了合成材料的组分。其间,活化还原过硼氢化钠,使钴以单质形式存在于复合材料内。借助磁性分析,人们可以确定材料磁性特征,提升催化硼氢化钠水解制氢速率,而将催化剂作为磁子,相比磁子搅拌,可以提升催化活性。CCN纳米复合材料具备较高的活性,可加速催化反应,实现催化剂的重复应用,在室温条件下,催化硼氢化钠水解制氢速率为710左右,活性等级较好[4]。通过有效结合金属氧化物@石墨相氮化碳纳米复合材料,人们可以提升复合材料产氢催化效率,同时提升超顺磁性的应用性。
