西山焦枣多糖的超声辅助法提取工艺和抗氧化研究
2019-07-06黄劲松
刘 静,汪 雨,黄劲松,郭 军
(1.宿州市食品药品检验检测中心,安徽宿州234000;2.池州学院化学与材料工程学院,安徽池州247000)
西山焦枣为鼠李科枣属植物的成熟果实,是安徽省池州市贵池区特产,生长在高海拔的皖南山区,清甜脆嫩,皮薄核小,肉质细腻,含有较多糖类、脂肪、蛋白质、熊果酸、胡萝卜素、维生素C、B族维生素、维生素P以及钙、铁、磷和环磷酸腺苷等营养成分,具有益阳补血,调理生机,养心定神,防止动脉血管硬化等功效,其中枣多糖是生物活性多糖的一种[1,2],研究表明多糖及其复合物对癌症、免疫紊乱、糖尿病、肝损伤、高血压、脑血栓等有显著的疗效,因此作为绿色膳食保健产品成分,具有广阔的市场前景[3]。1983年,日本学者友田正司等用柱层析的方法,分离得到活性多糖,并对其分子组成结构进行了研究。由于红枣是我国的特色果品,国外学者研究较少,对其很多营养功能性质了解较少[4],国内对枣多糖的研究起始于1998年,林勤保[5]等分离纯化得到中性多糖和酸性多糖并对其组分进行分离研究,随之国内学者开始对红枣多糖进行研究。超声近年来被用于天然植物活性功能成分的提取[6-7],其机理是利用超声波产生的强烈震荡、空化、粉碎作用,将植物中的成分有效的传递到溶剂中去,该法简单、效率高,能达到比传统提取更理想的效果[8-9]。
本研究采用超声波作为辅助技术,结合单因素和正交实验设计,探讨西山焦枣多糖的最佳提取工艺条件,为西山焦枣多糖多糖的研究开发提供科学理论依据。此外对西山焦枣多糖的结构、抗氧化性进行初步测定。
1 实验材料与方法
1.1 实验材料
1.1.1 原料与试剂西山焦枣(安徽池州),葡萄糖(分析纯),浓硫酸(分析纯),苯酚(分析纯),乙醇(分析纯,质量分数95%),氯仿(分析纯),异戊醇(分析纯)。(所有试剂均采购国药集团)。
1.1.2 实验仪器电子天平(YP202N)(上海菁海仪器有限公司),恒温水浴锅(HH-8,金坛市杰瑞尔电器有限公司);可见分光光度计(722,上海奥普勒仪器有限公司),电热恒温鼔风干燥箱(DH6-9243B5-lll,上海新苗医疗器械制造有限公司),低速离心机(常州国华电器有限公司),超声波振荡器(DL-820E,上海五相仪器仪表有限公司),恒温磁力搅拌器(85-2,金坛市杰瑞尔电器有限公司),傅立叶变换红外光谱仪(Nicolet iS-200,美国),透析袋(MD34-14,8000-1400,北京瑞达恒辉科技发展有限公司)。
1.2 实验方法
1.2.1 焦枣多糖的制取工艺路线焦枣多糖的分离纯化:焦枣粉→准确称重→热水浸提→抽滤→第一次乙醇沉淀多糖→离心→去除蛋白质→透析→第二次乙醇沉淀多糖→离心→烘干→焦枣多糖。
1.2.2 多糖纯度的测定本实验利用苯酚-硫酸法来测定焦枣多糖的浓度,其原理为多糖类的成分在硫酸作用下,水解成单糖,脱水形成糖醛衍生物,和苯酚缩合成有色化合物,采用分光光度法,在最大吸收波长490nm处,对照标准曲线,计算出多糖的浓度;提取液中含有较多的单糖或双糖,影响结果,因此本实验采用提取液浓缩醇沉再溶解的方法[10],具体方法如下:
(1)葡萄糖标准曲线:以葡萄糖为样标,精确称取干燥恒重的葡萄糖25.0mg,定容至250mL,配制成100mg/L的葡萄糖溶液。取蒸馏水2mL为空白对照,取0.2、0.4、0.6、0.8、1.0、1.2mL葡萄糖在比色管中加水至2.0mL,加入15%苯酚溶液1.0mL,摇匀,迅速加进5.0mL浓硫酸,摇匀,静置10min,置于沸水浴中加热15min,取出用自来水冷却至室温,用蒸馏水的反应液作空白对照,以最大吸收波长490nm处测定吸光度A值,以A490作为纵坐标,以葡萄糖的浓度为横坐标作标准曲线[10]。
依据分光光度法在波长490nm处测定吸光度A490,绘制出标准曲线,如图1所示,得回归方程为:A=0.083C-0.071R=0.987
A为吸光度;C为浓度(mg/L;R为线性相关系数
(2)多糖的提取率计算公式:
提取率(mg/L)=(C×稀释倍数×V×10-6)/m
式中:C为分光光度计间接测定的焦枣多糖的浓度;单位:mg/L
V为提取液体积;单位:L
m为样品质量;单位:mg

图1 葡萄糖标准曲线
1.2.3 焦枣多糖的纯化
(1)乙醇沉淀:以体积1:4(浓缩液:沉淀剂)进行沉淀。静置2h,待沉淀析出,离心分离,将沉淀物烘干,得粗多糖。
(2)脱蛋白:称量粗多糖样品加水溶解至100 mL,加入氯仿-异戊醇(实验前先配成4:1体积比的混合溶液)25 mL,放置于萃取装置之中,完全多次震荡,获取上层清夜,反复脱蛋白3次。
(3)透析除杂:将脱蛋白后的多糖溶液装进透析袋里面并放进盛有蒸馏水的大容器内,放于搅拌器上透析2~3天,乙醇沉淀,离心,低温烘干,通过透析法除去有机溶剂、单糖、双糖、萜、单宁以及无机盐等一些杂质,最后得到相对较纯的枣多糖[11]。
1.2.4 焦枣多糖的红外结构表征 Nicolet iS-200,44个波数分辨率,扫描32次,KBr压片制样。
1.2.5 焦枣活性多糖对羟基自由基(∙OH)的清除作用
原理:建立Fenton[12-13]体系。以EDTA Na2-Fe2+与H2O2反应,反应生成∙OH,后者可氧细胞内的脱氧核糖,损害细胞新陈代谢,产生有色物质,分光光度计在532nm处有强吸收峰。当有生物活性分子存在时,可延缓脱氧核糖的氧化,有色物质生成量少;从而根据吸光度的大小,计算其半抑制浓度(IC50),以判断活性物质清除∙OH的能力。
方法:配制不同浓度的Coixan标品、焦枣多糖样液,各取0.1mL于试管中,加入0.2mL EDTA Na2-Fe2+溶液(1mmol/L)和0.5mL的2-脱氧核糖溶液(1mmol/L),用磷酸缓冲液(pH为7.4,浓度为0.1mmol/L)定容为 1.8mL,再加入0.2mL H2O2(10mmol/L),在温度为37℃,恒温水浴中振荡反应30min后,先后加质量分数为2.8%(w/w)三氯乙酸溶液1.0mL,质量分数为1.0%(w/w)硫代巴比妥(TBA)溶液1.0mL,充分混合均匀后,沸水浴15min后,冷却室温为,测定吸光值As。另外空白,同上处理,不加样液,测定532nm处测定吸光值Ae;测定吸光值AO,最终清除∙OH自由基的能力SA(%)计算式为:

2 结果与讨论
2.1 单因素实验
影响浸提的因素主要有温度、浸提时间、料液比、提取次数超声功率,本实验从这四个因素来考虑对提取率的影响,为正交试验设计的水平提供有价值的取值范围。

图2 超声功率与提取率的关系
2.1.1 超声波功率对提取率的影响 由图2所示,设定温度为80℃,提取时间为25min,料液比为30:1时,伴随着超声波功率的增加,焦枣多糖提取率也将渐渐增大,当超声波功率大于80W之后,提取率增加相对较少。当功率超过90后提取率反而有所降低,可能原因为超声功率提高时,水分子运动加速,能量传递被加强、扩散,可溶性物质溶解速度加快,功率过大时超声波产生的强烈机械波引起细胞内部各种物质结构的变化,使枣多糖部分多糖降解。
2.1.2 浸提时间对提取率的影响 如图3,设定温度为80℃,提取功率为90W,料液比为30:1时,焦枣多糖提取率随着浸提时间的增加而逐渐增加,当提取时间超过25min后,提取率增加不甚明显,这说明提取25min后,溶液中的多糖与焦枣中多糖浓度差变小,基本达到平衡状态,继续提取耗能、耗时间,因此浸提时间应选在25min左右适宜。
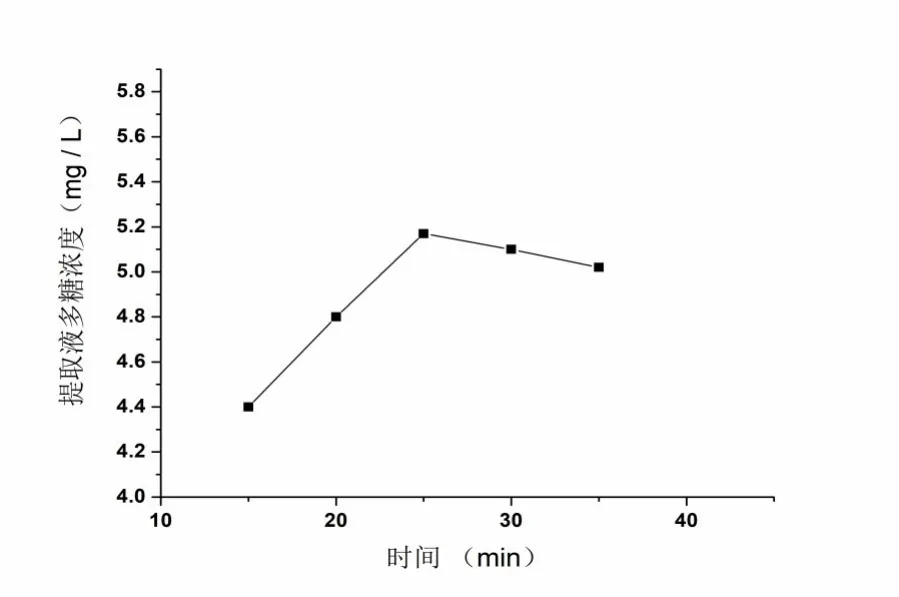
图3 浸提时间对提取率的影响
2.1.3 料液比对提取率的影响 如图4,设定温度为80℃,提取功率为90W,提取时间为25min时,伴随着液料比的增加,多糖的提取率也会渐渐增加,但当液料比到达1:30后,多糖的提取率的增加就变得迟缓。而容积体积的增加会延长浓缩时间,生产成本增加,所以液料比选择在1:30左右较好。

图4 液料比对提取率的影响
2.1.4 温度对提取率的影响 设定提取功率为90W,液料比为30:1,提取时间为25min,由图5可知,伴随温度的升高,多糖的提取率渐渐升高,表明温度较低不利于多糖的提取,大多数植物多糖不易溶解于冷水中易溶于热水,有利于多糖的浸出[14]。但由于温度过高,如在80℃左右时,焦枣提取液的粘度变得过大,这也许应该会有两个原因:一是焦枣细胞在高温下会处于“崩溃”、溶解的状况;也有可能破坏有效成分,使多糖降解以及降低多糖活性,而导致提取率降低,而且温度太高,还会导致蛋白质等杂质的浸提出的量增加,应当选在70℃~90℃之间为宜,这样使后续处理更简单。

图5 温度对提取率的影响
2.1.5 提取次数对提取率的影响 由图6可知,多糖一次提取率5.2mg/L,随着提取次数增加,多糖提取率逐渐减少,第五次提取提取率降到2.0mg/L,考虑到多次提取能耗较高,因此建议采用2次提取合并。

图6 提取次数对提取率的影响
2.2 焦枣多糖的正交实验
在单因素实验的基础之下,对多糖的提取工艺,利用正交试验设计进行了分析和优化。热水浸提法的单因素实验对条件选择具有针对性,缩短了实验的时间,摒除了水平数选择的盲目性。正交实验使用的是三水平四因素的正交表L9(34)。

表1 水平因素
按正交试验设计[13],共进行9次提取,每次平行三次,结果如表2所示:各个因素影响多糖提取率的排列顺序为:因素C>因素D>因素B>因素A,最佳的提取条件是:C2D3B2A3,也就是温度90℃,超声功率90w,浸提时间25min,料液比1:30,枣多糖的产率可达到5.58mg/L.温度在90℃时候,水分子运动剧烈,使多糖运动加快,焦枣颗粒对多糖的束缚力减弱,多糖在胞内和水溶液的渗透压加大,因此溶液内外浓度平衡较快。功率在90w时候,既可以不破坏细胞其它物质,又可以快速的浸出多糖,浸提时间低于25 min时,胞内外多糖无法达到平衡。时间大于25min时候,水热能量将破坏多糖,引起讲解。料液比大于1:30时候,溶液过稀,给后续浓缩带来困难,料液比小于1:30时,包内多糖难于浸出。

表2 正交实验结果
2.3 红外光谱图鉴定
由图在500—4000 cm-1范围内进行的IR扫描,图谱是具有糖类的特征吸收峰;在3200~3700cm-1范围处出现一个较宽的峰,这是糖分子内部或分子之间氢键O-H伸缩振动引起的结果;2930 cm-1处的吸收是次甲基(-CH2)中的C-H伸缩振动引起的;1630cm-1处的吸收峰应为-CHO的C=O伸缩振动引起,而1380cm-1处的峰很尖锐,属于C-H变角振动,它与C-H处的吸收伸缩振动一同构成了糖类的特征吸收峰。1110cm-1处的吸收峰是糖环的特征吸收峰,是由多糖中的C-O糖苷键振动吸收引起的[15]。此谱图表明实验所得物质是焦枣多糖[16]。

图7 多糖的红外光谱图
2.4 焦枣活性多糖的不同提取方法对羟基自由基(∙OH)的清除作用
Fenton反应是模拟生物体内产生∙OH的反应。∙OH是活性氧中反应活性较高的自由基,对生物体有较大的危害,它可攻击细胞膜导致损伤,或者破坏DNA,诱导DNA复制错误,引起细胞突变和死亡,从而导致机体衰老、癌症和其它疾病[17]。如图7:本实验对比了在超声条件下和无超声条件下提取的焦枣活性多糖对∙OH清除能力。
根据试验结果可知,对Fenton体系所产生的∙OH,焦枣多糖具有良好的清除的能力,而且在试验浓度范围内,超声提取的焦枣多糖和热水提取的焦枣多糖均呈现明显递增。其中超声提取的焦枣多糖对∙OH的清除能力优于普通热水水提法提取的焦枣多糖,二者消除∙OH的IC50分别为0.48g/L与0.57g/L,差异显著(p<0.05);而当其浓度达到0.50g/L时,超声提取的焦枣多糖对∙OH的清除能力是无超声提取的焦枣多糖的1.31倍,可能原因是普通热水提取需要3 h左右,超声提取方法极大的缩短提取时间,只需要0.5h,避免了多糖长时间处于高温环境,使多糖生物活性得到较大的保留[18-19]。

图8 多糖对∙OH的清除效果(n=3)
3 结论
通过最终优化实验,经分析计算确定枣多糖的最佳工艺提取条件:温度90℃,超声功率90w,浸提时间25min,料液比1:30,浸提2次,枣多糖的产率可达到5.58 mg/L。在这些条件之中温度的改变对多糖提取率的影响相对较大,然后依次为超声功率、浸提时间、液料比。与传统的水提取法相比,超声波辅助法能够提高多糖的的提取效率,缩短时间,节省能量;此外,超声波辅助提取的枣多糖有较强的清除自由基能力,具有明显的抗氧化。目前此方法仅限于实验室提取枣多糖,对于进一步对其生物体内的生物活性的研究,研究工作需进一步不断深入。
