A型猪塞内卡病毒TaqMan荧光定量PCR方法的建立
2019-07-06李秀博鄢明华崔玉东崔尚金
李秀博,刘 存,鄢明华,崔玉东,崔尚金
(1. 黑龙江八一农垦大学动物科技学院,大庆163319 ;2.中国农业科学院北京畜牧兽医研究所,北京1001931;3.农业部兽用药物与诊断技术北京科学观测实验站,北京100193;4.天津畜牧兽医研究所,天津300384)
A型塞内卡病毒(Senecavirus A,SVA)又称塞内卡山谷病毒(Seneca valley virus,SVV),是单股正链RNA病毒,是小RNA病毒科、塞内卡病毒属唯一成员。2008年和2012年,加拿大和美国的研究人员分别报道了SVA相关的猪水疱性疾病,为SVA感染可引起猪水疱性疾病提供了证据[1-3]。到目前为止,SVA感染已在美国、巴西、中国、哥伦比亚、泰国等国暴发,给养猪业造成了较大损失[4-10]。
SVA感染所致的猪水疱病为一种新发猪病毒性疾病,对养猪业的生产和经济效益具有很大地威胁。SVA可感染不同年龄的猪,以鼻、唇以及蹄部冠状带出现水疱病变为特征。SVA可致新生仔猪死亡,1~4日龄的新生仔猪感染发病率可达70%,死亡率为15%~30%[5,11]。动物回归试验证实SVA感染可引起仔猪腹泻[12-13]。SVA感染临床症状与其他致水疱性疾病相关病原——口蹄疫病毒(Foot and mouth disease virus,FMDV)、猪传染性水疱病毒(Swine vesicular disease virus,SVDV)、水疱性口炎病毒(Vesicular stomatitis virus,VSV)和猪传染性水疱皮疹病毒(Vesicular exanthema of swine virus,VESV)临床症状相似,无法区分[12-13],病原鉴定需要依靠实验诊断方法。目前,RT-PCR方法、RNA杂交、免疫组织化学、电子显微镜等方法已应用到SVA的检测中;病毒中和试验、竞争ELISA、间接ELISA方法等用于SVA感染的血清学检测[14]。
2015年,我国首次报道了SVA感染引起的猪水疱性疾病,目前已在广东、福建、湖南、河南、黑龙江省等地发现了SVA感染病例[7,14-16]。我国SVA感染以零星散发为主,危害较口蹄疫小,但并不能排除其形成流行的可能性,仍加强SVA的防控以及监测。实时荧光定量PCR技术具有特异性强、灵敏度高、重复性好、快速等优点,不仅成为病毒研究中常用的工具,在动物疫病防控与监测中也具有广泛应用[17-18]。本研究针对SVA基因组序列保守区域设计了引物与探针,建立了SVA TaqMan 荧光定量RTPCR方法,为了解SVA的流行病学特征及致猪水疱性疾病相关病原的鉴别诊断提供了技术支持。
1 材料和方法
1.1 病毒A型猪塞内卡病毒SVA CH/FuJ/2017株(GenBank登录号:MH490944)、猪伪狂犬病病毒JL株均由本实验室保存;猪瘟病毒、猪流行性腹泻病毒及传染性胃肠炎病毒cDNA均提取自市售疫苗毒;O型口蹄疫病毒cDNA由本实验室保存。
1.2 主要试剂KAPA Probe Fast Universal qPCR 试剂盒购自北京普凯瑞生物技术有限公司;病毒RNA快速提取试剂盒和PCR Master Mix 购自北京艾德艾德莱生物技术有限公司;反转录酶M-MLV和pMD18-T载体购自TaKaRa公司。
1.3 引物及探针设计与合成参考SVA CH/FuJ/2017株全基因组序列,利用Primer Express 3.0设计1对特异性引物SVA-3D F/R及探针SVA-3D probe。同时,设计1对引物SVA-MF/R用于构建标准品质粒,引物由北京六合华大基因科技有限公司合成,引物序列见表1。
1.4 标准品质粒的构建参照病毒RNA快速提取试剂盒说明书提取SVA CH/FuJ/2017株RNA,利用M-MLV反转录酶合成cDNA,并以此为模板利用SVA-MF/R进行PCR扩增。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,共计35个循环;72℃延伸10 min。参照Omega胶回收试剂盒说明书对目的片段进行胶回收,并连接至pMD18-T载体,构建重组质粒pMD18T-SVA-M。利用紫外分光光度计测定其质量浓度,按照公式copies / μL=(6.02×1023copies/mol)×(浓度 g/mL) ×10-3/(分子质量g/mol)计算拷贝数。
1.5 荧光定量PCR反应条件优化根据KAPA Probe Fast Universal qPCR 试剂盒说明书确定反应体系为20 μL。以阳性标准品质粒为模板,采用矩阵法,对荧光定量PCR的退火温度(56℃、58℃、60℃、62℃、64℃)进行优化,并利用矩阵法对引物(10 μmol/L)及探针(10 μmol/L)使用量(0.4、0.6、0.8、1.0 μL)依次进行优化。
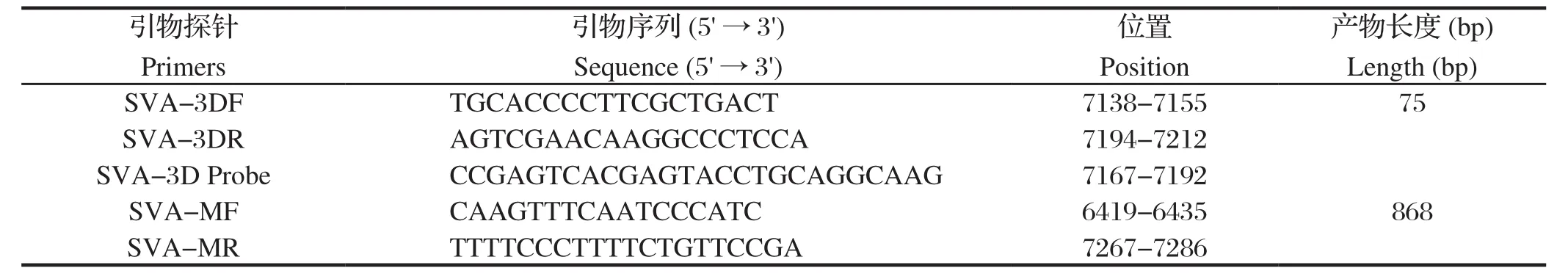
表1 本研究中应用的引物及探针Table 1 The primers and probe sequences in this study
1.6 标准曲线绘制将重组质粒标准品进行10倍系列稀释,选用浓度为3.75×108~3.75×101copies/μL标准品为模板,以优化的反应条件进行荧光定量PCR检测,每个浓度标准品做3个重复。以log(拷贝数)为纵坐标,CT值为横坐标绘制标准曲线,并进行线性回归分析。
1.7 特异性试验以SVA CH/FuJ/2017株、猪伪狂犬病病毒JL株、口蹄疫病毒、猪瘟病毒、猪流行性腹泻病毒以及猪传染性胃肠炎病毒的cDNA或DNA为模板,以最佳的反应条件进行荧光定量PCR检测,评价该方法的特异性。
1.8 敏感性试验以3.75×108~3.75×100copies/μL标准品质粒为模板进行荧光定量PCR检测,确定该方法的检测下限。同时,对使用的不同浓度的标准品质粒作为模板进行普通PCR扩增,确定其检测下限。比较荧光定量PCR与普通PCR两种方法的敏感性。
1.9 重复性试验选用3.75×105copies/μL、3.75×104copies/μL、3.75×103copies/μL标准品质粒为模板进行3批重复试验,每批次重复3次以检验其批内重复效果。在不同时间进行3次重复试验以检验该方法批间重复效果。
2 结果
2.1 标准品质粒的构建以SVA CH/FuJ/2017株cDNA为模板,利用引物SVA-MF/R进行PCR扩增,经琼脂糖凝胶电泳检测,成功扩增出目的片段SVA-M。将PCR产物进行胶回收后,连接于pMD18T载体并进行转化、筛选,经双酶切及测序鉴定,重组标准品质粒pMD18T -SVA-M构建成功。对获得的重组质粒测定质量浓度后计算拷贝数为3.75×1010copies/μL。
2.2 TaqMan荧光定量PCR条件优化及标准曲线的绘制根据KAPA Probe Fast Universal qPCR 试剂盒说明书确定反应体系为20 μL,经过优化最终确定为qPCR Mix 10 μL、探针(10 μmol/L)0.6 μL、上/下游引物(10 μmol/L)0.8 μL、Rox 0.4 μL、模板1 μL,dd H2O 补至20 μL。经过对反应条件的优化,确定最佳反应条件:95℃预变性1 min;95℃变性15 s,60℃退火30 s(收集荧光),共计40个循环。以标准品质粒pMD18T -SVA-M进行10倍系列稀释,选用3.75×108~3.75×101copies/μL标准品为模板进行荧光定量PCR检测,绘制标准曲线。标准曲线为Y=-3.1013X+34.60,相关系数R2=0.9974,线性关系良好。
2.3 特异性检验以SVA CH/FuJ/2017株、口蹄疫病毒、猪瘟病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒的cDNA及猪伪狂犬病病毒JL株的DNA为模板进行检测。结果表明,该方法仅与SVA cDNA存在特异性反应,与其他病毒不存在交叉反应,特异性良好(图1)。
2.4 敏感性试验以3.75×108~3.75×100copies/μL重组质粒标准品作为模板进行荧光定量PCR检测。检测结果显示,所建立的TaqMan荧光定量PCR方法最低检出下限为3.75拷贝。普通PCR检出下限为3.75×103拷贝。可见,所建立的TaqMan荧光定量PCR方法比传统PCR方法灵敏度更高。
2.5 重复性检验以3.75×105copies/μL、3.75×104copies/μL、3.75×103copies/μL标准品质粒为模板进行批内、批间重复性试验。结果表明,批内变异系数和批间变异系数均小于5%,说明该方法重复性良好(表2)。

图1 SVA TaqMan 荧光定量PCR方法的特异性试验Fig. 1 Specificity of TaqMan PCR for SVA
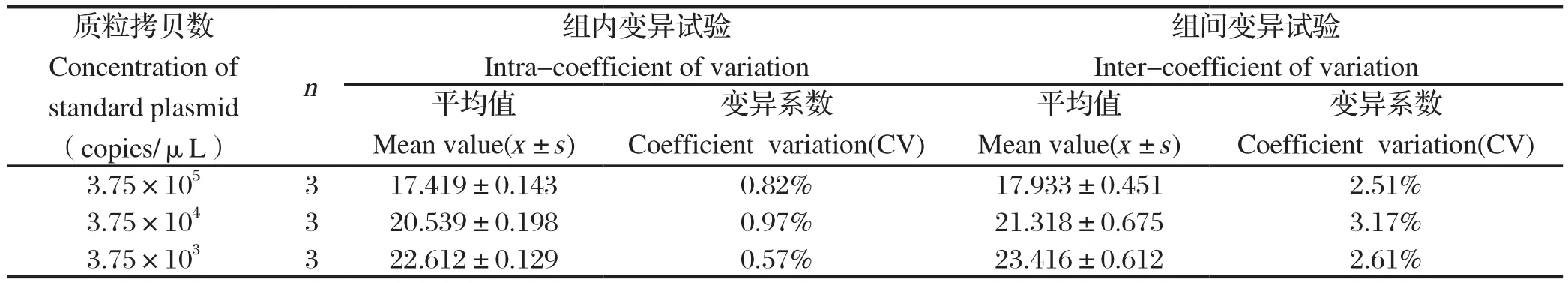
表2 SVA TaqMan荧光定量PCR方法的重复性试验Table 2 The reproducibility test of TaqMan real-time PCR for SVA
3 讨论
目前,SVA所致的水疱性疾病已经在美国、加拿大、泰国、哥伦比亚、澳大利亚等国家报道,中国广东、福建、河南、黑龙江等省也发现了SVA感染病例[4-10,14-16]。对SVA防控亟需了解其在我国猪群的流行与分布,因此建立SVA快速诊断方法具有重要意义。
本研究建立的TaqMan荧光定量PCR方法具有良好的特异性,与口蹄疫病毒、猪瘟病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒以及猪伪狂犬病病毒等不存在交叉反应。该方法灵敏度较普通PCR方法高且更为快速、方便,检出下限为3.75拷贝。重复性试验结果显示,该方法批内及批间的变异系数均小于5%,具有良好的重复性及稳定性。
目前,已经应用于SVA检测及诊断的技术包括原位杂交技术、血清学检测技术和PCR检测方法等。研究表明,ELISA方法更适合于血清学诊断及免疫诊断,而不适于SVA的早期诊断。Yang等[19]利用cELISA对SVA攻毒猪进行血清学诊断,在攻毒6 d后,所有攻毒猪均呈现抗体阳性,血清阳性抑制持续至试验结束(攻毒后57 d)。可见,通过血清学诊断判定动物感染状态不适于早期诊断,也不利于对该病早期防控措施的实施。在病原检测方法中,Resende等[20]采用一种新型原位杂交技术(ISH)检测不同组织中病毒RNA,具有高效高特异性。但该方法需要采集动物不同组织样品,不适合活体动物的早期快速检测。PCR检测不受样品限制,适合于动物活体检测。国外已建立PCR、巢式PCR、SYBR Green RT-qPCR等方法并应用于SVA感染诊断[21-23]。
我国多个地区已发现了SVA感染,虽尚未形成流行的趋势,但不可排除其形成流行的可能。本研究建立的SVA TaqMan荧光定量PCR方法,特异性良好,敏感度比普通PCR更高,为SVA感染早期诊断及相应防控措施的实施提供了技术支持。
