特发性膜性肾病血清抗磷脂酶A2受体抗体与免疫治疗关系的研究
2019-07-05邬碧波郝晓萍胡小华张黎明
唐 琦,邬碧波,李 林,郝晓萍, 胡小华,张黎明*
(1.上海市静安区闸北中心医院肾内科,上海 200070;2.海军军医大学长征医院肾内科,解放军肾脏病研究所,上海 200003)
特发性膜性肾病(idiopathic membranous nephropathy,IMN)是成人肾病综合征的一个常见病理类型。目前已知IMN患者体内可能存在多种针对不同自身抗原的抗体,而肾小球足细胞上的抗磷脂酶A2受体(phospholipase A2receptor,PLA2R)为其主要抗原,患者血清中可检测到抗PLA2R抗体,并主要以IgG4形式存在,循环中抗 PLA2R 抗体与肾小球上的 PLA2R 抗原结合形成原位免疫复合物,激活补体,导致足细胞损伤,致使尿蛋白产生[1]。国外报道血清抗PLA2R抗体水平与尿蛋白、疾病转归及预后密切相关[2-4],目前国内将PLA2R抗体作为IMN生物标志物的相关报道较少。本研究采用激素联合环磷酰胺方案治疗IMN患者,观察血清抗PLA2R抗体在IMN诊断和病情严重程度评估中的作用,为今后IMN的免疫治疗提供临床依据。
1 资料和方法
1.1 研究对象 收集2014年1月至2017年6月在上海市静安区闸北中心医院和海军军医大学长征医院肾内科住院患者60例,其中男34例,女26例,年龄28~72岁。入选标准:(1)经皮肾穿刺活检后病理证实为IMN,光镜下无明显系膜增生,无细胞浸润,免疫荧光以IgG及C3沉积为主,电镜下无内皮下及系膜区免疫复合物沉积;(2)既往无激素和免疫制剂治疗史。排除标准:(1)系统性红斑狼疮;(2)HIV、梅毒、乙肝、丙肝病毒感染者;(3)肝功能异常:丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)超过正常值上限1.5倍;(4)使用金制剂或青霉胺;(5)恶性肿瘤、糖尿病、妊娠或哺乳期妇女。本研究经上海市静安区闸北中心医院伦理委员会审查并同意,所有患者入组前均签署知情同意书。
1.2 仪器和试药 DM 2500正置荧光显微镜(德国徕卡仪器有限公司)。PLA2R抗原试剂盒(德国欧盟公司);PLA2R抗体试剂盒(美国DAKO公司);泼尼松片(上海上药信谊有限公司);环磷酰胺注射剂(美国国际百特有限公司)。
1.3 血清抗PLA2R抗体检测和分组 所有患者空腹抽血,采用间接免疫荧光法检测血清抗PLA2R抗体,以PLA2R 转染的 pcDNA3.1/Hygro-PLA2R作为底物,患者待检血清作为第一抗体,羊抗人IgG-FTFC作为第二抗体。操作步骤按试剂盒说明书进行,试剂盒提供阴性及阳性对照。60例IMN患者根据血清抗PLA2R抗体结果,分为血清抗PLA2R抗体阳性组(抗PLA2R+组)44例,血清抗PLA2R抗体阴性组(抗PLA2R-组)16例。
1.4 肾组织PLA2R检测 对确诊IMN的患者留取肾活检组织的冰冻切片,采用免疫组织化学染色法检测肾组织PLA2R表达,检测时用磷酸盐缓冲液冲洗,苏木素复染,干燥后封片,用显微镜观察。
1.5 治疗方法 患者均采用改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)推荐的激素联合环磷酰胺方案治疗,泼尼松初始剂量为1 mg·kg-1·d-1,上限60 mg。如肾病综合征缓解,继续原方案治疗2周后激素减量;若未缓解,激素治疗3个月后逐渐减量;环磷酰胺采用静脉给药,0.5~0.75 g/m2,前6个月每月给药1次,后6个月每两个月给药1次。同时给予患者相应支持治疗。
1.6 观察指标 两组均检测基线和治疗3、6、9、12个月时24 h尿蛋白、血清白蛋白、ALT、血尿素氮、血肌酐,检测基线、治疗12个月血清抗PLA2R抗体等指标。估计肾小球滤过率(estimated glomerular filtration rate,eGFR)计算采用慢性肾脏病流行病学合作组(Chronic Kidney Disease Epidemiology Collaboration,CKD-EPI)的公式。
1.7 疗效评价[5](1)完全缓解:24 h尿蛋白<0.3 g/d,且血清白蛋白> 35 g/L,血肌酐正常。(2)部分缓解:24 h尿蛋白下降超过基础值50%,且血清白蛋白正常或改善,血肌酐稳定。(3)未缓解:治疗未达到上述标准。
1.8 不良事件 记录治疗期间发生的各种药品不良反应(ADRs),如感染、皮疹、胃肠道反应、肝功能受损、恶性肿瘤, ALT或AST超过正常值上限2倍定义为肝功能受损。
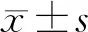
2 结 果
2.1 患者一般情况 两组患者在入组时的年龄、24 h尿蛋白、尿白蛋白与肌酐比、血清白蛋白、血尿素氮、血肌酐、ALT、eGFR等指标方面差异均无统计学意义(P>0.05),有可比性,具体见表1。
2.2 24 h尿蛋白检测结果 治疗3个月后,抗PLA2R-组患者24 h尿蛋白低于同期抗PLA2R+组(P<0.05),低于基线(P<0.01)。治疗3个月时,抗PLA2R+组24 h尿蛋白有下降, 但与基线比较差异无统计学意义(P>0.05)。治疗6个月后,抗PLA2R+组24 h尿蛋白低于基线,差异有统计学意义(P<0.01),见图1。


组别n年龄(岁)性别(男/女)24 h尿蛋白(g/d)尿白蛋白/肌酐(g/g)血清白蛋白(ρB/g·L-1)血肌酐(cB/μmol·L-1)丙氨酸氨基转移酶(zB/U·L-1)总胆固醇(cB/mmol·L-1)三酰甘油cB/mmol·L-1)eGFRa(ml·min-1 ·1.73 m-2)血清抗PLA2R 抗体阳性组4449±1526/208.2±3.86.6±3.423.1±5.278±7.210±5.47.5±2.43.1±1.391±15血清抗PLA2R 抗体阴性组1646±178/67.5±3.36.9±4.024.8±4.776±6.911±4.57.2±2.63.3±1.493±16
PLA2R:磷脂酶A2受体;a:计算采用慢性肾脏病流行病学合作组(CKD-EPI)的公式;eGFR:估计肾小球滤过率
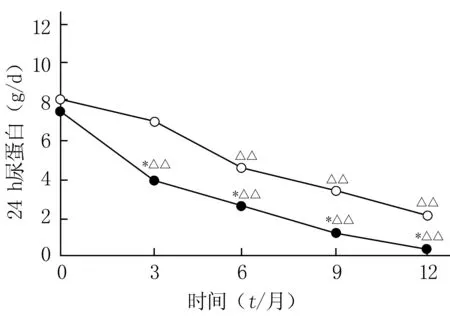
图1 两组患者24 h尿蛋白的比较Figure 1 Comparison of 24-h urinaryprotein between the two groups○:血清抗PLA2R抗体阳性组;●:血清抗PLA2R抗体阴性组;*P<0.05,与血清抗PLA2R抗体阳性组比较;△△P<0.01,与同组基线时比较;PLA2R:磷脂酶A2受体
2.3 生化指标检测结果 治疗3个月后,抗PLA2R-组血清白蛋白水平高于基线和同期抗PLA2R+组,差异均有统计学意义(P<0.01)。治疗3个月时,抗PLA2R+组血清白蛋白水平与基线比较无明显变化,差异无统计学意义(P>0.05),治疗6个月后,抗PLA2R+组血清白蛋白水平高于基线,差异有统计学意义(P<0.01),见图2。治疗3、6、9、12个月,抗PLA2R+组血尿素氮、血肌酐、eGFR有上升趋势,但与基线比较均无统计学意义(P>0.05);血清ALT无明显变化。抗PLA2R-组以上4项指标在治疗过程各检测时间点与基线比较无明显变化。
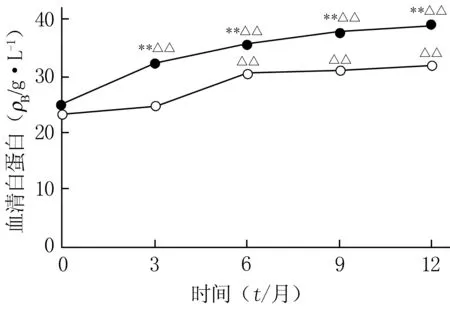
图2 两组患者血清白蛋白的比较Figure 2 Comparison of serum albumin between the two groups○:血清抗PLA2R抗体阳性组;●:血清抗PLA2R抗体阴性组;**P<0.01,与血清抗PLA2R抗体阳性组比较;△△P<0.01,与同组基线时比较;PLA2R:磷脂酶A2受体
2.4 疗效 治疗6个月,抗PLA2R+组的8例患者(18.2%)完全缓解,13例(29.5%)部分缓解,总缓解21例(47.7%);抗PLA2R-组6例(37.5%)完全缓解,9例(56.3%)部分缓解,总缓解15例(93.8%),抗PLA2R-组总缓解率高于抗PLA2R+组,差异有统计学意义(χ2=8.526 3,P<0.01)。治疗12个月,抗PLA2R+组的11例患者(25%)完全缓解,14例(31.8%)部分缓解,总缓解25例(56.8%);抗PLA2R-组15例(93.7%)完全缓解,1例(6.3%)部分缓解,总缓解16例(100%),抗PLA2R-组总缓解率高于对照组,差异有统计学意义(χ2=8.213 8,P<0.01),详见图3。
2.5 血清抗PLA2R抗体检测结果 60例IMN患者在基线时检测血清抗PLA2R抗体阳性为44例,阳性率73.3%。44例抗PLA2R抗体阳性患者予免疫抑制剂治疗12个月后复测血清抗PLA2R抗体,11例完全缓解患者的血清抗PLA2R抗体全部转阴;14例部分缓解患者的血清抗PLA2R抗体转阴8例,6例仍是阳性;19例未缓解患者的血清抗PLA2R抗体全部没有转阴。
2.6 肾组织PLA2R检测结果 60例入选IMN患者,肾组织PLA2R检测阳性44例,其中23例可见肾组织PLA2R沿肾小球毛细血管襻呈颗粒状沉积,弥漫性着色,为强阳性;21例沿肾小球毛细血管襻呈颗粒状沉积,节段性或弥漫性着色,为弱阳性。基线时血清抗 PLA2R 抗体检测阳性患者,其肾组织PLA2R表达也全部呈阳性,见图4。
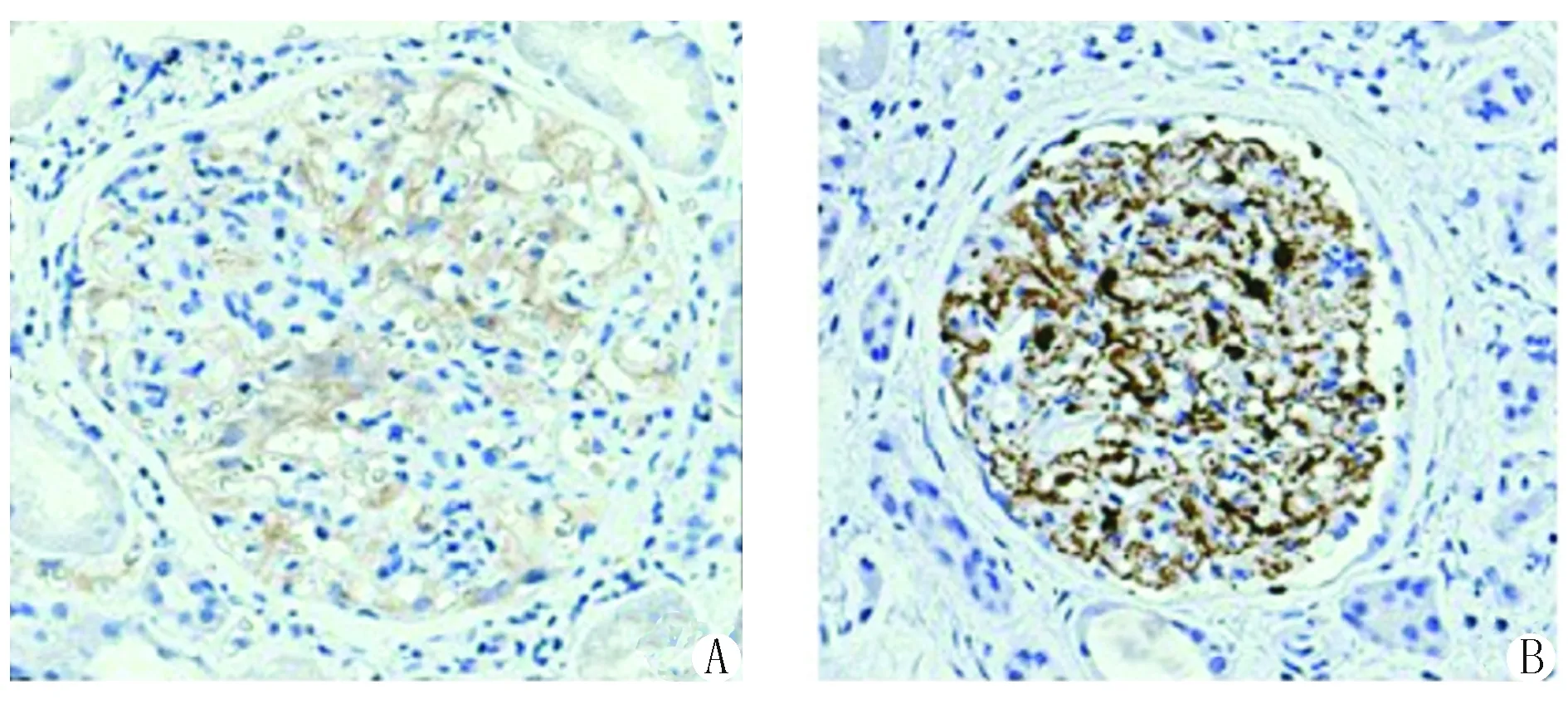
图4 肾组织PLA2R表达(免疫组织化学染色,×400)Figure 4 Expression of PLA2R in renal tissues (immunohistochemical staining,×400)A:PLA2R弱阳性,B:PLA2R强阳性
2.7 ADRs 患者在12个月试验期间均未出现服药有关肝功能受损、骨髓抑制、严重感染、恶性肿瘤等。
3 讨 论
膜性肾病的病理特点是肾小球基底膜上皮下免疫复合物沉积及基底膜弥漫性增厚。一般认为,循环免疫复合物沉积或原位免疫复合物形成导致的免疫反应是 IMN 的主要发病机制。2009年,Beck等[6]在IMN患者血清中首次检测出抗PLA2R抗体,一系列针对血清抗PLA2R抗体的研究[2-4]发现,70%~80%的IMN患者血清中可检测出抗PLA2R抗体,由此推测该抗体对于IMN是存在致病性的,抗PLA2R 抗体可能是IMN具有诊断意义的生物标志物[4,7]。近期有小样本研究显示,血清PLA2R抗体水平与患者临床病情和药物疗效相关[8-10],但国内针对抗 PLA2R 抗体作为 IMN 生物标志物的相关报道较少。
本研究结果显示,60例患者血清抗PLA2R抗体阳性率为73.3%%,与Beck等[3]和宋东旭等[11]的报道一致。24 h蛋白尿和血清白蛋白水平是评估IMN疾病严重程度的重要指标。有研究发现,在IMN中血清抗PLA2R抗体出现与患者大量蛋白尿、低蛋白血症相关[2,9,10]。本研究结果显示,治疗3个月,抗PLA2R-组24 h尿蛋白、血清白蛋白恢复情况优于抗PLA2R+组;治疗6个月,抗PLA2R+组和抗PLA2R-组总缓解率分别为47.7%和93.8%;治疗12个月总缓解率分别为56.8%和100%。这表明血清抗PLA2R抗体阴性IMN患者达到临床缓解时间短于血清抗PLA2R抗体阳性患者,血清抗PLA2R抗体阴性IMN采用免疫抑制治疗的疗效更佳,对于免疫治疗的早期反应更为敏感。PLA2R是一种Ⅰ型跨膜糖蛋白,存在于人类正常足细胞中,患者血清抗PLA2R抗体能与相应受体结合形成免疫复合物,沉积于肾小球毛细血管襻和基底膜并进一步激活补体,导致足细胞病变,产生蛋白尿。Skoberne等[12]的体外实验证明携带PLA2R抗体的患者血清能干扰足细胞在体外黏附Ⅳ型胶原,从而影响足细胞的功能。
本研究也显示,44例抗PLA2R抗体阳性患者予免疫抑制治疗12个月后复测血清抗PLA2R抗体,11例完全缓解患者的血清抗PLA2R抗体全部转阴;14例部分缓解患者的血清抗PLA2R抗体转阴8例,其余6例仍是阳性;19例未缓解组的血清抗PLA2R抗体全部没有转阴。这说明血清抗PLA2R抗体随病情缓解而转阴,与疾病近期转归密切相关。Beck等[3]对25例血清抗PLA2R抗体阳性的IMN患者采用利妥昔单抗治疗,发现抗体滴度下降或转阴的患者临床容易达到缓解。黄俊等[13]用他克莫司联合激素治疗血清抗PLA2R抗体持续高滴度的难治性IMN,发现对常规免疫抑制剂治疗无反应成为难治性IMN时,其血清抗PLA2R抗体一直在高滴度水平,提示其自身免疫反应未缓解。
本研究发现血清抗PLA2R 抗体检测结果呈阳性的IMN患者,其肾小球PLA2R的免疫组织化学检查结果也是阳性,说明这两种检测方法都对IMN诊断有重要价值,但采用免疫组织化学染色法检测肾组织PLA2R表达需依赖肾活检穿刺术,有创操作对患者有一定风险,而血清抗PLA2R 抗体检测取材方便、安全,且检测步骤相对简单。除此以外,有研究发现治疗有效的IMN患者,血清抗PLA2R抗体滴度的下降常先于尿蛋白减少及疾病缓解[14-15]。因此提示不但在治疗前及治疗结束时要检测患者血清抗PLA2R抗体水平,而且在治疗过程中也需定期监测血清抗体变化来评估治疗敏感性及疾病转归。Kanigicherla等[16]观察患者5年,发现血清抗PLA2R抗体滴度最高的1/3患者,其血肌酐升高至基线水平两倍的风险较大,预后较差。本研究只追踪患者12个月,抗PLA2R+组的血肌酐和eGFR有上升趋势,但与基线比较无统计学意义,因此还需延长随访时间,并扩大研究样本量以期进一步明确。
总之,血清抗PLA2R抗体是IMN的特异性生物标志物,血清抗PLA2R抗体阳性的患者免疫治疗效果差,IMN患者检测血清抗PLA2R抗体有助于判断病情,对于其在治疗策略的选择、病情的监测具十分重要的意义。
