副干酪乳杆菌的分离鉴定及肠道耐受性研究
2019-07-03印伯星
印伯星
(1.扬州大学,食品科学与工程学院,江苏扬州225009,2.江苏省乳品生物技术与安全控制重点实验室,江苏扬州225004,3.江苏省乳业生物工程技术研究中心,江苏扬州225004)
0 引 言
乳酸菌作为一类能够利用糖类生长并产生乳酸的益生菌[1],因其具有保护人体肠道健康等益生作用引起了人们的高度关注。乳酸菌包括乳杆菌属、双歧杆菌属、丙酸菌和酵母菌属等,其中乳杆菌数和双歧杆菌属被广泛应用于发酵乳产业中[2]。副干酪乳杆菌广泛存在于奶酪、泡菜等发酵食品中,其益生作用经过了多年的实践检验[3]。Chen[4]等人利用副干酪乳杆菌发酵乳饮料,发现其在发酵后能够促进肠上皮细胞的生长,并且降低肿瘤坏死因子-α(TN F-α)的产生。曹永强[5]等人利用副干酪乳杆菌N 1115发酵乳进行动物实验,研究结果表明摄入副干酪乳杆菌N 1115发酵乳后小鼠肠道内短链脂肪酸含量显著增多,有效改善了小鼠的便秘情况。但是由于副干酪乳杆菌和干酪乳杆菌的亲缘关系非常近,传统的生理生化特性以及16S rDNA序列很难将其进行区分[6]。因此,需要针对副干酪乳杆菌的特异性基因进行鉴定,才能将其与干酪乳杆菌进行有效区分。
本研究从西藏传统乳制品中分离出35株乳酸菌,经16S rDNA序列测序比对后,初步将其中15株乳酸菌鉴定为干酪乳杆菌或副干酪乳杆菌群。再利用特异性基因recA[7]序列进行鉴定分析后,将其中5株确定为副干酪乳杆菌,随后对菌株环境耐受性进行研究,为开发商业发酵剂和副干酪乳杆菌的鉴定提供了参考。
1 试 验
1.1 材料
1.1.1 试验菌株与试剂
15株分离自西藏传统乳制品中的干酪乳杆菌或副干酪乳杆菌群,M RS培养基,溶菌酶,2×Taq PCR M aster mix,DL 2000 DNA m arker,牛黄胆酸钠,盐酸,胃蛋白酶,胰蛋白酶,碳酸氢钠等,化学试剂均为分析纯。
1.1.2 仪器与设备
BCN 1360型生物洁净工作台,DHP-9272型电热恒温培养箱,7000 PCR扩增仪,DYY-10C型电泳仪,TGC-16G型离心机,Delta320 pH计等。
1.2 方法
1.2.1 菌株分离及保藏
在无菌条件下,取传统发酵乳制品样品100μL或0.1 g于900μL无菌生理盐水(0.85%,w/v)中,振荡混匀,得到10-1cfu/m L的菌悬液。然后对菌悬液进行10倍梯度稀释,将稀释好的样品分别接种于灭菌M RS固体培养基,置于37℃恒温培养箱中厌氧培养48~72 h,菌落形成后观察并记录菌落形态。随后选取生长状态良好、菌落形态不同的单一典型菌落接种于液体M RS培养基中,在37℃厌氧条件下培养18~24 h,对菌株进行多次划线纯化。然后挑取单一菌落进行革兰氏染色和镜检,将确定为革兰氏阳性的菌株继续活化,并对其进行过氧化氢酶试验。若菌株为革兰氏阳性菌,过氧化氢酶阴性,则将其暂定为乳酸菌,并进行保种,以便进行后续试验。
1.2.2 16S rDNA序列鉴定
首先采用改良的Chelex[8]方法对分离菌株DNA进行提取,其方法如下:(1)取2 m L培养至对数期的菌液(菌液浓度为108cfu/m L),12 000 r/min,离心2 min,弃掉上清,收集菌体。(2)取1 m L生理盐水反复洗涤菌体3次,12 000 r/min,离心2 min,弃掉上清。(3)菌泥中加入提取液(25%Chelex®100,0.5%NP40,1×TE缓冲液配制,pH=9.0),进行56℃孵育30 min。(4)将上述混合液煮沸10 min,12 000 r/min,离心2 min,取上清液,即为DNA,保存于-20℃直至使用。用1%琼脂糖凝胶电泳对提取的菌株DNA进行检测。
随后以菌株DNA作为模板进行PCR扩增,引物采用细菌16S rDNA的通用引物27F和1492R,序列如下:27F:5'-AGTCTCTGATCATGCCTCAG-3';1492R:5'-AAGGAGGTGCTCCAGCC-3',采用50μL反应体系。PCR反应条件如下:94℃预变性5 min,95℃1 min,55℃1 min,72℃1 min,30个循环;72℃延伸5 min;4℃保存。PCR完成后进行16S rDNA测序,对测序结果进行比对分析。
1.2.3 recA基因引物设计及扩增
本研究通过比较基因组学分析Lb.paracasei ATCC 334的全基因组序列,选取recA基因作为特异性靶基因进行特异性引物设计,以区分干酪乳杆菌及副干酪乳杆菌[9]。recA基因引物设计结果如下:

表1 引物序列
PCR反应条件为94℃预变性5 min,95℃30 s,57℃30 s,72℃30 s,30个循环;72℃延伸5 min;4℃保存。PCR扩增完成后利用1%琼脂糖凝胶电泳检测扩增效果,对扩增产物进行测序后进行比对分析。
1.2.4 环境耐受性试验
1.2.4.1 耐酸性试验
2代活化的菌悬液于10 000 g,4℃离心5 min,然后用PBS清洗3次菌泥,按3%的接种量接种于HC l调整后p H值为3.0的液体M RS培养基中,37℃培养,分别取0、1、2、3 h时的菌液稀释涂布,以新鲜MRS培养基为空白对照,计算存活率。
1.2.4.2 耐胆盐试验
按3%的接种量将菌悬液接种于胆酸盐浓度为0.3%的MRS液体培养基中,37℃培养0、1、2、3和4 h时,分别取100μL样品进行10倍梯度稀释,取适当梯度的稀释液进行涂布计数,以新鲜MRS培养基为空白对照,计算存活率。
1.2.4.3 人工胃肠液耐受性试验
活化2代的菌悬液离心后用PBS清洗3次,将菌泥重悬于经滤膜过滤除菌的人工胃液(0.35%胃蛋白酶、0.3%N aC l、调整至p H 3.0)中,37℃分别培养0、1、2、3 h时取100μL菌液稀释涂布,用平板菌落计数法计算活菌数,测定菌株在酸性胃液条件下的耐受性。当菌体在人工胃液中处理3 h后,吸取1 m L含菌人工胃液,加入至9 m L经滤膜过滤除菌的人工肠液(1.1%碳酸氢钠、0.3%N aC l、0.1%胰蛋白酶、0.6%胆盐,调整至p H 8.0)中,于37℃培养,分别在0、3、5、7、8 h时吸取100μL菌液稀释涂布,用平板计数法计算活菌数,测定菌株在肠中的耐受性。以新鲜M RS培养基为空白对照,计算存活率。
1.2.5 数据统计分析
每个试验样品设置3组平行,结果取平均值,利用M EGA软件对分离菌株的16S rDNA序列和recA基因序列进行系统发育分析,采用O rigin软件作图分析。
2 结果与讨论
2.1 菌株分离及16S rDNA测序
从传统乳制品中分离出35株待定乳酸菌,进行16S rDNA测序,测序结果显示编号1到15的菌株全部为干酪乳杆菌或副干酪乳杆菌,运用通用引物进行PCR所获得的序列进行系统发育树的构建(图1),发现无法区分菌株种属。
2.2 recA引物扩增结果
利用副干酪乳杆菌特异性基因recA设计特异性引物,对15株16S rDNA测序结果为干酪乳杆菌或副干酪乳杆菌的菌株进行PCR扩增,通过琼脂糖凝胶电泳进行验证,发现存在清晰条带。随后针对测序结果进行Blast比对,确定其中5株为副干酪乳杆菌,分别编号为KY 1、KY 2、KY 3、KY 4和KY 5。利用M ega软件将5株分离株与标准菌株(Lb.paracasei ATCC 334、Lb.paracasei ATCC 25302、Lb.paracasei JCM 8130、Lb.casei ATCC 393)的recA序列构建系统发育树,从图2中可以发现,5株分离株与副干酪乳杆菌亲缘关系更近,说明recA基因可以较好的区分亲缘关系较近的干酪乳杆菌与副干酪乳杆菌。
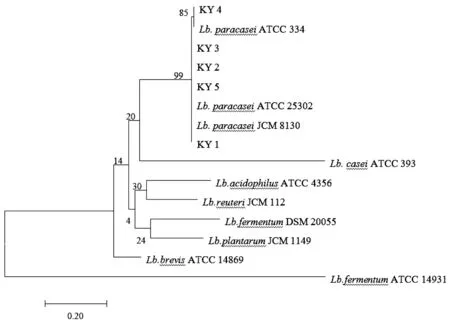
图2 基因序列的系统发育树
2.3 耐酸性试验
人体中胃液的p H一般在2.5~3.5之间,食物在胃中的消化时间一般为1~3 h,因此选择p H值3.0作为试验条件来评价菌株对酸的耐受性。针对5株筛选出的副干酪乳杆菌进行耐酸性试验,试验结果如下图3所示。由图3可知,在pH值为3.0的MRS中生长3 h后,副干酪乳杆菌KY 1、KY 2的存活率仍达到30%以上,说明KY 1、KY 2对酸性环境有较强的耐受性,因此选取副干酪乳杆菌KY 1和KY 2作为后续试验的试验菌株。SKask[10]等人研究了从奶酪中分离出的副干酪乳杆菌在内的6株乳酸菌,研究结果发现副干酪乳杆菌在酸性条件下具有更高的生长速率。
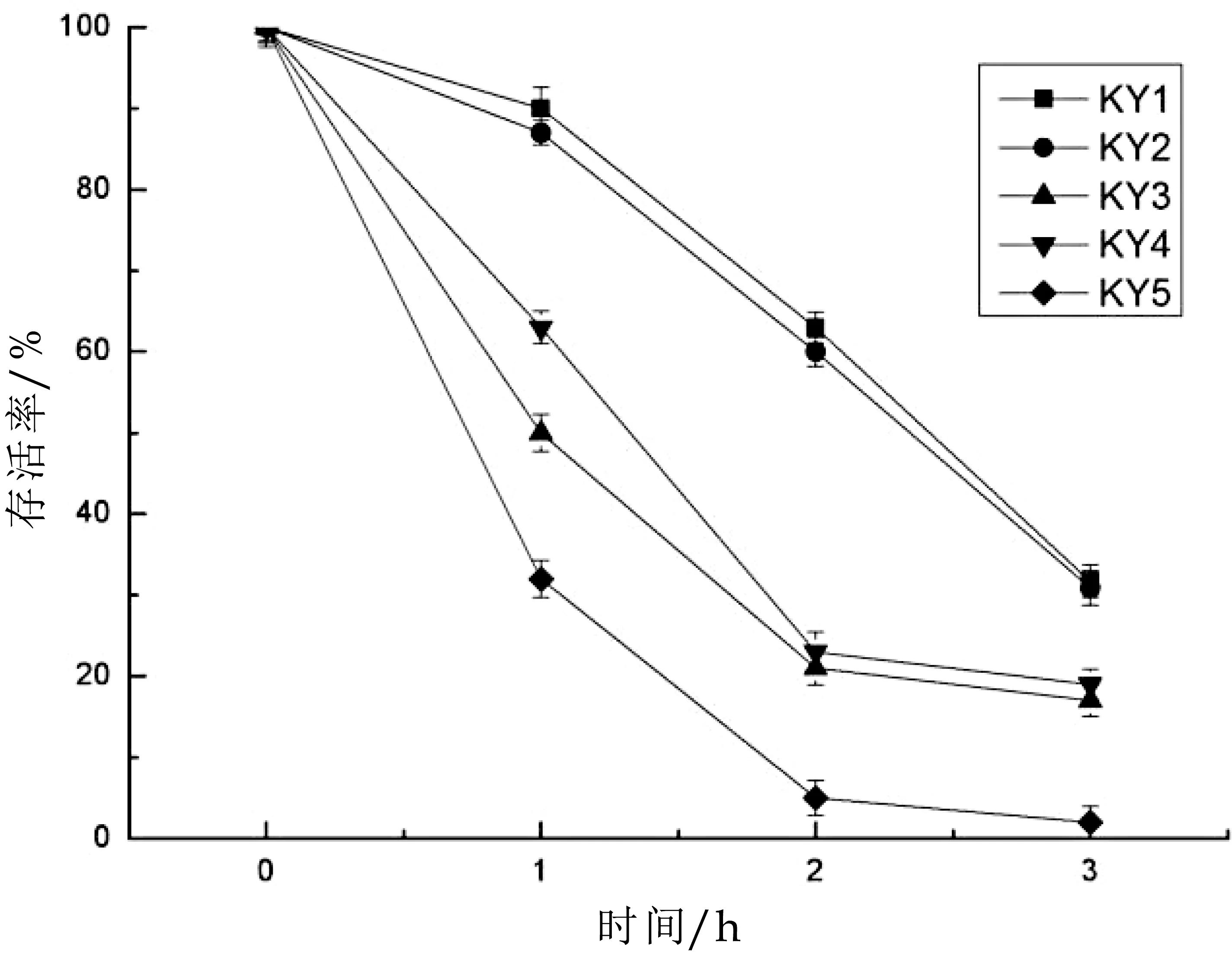
图3 副干酪乳杆菌KY1-5对酸的耐受性(pH3.0)
2.4 耐胆盐试验
本试验选取胆盐浓度为0.3%的M RS,分别作用0、1、2、3、4 h后通过平板计数评价菌株对胆盐的耐受性。结果如图4所示,可以看出副干酪乳杆菌KY 1和KY 2对胆盐均具有很高的耐受性,在3 h时菌株存活率可达到69.1%和64.9%。胆盐浓度的选择是由于正常人体肠道内胆盐浓度最接近于0.3%[11],因此本研究的耐受性试验具有较高的实际意义。

图4 副干酪乳杆菌KY1、KY2对胆盐的耐受性(0.3%)
2.5 耐人工胃液试验
人体胃液呈酸性,其中还含有一些酶类物质,其酸性环境和酶类物质对于乳酸菌发挥益生功能作用具有很强的抑制作用[12],因此对胃肠液具有高耐受性的益生菌发酵剂具有很高的工业应用价值。本研究选取通常情况下胃中p H值为3.0的条件下,处理0、1、2、3 h后,进行菌落计数,评估菌株对人工胃液的承受能力。试验结果如图5所示,模拟人工胃液处理3 h后,KY 1和KY 2的存活率分别为15.1%和13.2%。
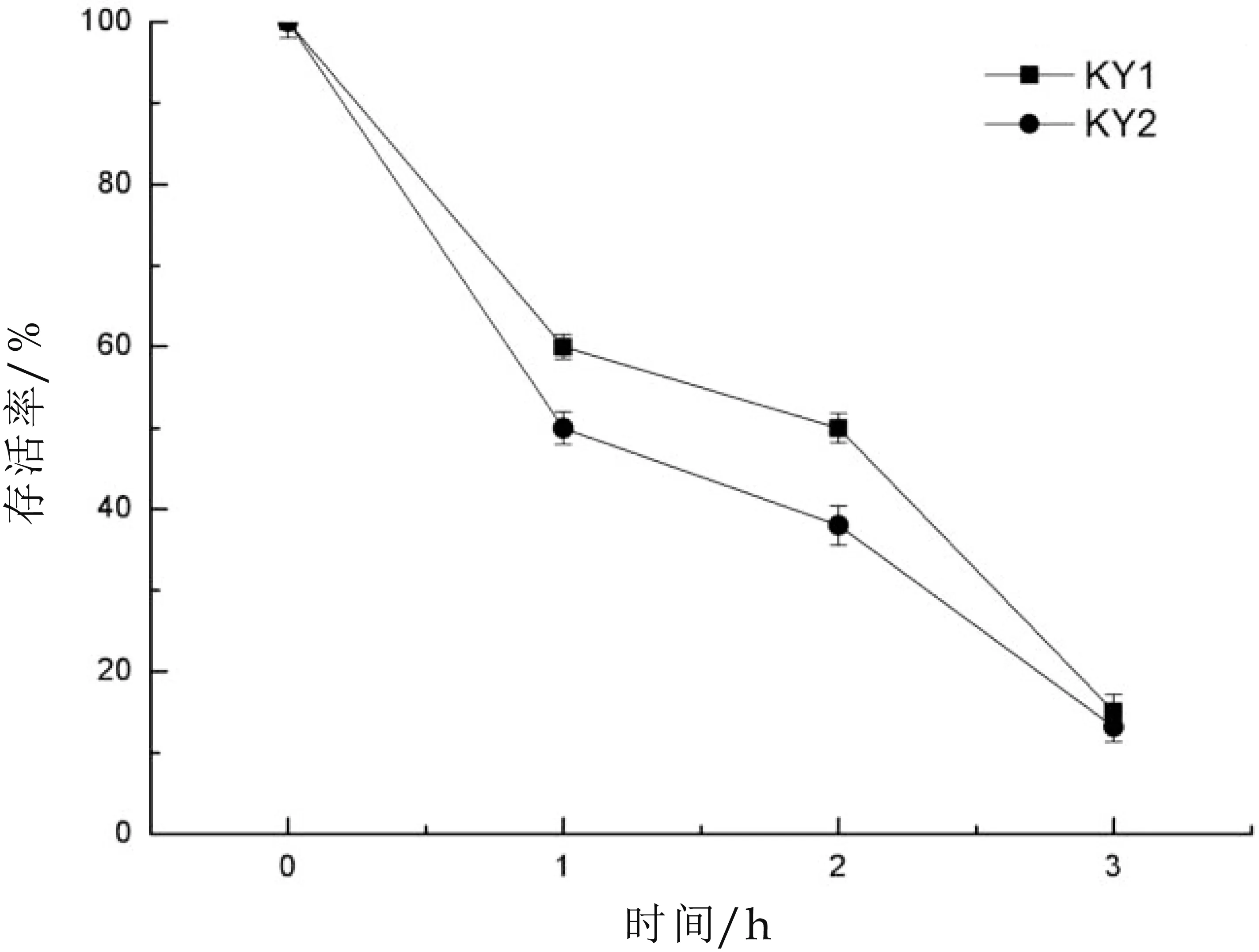
图5 副干酪乳杆菌KY1、KY2对人工胃液的耐受性
2.6 耐人工肠液试验
食物经过胃部消化后进入肠道,肠道中的菌群生长会受到多种成分的影响,益生菌需要有能力耐受肠道内的胰蛋白酶及碱性环境才能够发挥其益生作用。小肠内的pH一般在7.6左右,食物在小肠内会停留3~8 h[13]。因此,本试验选取pH 8.0的人工肠液处理0、3、5、7、8 h后,通过平板计数检测副干酪乳杆菌KY 1和KY 2对人工肠液的耐受性。结果如图6所示,两株副干酪乳杆菌KY 1和KY 2在模拟人工肠液中处理8 h后存活率能够分别维持到48.9%和48.3%,可见这两株副干酪乳杆菌都具有很好的人工肠液耐受能力。

图6 副干酪乳杆菌KY1、KY2对人工肠液的耐受性
3 结 论
本研究针对西藏传统乳制品中分离出的35株乳酸菌进行了16S rDNA测序和特异性recA基因扩增,确定其中5株为副干酪乳杆菌,并发现recA序列可以较好的区分亲缘关系较近的干酪乳杆菌与副干酪乳杆菌。再针对这5株副干酪乳杆菌进行耐受性评价,试验结果表明副干酪乳杆菌KY 1、KY 2具有较高的酸耐受性,胆盐耐受性和人工胃肠液耐受性,意味着两株副干酪乳杆菌KY 1、KY 2具有较高的潜力成为工业化发酵剂。
