[18F]F-DOPA合成方法的研究进展
2019-07-03成伟华郭飞虎邓雪松秦祥宇樊红强
成伟华,郭飞虎,邓雪松,秦祥宇,樊红强,胡 骥
(原子高科股份有限公司,北京 102413)
正电子发射型计算机断层扫描显像(positron emission tomography,PET),由于其灵敏度高,特异性好,安全性好,并且可以进行全身显像,已广泛用于多种疾病的诊断与鉴别诊断、疗效评价和新药开发等[1]。左旋多巴(3,4-二羟基-L-苯丙氨酸)是中枢神经递质多巴胺的前体物质,用于治疗帕金森病,18F标记的左旋多巴类似物6-[18F]氟-3,4-二羟基-L-苯丙氨酸([18F]F-DOPA,1)是研究大脑多巴胺功能的正电子显像剂,用于早期诊断帕金森病[2]和肿瘤的诊断与鉴别[3]。目前,[18F]F-DOPA的合成方法主要有亲电取代法和亲核取代法。亲电取代法是目前制备[18F]F-DOPA较常用的方法,用标记前体2与[18F]F2进行亲电取代得到[18F]F-DOPA (1)[4-5](图1),RCY为(6.4±1.7)%。

图1 亲电合成[18F]F-DOPA (1)
由于生产[18F]F2时必须用稳定F2作为载气以减少[18F]F2的吸附,因此最终产品为有载体[18F]F-DOPA,同时此方法的RCY低,比活度低。已报道的亲电取代自动化合成方法中[6-8],[18F]F-DOPA的比活度都不高(>100 MBq/μmol)。Forsback 等[9]改变反应溶剂发现,氘代二氯甲烷(RCY=7.8%),氘代三氯甲烷(RCY=7.5%)和氘代丙酮(RCY=8.5%)都比三氯氟甲烷(RCY=6.0%)RCY高,在反应中加入醋酸可以提高RCY,且产品质量不受改变溶剂的影响。近期研究发现[10],通过Ag前体化合物4亲电合成[18F]F-DOPA (1)(图2),RCY为(19±12)%,此法比前述的亲电合成方法效率高。

图2 通过含银化合物亲电合成[18F]F-DOPA (1)
亲核取代合成[18F]F-DOPA,以无载体的[18F]F-作为亲核进攻试剂,并且亲核氟化反应具有好的选择性,可以得到单一对映体[18F]-DOPA,且不需要高效液相进行分离纯化,可得到高比活度的[18F]F-DOPA。本文对近几年通过亲核取代合成[18F]F-DOPA的方法进行综述。
1 通过含Ni前体化合物合成
Lee等[11]报道了通过氧化亲核取代反应快速制备得到含保护基团[18F]F-DOPA前体化合物7(图3)。此方法首先合成含镍的化合物6,这个化合物在空气、水和硅胶中都很稳定。然后,在高价碘化合物存在下,18F-与含镍的化合物6反应1min就可以得到高比活度无载体的[18F]F-DOPA前体化合物7,RCY为15%。此方法特别之处是无需用共沸的方法来进行除水处理,直接反应,可节省总的反应时间,缺点是化合物(高价碘)不稳定且合成比较复杂。Zlatopolskiy等[12]运用这个方法优化了反应条件,合成了[18F]F-DOPA、[18F]FMT和[18F]FDA,其中合成得到的[18F]F-DOPA总的合成时间50 min,RCY约7%,比活度为175 GBq/μmol(通过亲电取代的方法比活度为30 MBq/μmol)。作者同时还观察了另外两种含碘氧化剂1-亚碘酰苯和2-亚碘酰-1,3,5-三甲基苯对反应的影响,结果用这两种氧化剂时反应不能发生,说明此反应碘氧化剂具有专一性。

图3通过含镍化合亲核合成[18F]F-DOPA 前体化合物7
2 通过碘鎓盐前体化合物合成
DiMagno等[13]报道三氟磺酸二芳基碘鎓盐8在干燥的乙腈中,可以通过阴离子交换得到碘鎓盐[18F]氟化物9,在非极性溶剂中脱去碘鎓成功氟化得到含保护基团的[18F]F-DOPA10,经氢溴酸脱保护得到[18F]F-DOPA (1)(图4)。由于这是一篇专利文献,具体细节没有详细阐述。
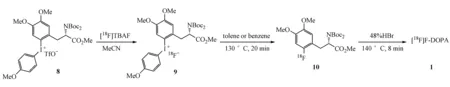
图4 通过碘鎓盐前体化合物亲核合成[18F]F-DOPA (1)
Wang等[14]发现通过碘鎓盐可以提高氟化反应效率。Edwards等[15]用Boc保护基团的碘鎓盐来合成[18F]F-DOPA (1),此方法不用金属催化,合成前体化合物11稳定且无毒,优化了反应条件,分别进行了“冷”和“热”的氟化反应,可得到高比活度的[18F]F-DOPA前体化合物12(图5)。在优化反应条件时发现,用二甲基亚砜和乙腈做为混合溶剂,反应可以进行,而单独以二甲基亚砜作为溶剂时,反应不发生。用N,N-二甲基甲酰胺或者乙腈作为溶剂时,会出现很多不能确定的标记副产物。在各种反应条件下,RCY小于1%,表明如此低的RCY并不适用于常规生产[18F]F-DOPA。

图5 通过二芳基碘鎓盐化合物亲核合成[18F]F-DOPA 前体化合物12
Ichiishi等[16]发现三甲苯基取代碘鎓盐(四氟化硼)13在铜-催化下氟取代,空间选择性很好,最后得到[18F]F-DOPA前体化合物14(图6)。标记率为(31±3)%。到目前为止,在临床上没有自动化合成[18F]F-DOPA的路线,为了证实运用此方法自动化合成[18F]F-DOPA的可能性,同时作者用三甲苯基取代的碘鎓盐(甲苯磺酰基)自动化合成[18F]F-DOPA前体化合物14,标记率(17±5)%,比活度(4 000±2 000)Ci/mmol(用13-BF4作为起始原料,得到化合物14,RCY为1.1%,比活度为290 Ci/mmol)。

图6 通过二芳基碘鎓盐化合物亲核合成[18F]F-DOPA 前体化合物14
3 通过碘酰基前体化合物合成
之前报道用碘酰基化合物来进行18F标记的方法比较少,Rotstein等[17]报道了用碘酰基化合物进行18F 标记的方法。Satyamurthy等[18]也运用碘叶立德合成含保护基团的[18F]F-DOPA前体化合物16,但是具体细节未阐述。作者还用此方法进行18F标记化合物15b,RCY尚可接受(5%~ 10%),但标记前体化合物15b不稳定限制了此方法的应用[19](图7)。

图7 运用碘叶立德和碘酰基化合物亲核合成[18F]F-DOPA前体化合物16
4 铜-催化合成
Tredwell等[20]在铜催化下,利用前体化合物硼酸酯17,合成[18F]F-DOPA前体化合物18(图8),RCY为(55±23)%,通过HI脱保护后得到单一对映体的[18F]F-DOPA(ee>99%)。此方法前体化合物硼酸酯易于合成,毒性比较低,并且Cu催化要比Ni或Pd更安全,反应在空气环境下就可进行。当前亲电合成方法得到[18F]F-DOPA剂量范围是300~1 200 MBq/mmol[4-5],运用铜催化合成方法生产可以得到609 MBq/mmol[18F]F-DOPA,并且产品达到欧洲药典的质量要求,可见该法可用于[18F]F-DOPA的常规生产。

图8 铜催化亲核合成[18F]F-DOPA前体化合物18
Makaravage等[21]在铜催化条件下,以N,N-二甲基苯胺和吡啶溶剂中,进行前体化合物19的18F标记,得到含保护基团的[18F]F-DOPA20(标记率为56%±12%)(图9),与近几年报道的亲核取代标记方法相比,该标记率是比较高的。另外,标记前体化合物19是亲电取代生产[18F]F-DOPA的标记前体衍生物,并已经商业化了,表明此方法有望成为亲核取代生产[18F]F-DOPA最具潜力的方法。

图9 铜催化亲核合成[18F]F-DOPA前体化合物20
5 同位素交换合成
2001年Tierlinq等[22]通过离子交换的方法,通过19F化合物21得到[18F]F-DOPA前体化合物22,经Baeyer-Villiger氧化、水解可得到[18F]F-DOPA (2)(图10),RCY(未校正)8%~10%,反应时间70 min,单一对映体约70%。结果表明,有合适离去基团,此法可得到高比活度的[18F]F-DOPA。
此后Wagner等[23]继续研究通过离子交换法合成[18F]F-DOPA,采用了新的离去基团化合物23,在相转移催化剂碳酸氢四丁铵存在下经离子交换得到标记化合物24,再氧化、水解得到[18F]F-DOPA (1)(图11),此方法得到的单一对映体大于96%,RCY约22%,合成时间105 min,比亲电合成法得到[18F]F-DOPA的比活度高(2 GBq/μmol),并且此方法很适合自动化合成。

图10 利用同位素交换合成[18F]F-DOPA (1)

图11 通过同位素交换合成[18F]F-DOPA (1)
6 手性相转移催化合成
通过手性相转移催化剂合成[18F]F-DOPA也是一有效的方法[24],Lemaire课题组报道了一种芳环多步合成[18F]F-DOPA的方法[25-27],首先含硝基化合物25进行18F标记得到化合物26,经过还原取代得到碘取代的化合物28,然后在手性催化剂(29或30)的条件下,与希夫碱31区域选择性加成,经过水解和HPLC纯化得到单一对映体[18F]F-DOPA(1,97%ee),反应时间63 min,RCY为(36±3)%,比活度超过753 GBq/mmol(图12)。此方法已运用到GE公司FASTlab合成仪上。

图12 手性相转移催化合成[18F]F-DOPA (1)
7 结 语
[18F]F-DOPA作为肿瘤和中枢神经系统疾病的显像诊断试剂,已应用多年。利用亲电合成的[18F]F-DOPA,存在有载体、比活度比较低等缺点,尽管亲电取代也一直在研究发展,但是亲核取代合成[18F]F-DOPA具有无载体(除同位素交换法)、比活度高等优势。所以近年来亲核取代方法受到了广泛的关注和研究,近年来亲核取代方法优劣比较见表1。
表1 亲核合成[18F]F-DOPA的方法优缺点

方法优点缺点商业应用参考文献Ni介导标记反应只需1min,产物比活度高反应化合物(存在高价碘)不稳定且合成比较复杂否[11-12]碘鎓盐不使用金属催化剂RCY<1.1%否[16]碘酰基—标记前体化合物不稳定否[18-19]铜-硼酸酯前体化合物易合成,反应温和比活度较低是[20]铜-锡取代基标记率比较高,标记前体已商业化—有潜力[21]离子交换适合自动化合成存在载体否[23]手性相转移催化反应时间较短,RCY高,产物高比活度—是[26]
从表1可见,采用金属催化、手性相转移催化或碘鎓盐合成等方法,不仅克服了以上的缺点,而且其中的一些方法已在国内实现了自动化。例如,最近中国人民解放军总医院核医学科付华平等[28]应用了Tredwell等[20]的方法,进行了国产化氟多巴功能模块合成,[18F]F-DOPA合成耗时60 min;不校正合成效率为(10.0±2.3)%(n=6),放化纯度大于99%,产量大于7.4 GBq。人体PET结果显示良好,产品质量符合临床要求。中山大学文富华等[29]应用Lemaire等[26]报道的方法,使用进口多功能ALLINONE合成仪及其配套卡套和试剂盒得到[18F]F-DOPA注射液,实现[18F]F-DOPA自动化生产,并对获得的[18F]F-DOPA注射液进行质量检测与分析,合成时间约80 min,校正RCY为(63.1±3.8)%(n=10),放化纯度大于98%,产品质量达到动物和人体PET显像要求。相信在不久的将来,通过亲核取代法合成高比活度的[18F]F-DOPA将会广泛应用于常规生产中。
