肝癌干细胞表面标志物研究进展综述
2019-07-02李民举
李民举
摘 要: 肝癌是世界最常见的癌症之一。近年来,对肝癌干细胞的研究逐渐深入。在肝癌干细胞起源的问题上,目前各项研究的意见尚不统一。在肝癌干细胞表面标志物方面,诸多学者进行了深入的实验研究和理论探索,希望能够为肝癌的临床诊断技术和治疗手段的提高提供新的思路。就近几年来对肝癌干细胞的起源以及表面标志物的研究进展加以综述,并对肝癌干细胞表面标志物的应用前景加以展望。
关键词: 肝癌;肝癌干细胞;表面标志物;综述
中图分类号: F24 文献标识码: A doi:10.19311/j.cnki.1672-3198.2019.13.040
肝细胞癌(以下简称肝癌)即肝脏恶性肿瘤,是世界五大常见癌症之一。在我国,因肝癌致死的人数位列恶性肿瘤致死人数的第二位,仅次于肺癌,给我国民众带来了较大的健康威胁和经济负担。
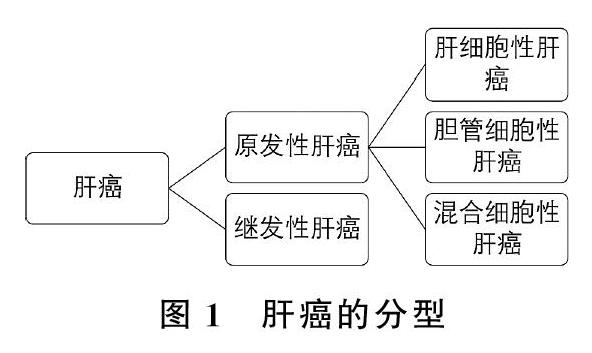
肝癌可分为原发性肝癌(Primary Hepatocellular Carcinoma)和继发性肝癌(Secondary Hepatocellular Carcinoma)两大类,其中原发性肝癌是最为人们所熟知的。而原发性肝癌又主要包括肝细胞癌和肝内胆管癌等。原发性肝癌凭借其高发病率与高死亡率严重地威胁到人们的生命健康安全。肝癌发病隐匿,不易被人们察觉。多数患者在医院检查出身患肝癌时已处于中期或晚期。再加上脂肪肝、肝硬化等以肝疾病为首的各种致病因素,即使是肝癌根治性切除疗法,其术后也有极高的复发率,使得患者术后无法得到有效的治疗保障。
图1 肝癌的分型
近年来,随着对癌症的深入讨论和不断研究,人们提出了“肿瘤干细胞”(Cancer Stem Cell,CSCs)这一概念:CSCs是一群存在于某些肿瘤组织中的干细胞样细胞。因此,CSCs同样具有无限增殖、转移及强耐药的能力。迄今为止,人们对肝癌的治疗方法仍限于以肝部分切除为主,以放疗、化疗配合相关药物治疗为辅助手段,但效果并不理想。在肝癌患者术后高复发率的现象的启示下,研究推测并证实了肝癌中同样存在着肝癌干细胞,且其在肝肿瘤组织中起着极为重要的作用。如果能研究清楚肝癌干细胞在肝癌中起着怎样的作用以及存在着何种机制,就会为肝癌的研究、诊断和治疗提供一个新的方向。本文从肝癌干细胞的起源和肝癌干细胞表面标志物两方面对近些年来肝癌干细胞的主要研究进展加以综述。
1 肝癌干细胞的来源
肝脏是人体内具有极强的恢复、再生能力的器官,由此可知其细胞必定具有强大的克隆能力。按照肝细胞的来源,我们可以将其分为两种,一种称之为肝源性干细胞,而另一种称之为非肝源性干细胞。第一种细胞是由肝脏内部未分化的卵圆细胞形成而来,另一种则是由骨髓中的造血干细胞分化形成。因此可推断:肝干细胞的来源是多元的。只是目前肝癌干细胞由何而来的问题在学术界仍然存在争议。其中,主要分为成熟肝细胞来源与肝干细胞来源两种观点。前者在实验基础上认为,成熟的肝细胞在去分化的作用下可获得干细胞的生物特性变为肝癌干细胞;有部分实验报告表明,变异的卵圆细胞可以形成肝癌,例如,人们在病毒性肝炎、酒精性肝炎等类似肝疾病中均可观察到卵圆细胞的增殖与分化。后者通过实验观察发现,当肝干细胞在成熟过程中受到阻碍时,也会变异形成肝癌干细胞。近年来,随着人们对肝癌及其与肝干细胞间的关系研究得越发清楚,再加上大量的实验结果,越来越多的人推测:肝干细胞成熟过程受碍极有可能是形成肝癌干细胞的最主要因素。
2 肝癌干细胞表面标志物
肝癌干细胞表面标志物(Liver Cancer Stem Cell Surface Marker),即在肝癌干细胞表面存在的高表达的特异分子。对肝癌干细胞表面标志物的研究有利于人们对肝癌细胞进行甄别、选择、分离,同时,在现实的临床应用方面,如肝癌的诊断和治疗,均起到重要的作用。
2.1 CD133
CD133是具有5个跨膜结构域,且在细胞膜外有两个较大环的糖蛋白。2009年,张荣生等研究发现:CD133+细胞在体外具有极强的增殖分化能力,与人们研究的肿瘤干细胞的特性相似。另外,张宝芹也在实验中观察到:CD133+细胞其致瘤能力远超过CD133-细胞。因此有人认为CD133或许可以视为肝癌干细胞表面标志物,并以此进行选择和分离。但是随着近年来研究的深入,Zhu Z等研究表明:并非有CD133糖蛋白的细胞就是肝癌干细胞。同时,他们认为CD133和CD44糖蛋白的共表达可更精确地确定肝癌干细胞的表型。因此,CD133不能单独作为肝癌干细胞的判断依据。
2.2 CD44与CD90
CD44糖蛋白既是细胞的表面标志物,也是透明质酸的受体,与细胞、胞质黏连以及迁移相关密切。CD90锚定蛋白既是细胞表面的糖蛋白,也是细胞黏附分子免疫球蛋白超家族中最小的一种。根據Yang等的实验得出:CD44与CD90间存在着一定的联系,CD44能够阻断CD90细胞形成局部、转移性肿瘤结节;同时研究发现有着CD90+、CD44+表面标志物的肝癌细胞具有更强的侵袭性。杨蕊研究实验发现:CD90+肝癌细胞具有干细胞特性。同时,莘长明在实验中观察到,在手术后的肝癌患者体内,CD44+表面标志物的表达对肝癌的复发有着明显的作用。周四莲等通过实时荧光定量PCR和免疫组化法检测发现,远端癌旁组织中CD44mRNA和CD90mRNA的表达相比于肝癌组织中二者的表达较底,推测CD90和CD44与肝癌的发生紧密相关。而以上种种研究实验都指向:我们可以检测细胞表面是否同时存在CD44和CD90,并以此作为一种鉴定肝癌干细胞的手段。
2.3 CD13
CD13/氨基肽酶N,与上述表面标志物生物功能不同,是一种跨膜Ⅱ型金属蛋白酶,所结合的金属离子为锌离子,其活性表现为可切除肽链N端的氨基酸,并与寡肽N末端氨基酸切除的糖蛋白结合。含有CD13+的肝癌细胞大多分布在G0/G1期,由此可以得出,该种细胞具有较强的自我更新能力。SaiKi等通过研究CD13特异性单克隆抗体对肿瘤细胞转移和侵袭的影响,发现CD13作为酶类可能参与了肿瘤细胞的转移机制的激活。除此之外,侯金宁等研究CD13肝癌细胞发现:CD13肝癌细胞有着最强的成瘤能力,而且在体外培养的肝癌细胞中表达更高,同时还发现该细胞具有较强的化学耐药性。由此可以推断,肝癌的复发与CD13/氨基肽酶N密切相关,其是肝癌干细胞的表面标志物的可能性极高。因此针对CD13进行靶向治疗以及抑制CD13表面标志物表达的相关药物的研发或会对肝癌的攻克起到重要的作用。
3 结语与展望
对肝癌干细胞起源的研究和推断缩小并精确了未来人们研究肝癌的范围,同时也为进一步了解肝癌干细胞的形成指明方向。表面标志物理论的提出和实验研究则对肝癌的治疗起到了一定推动作用,让人们对肝癌的理解更进一步。除了上文已提到的一些表面标志物,目前发现的表面标志物还有CD24、OV6、DLK1等。肝癌干细胞表面标志物的多样性从一定程度上揭露出肝癌干细胞表面标志物存在着特异性,提示在筛查肝癌干细胞时可以结合多种表面标志物的检验结果,对其加以进一步的分析与确定。
肝癌干细胞表面标志物的研究意义十分重大。它既是人们对不同肝癌进行诊断和进行靶向治疗的基础,也是人们进行特异性药物研究和开发的重要依据。相信未来人们会在此基础上发现更多的表面标志物,并找出表面标志物之间相互作用、共同表达的机制。进一步发展和完善靶向治疗技术,研发出对人体其他细胞损伤更小的抗癌药物。
参考文献
[1] 《中国卫生和计划生育统计年鉴》编辑委员会,《中国卫生和计划生育统计年鉴》编辑委员会.中国卫生和计划生育统计年鉴[M].北京:中国协和医科大学出版社,2017.
[2]章健,来维洁,周秀梅,王毅刚.靶向肝癌干细胞的肿瘤治疗进展[J].中国细胞生物学学报,2017,39(01):87-96.
[3]翟中和,王喜忠,丁明孝.细胞生物学[M].北京:高等教育出版社,2011.
[4]Dumble ML,Croager EJ,Yeoh GC T,et al.Generation and characterization of p53 null transformed hepatic progenitor cells:oval cells give rise to hepatocellular carcinoma[J].Carcinogenesis,2002,23(3):435-445.
[5]張荣生.CD133 作为肝细胞性肝癌肿瘤干细胞表面标记的初步研究[D].南京:南京医科大学,2009.
[6]张宝芹.干细胞表面标志 CD133 在肝癌中的表达及其阳性亚群增殖特性[J].中国组织工程研究, 2017,21(9):1319-1323.
[7]Zhu Z,Hao X,Yan M,et al.Cancer stem/progenitor cells are highly enriched in CD133+CD44+ population in hepatocellular carcinoma[J].International Journal of Cancer,2010,126(9):2067-2078.
[8]Yang ZF,Ho DW,Ng MN,et al. Significance of CD90+ cancer stem cells in human liver cancer[J].Cancer Cell,2008,13(2):153-166.
[9]杨蕊.基于MFH的抗CD90/17-AAG磁性热敏脂质体的制备及其靶向治疗肝癌的实验研究[D].南京:东南大学,2016.
[10]莘长明.CD44在肝细胞癌中的表达及其与复发转移的关系[D].天津:天津医科大学,2013.
[11]周四莲,匡志鹏.CD90和CD44分子在人肝癌组织中的表达[J].中国癌症防治杂志,2017,9(03):185-189.
[12]Saiki I,Fujii H,Yoneda J,et al.Role of aminopeptidase N (CD13) in tumor-cell invasion and extracellular matrix degradation[J].International Journal of Cancer,2010,54(1):137-143.
[13]基于肿瘤干细胞标记物CD13为靶标的抗癌药物发现[C]//中国药学大会暨中国药师周,2014.
