转基因杜仲再生体系的优化
2019-07-02242
242
(1. 贵州大学生命科学学院/农业生物工程研究院,贵州省农业生物工程重点实验室/山地植物资源保护与种质创新省部共建教育部重点实验室,贵阳 550025;2.贵州省山地生态与农业生物工程2011协同创新中心,贵阳 550025;3.贵州大学生命科学学院,贵阳 550025; 4.贵州省农业科学院,贵阳 550006)

图1 pGM 626-Act1-EuDIR3(A)和pSH 737-35S-EuDIR1(B)载体的T-DNA区域示意图
杜仲(EucommiaulmoidesOliver),杜仲科杜仲属,为第三纪孑遗物种,其干燥的叶和树皮皆可入药,是我国特有的传统中药材[1-2]。杜仲含有木脂素类、环烯醚萜类、苯丙素类等有效化学成分,具有双向调节血压、降血糖、滋养肝脏、抗菌、强化肌肉和骨骼、抗衰老和抗肿瘤等药理作用[3-6]。此外,杜仲还是重要的胶源植物,可用于制作优良的海底电缆、飞机轮胎等材料[7-9]。
由于杜仲生长缓慢[10],现代生物学开始利用植物组织培养技术来对天然代谢产物进行调控及生产[11-13]。杜仲愈伤组织诱导过程中,基本培养基有MS、B5、WPM和H等,其中MS培养基使用最多[14-18]。不同培养基对杜仲愈伤组织的诱导和继代培养有不同的影响,MS培养基对杜仲幼茎愈伤组织的诱导效果较好,而B5培养基不仅能增加杜仲叶愈伤组织的诱导率,对茎和叶愈伤组织的继代培养也有利[15]。在农杆菌介导植物的遗传转化过程中,提高遗传转化效率能为后续遗传体系的建立、功能基因的表达调控等研究提供理论和技术支持[19]。对杜仲遗传转化的研究主要集中在培养基的添加成分和培养时间等影响因素方面。赵丹等[20]利用农杆菌介导法研究卡那霉素浓度、共培养时间等因素对杜仲遗传转化的影响。李岩等[21]首次证明ipt基因能够增加杜仲不定芽的诱导率。周舒婷等[18]通过优化杜仲种子萌发过程中的种子切割方式、光照强度和转化过程中的激素浓度,提高了杜仲下胚轴遗传转化效率。杜仲作为木本植物,在遗传转化过程中,不定芽的分化及生根较为困难,而有关培养基质对杜仲遗传转化影响的研究鲜见报道。杜仲下胚轴作为外植体能够快速有效的进行杜仲愈伤组织分化和植株再生,但在经农杆菌遗传转化后,其在MS培养基中的分化和生根效率显著下降[22]。因此,为提高杜仲遗传转化过程中不定芽的获得率及生根率,本试验主要就3种不同培养基质条件对遗传转化杜仲下胚轴的影响进行研究。
1 试验材料与方法
1.1 试验材料
本试验所用杜仲种子由贵州大学农业生物工程研究院提供。
根癌农杆菌LBA 4404、大肠杆菌(E.coli)株系DH 5α及植物表达载体pSH 737-35S-EuDIR1和pGM 626-Act1-EuDIR3(图1)均由本实验室保存。
B5、MS和WPM培养基购自美国PhytoTechnology Laboratories公司;直接PCR扩增试剂盒购自上海生工生物工程;PCR所用引物由北京六合华大基因公司合成。
1.2 方 法
1.2.1农杆菌介导杜仲遗传转化
参照周舒婷等[18]的方法培养无菌苗并制备外植体,培养基配制参照赵丹等[20]、chen等[23]的方法,重悬液、共培培养基、筛选培养基、生根培养基各采用3种基质配比(MS:4.43 g·L-1;B5:3.21 g·L-1;WPM:2.41 g·L-1),其中重悬液添加30 g·L-1蔗糖+3μmol·L-16-BA+3μmol·L-12-IP+20 mg·L-1As(pH=5.2);共培培养基添加30 g·L-1蔗糖+3μmol·L-16-BA+3μmol·L-12-IP+20 mg·L-1As+2.4 g·L-1植物凝胶(pH=5.2);筛选培养基添加30 g·L-1蔗糖+3μmol·L-16-BA+3μmol·L-12-IP+100 mg·L-1Tim+0.25 mg·L-1草铵膦(或25 mg·L-1卡那霉素)+2.4 g·L-1植物凝胶(pH=5.8);生根培养基添加30 g·L-1蔗糖+1μmol·L-1NAA+100 mg·L-1Tim+0.25 mg·L-1草铵膦(或25 mg·L-1卡那霉素)+2.4 g·L-1植物凝胶(pH=5.8)。
表1 3种培养基中不定芽诱导情况

培养基转化质粒平均外植体数/个愈伤组织生长情况平均出芽数/个平均出芽率/%B5A189多数长势良好,生长旺盛,色泽鲜艳呈绿色,质地紧密脆嫩4020.99±0.25B240多数生长良好,呈黄绿色,质地紧密,少数枯死218.60±0.37MSA173多数呈黄绿色,部分或泛白或泛黄或泛褐1710.00±0.61B274生长较慢,色泽暗淡,部分泛褐,有的甚至枯死155.35±0.20WPMA161多数生长缓慢,部分色泽暗或泛黄或泛白或泛褐,生长不良且质地疏松,大部分不长愈伤,有的甚至枯死74.33±0.31B214呈黄绿色透明状,少数枯死,或泛白或泛黄或泛褐83.76±0.75
注:A代表pGM 626-Act1-EuDIR3;B代表pSH 737-35S-EuDIR1。
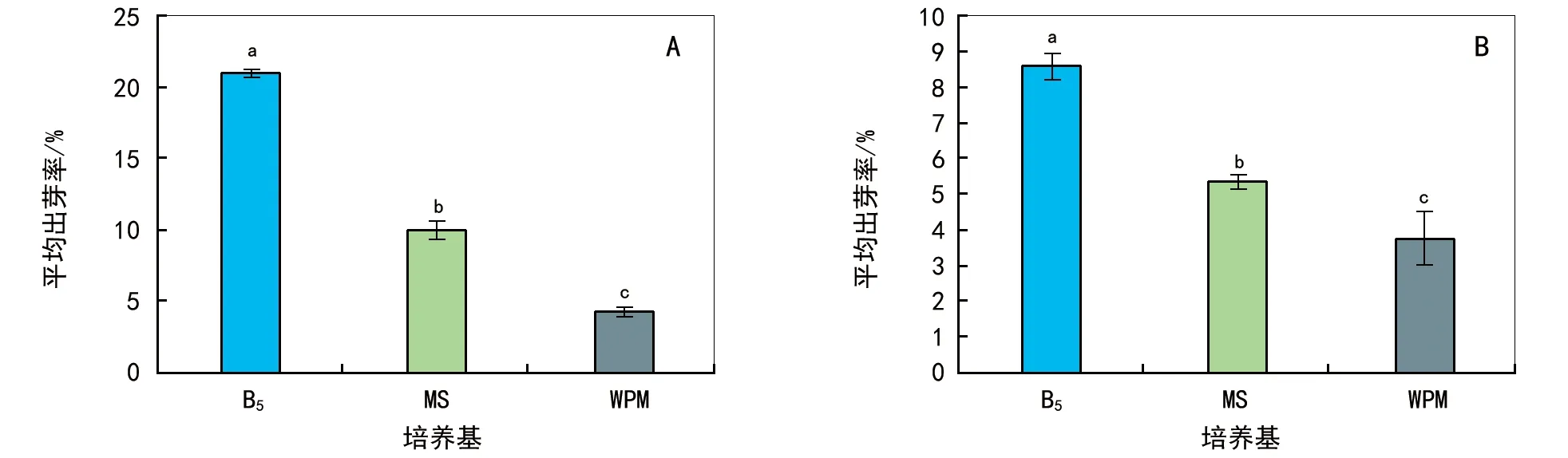
注:不同字母表示差异显著(p<0.05)。图2 3种培养基中转化不同质粒的外植体出芽率情况
将外植体分别置于含质粒pGM 626-Act1-EuDIR3或pSH 737-35S-EuDIR1的3种农杆菌浸染液中浸染3 min,用无菌纸吸干浸染液,分别紧密排布于对应共培培养基上,28 ℃暗培3 d后分别转入至各筛选培养基中。每2周更换1次培养基,10 d左右外植体周围长出愈伤组织,随后分化出不定芽,每2周更换1次培养基,统计外植体和不定芽数量,并计算出芽率。每种条件设置3个生物学重复。
出芽率(%)=(不定芽数/接种的外植体数)×100%。
1.2.2阳性芽的鉴定
GUS染色参照Jefferson[24]方法进行。将筛选出的杜仲不定芽叶片浸在GUS染液中,37 ℃反应8~10 h,取出叶片放入75%乙醇中脱色12 h,然后通过实体显微镜观察外植体染色情况。同时对获得的所有不定芽进行直接PCR检测,扩增载体上的部分GUS基因,筛选出阳性芽。用于转基因阳性芽检测的PCR引物分别为F:5’-GGTGATTGATGAAACTGCTG-3’和R:5’-GAACATTACATTGACGCAGG-3’。PCR扩增体系20μL,扩增程序为94 ℃ 3 min;94 ℃ 1 min,57 ℃ 1 min,60 ℃ 2 min,35个循环;最后72 ℃延伸5 min。PCR产物经1.2%琼脂糖凝胶电泳,由凝胶成像系统拍照统计筛选出的转基因阳性芽数量,并计算阳性芽数与不定芽数比值。
1.2.3阳性芽的生根培养
待上述阳性芽长度到达2 cm以上,将其从外植体上切下放入3种对应的生根培养基中,统计生根数并计算生根率。

注:WT:野生型;TP:转基因型;M:DL 2000 Marker;-:阴性对照;+:阳性对照;1~3:转基因阳性芽。图3 部分转基因阳性芽的GUS染色检测(A)及直接PCR检测(B)
生根率(%)=(生根的阳性芽数/阳性芽数)×100%。
1.2.4数据处理
试验数据利用Microsoft office Excel 2003软件及DPS 7.05软件进行处理和分析,用LSD-t检验进行显著性分析。
2 结果与分析
2.1 杜仲不定芽再生
以杜仲下胚轴为外植体,B5、MS和WPM为培养基,选用2种不同载体(分别包含35S启动子和卡那霉素筛选标记以及Act1启动子和草铵膦筛选标记)进行杜仲遗传转化。转入2种质粒的愈伤组织在B5培养基上长势较好,色泽鲜绿或呈黄绿色,出芽数较多;而在WPM培养基上生长缓慢,色泽暗淡或呈黄绿色透明状,甚至枯死,出芽数较少;在MS培养基上的外植体生长情况则介于上述2种培养基之间。此外,3种培养基中转化质粒的出芽率差异显著,在添加了细胞分裂素6-BA(3μmol·L-1)条件下,B5培养基中出芽率最高,为(14.79±6.20)%,而在MS和WPM培养基中出芽率分别为(7.68±2.37)%和(4.05±0.64)%。3种培养基中不定芽的诱导情况见表1和图2。
2.2 转基因阳性芽鉴定
通过GUS基因组织染色法和PCR检测对不定芽进行鉴定(见图3),表明已经获得转基因阳性芽,在抗生素草铵膦(0.25 mg·L-1)或卡那霉素(25 mg·L-1)筛选压力下,阳性芽数均占不定芽总数80%以上(见表2),表明本研究所用的遗传转化体系较高效,此外,B5培养基上的比值在90%以上,说明B5培养基适合不定芽的诱导和再生培养。
表2 3种培养基中阳性芽获得情况

培养基转化质粒平均出芽数/个平均阳性芽数/个平均(阳性芽数/出芽数)/%B5A403794.16±0.81B211990.26±0.77MSA171586.67±1.17B151284.13±2.94WPMA7685.52±1.71B8787.04±2.62
注:A代表pGM 626-Act1-EuDIR3;B代表pSH 737-35S-EuDIR1。
2.3 3种培养基对阳性芽生根影响
本研究发现,3种培养基对杜仲遗传转化的生根率具有不同的影响。在添加相同生长素NAA(1μmol·L-1)和抗生素条件下,通过对阳性芽进行生根诱导培养,发现3种培养基中的生根率存在差异,B5培养基适于不定芽诱导,但却不利于生根,WPM培养基上的生根率达到53.85%,远高于另外2种培养基。3种培养基对杜仲阳性芽生根的诱导情况见表3。
表3 3种培养基中阳性芽生根情况

培养基总阳性芽数/个总生根数/个总生根率/%B516863.57MS8200WPM392153.85
3 讨 论
杜仲是我国特有的名贵树种,具有重要的经济价值。作为木本植物,杜仲遗传转化体系的建立比较困难,导致杜仲功能基因的研究相对滞后。影响杜仲遗传转化的因素主要有筛选压、激素浓度、菌液浓度、浸染时间和共培养时间等,提高转基因幼苗的再生率可以获得更高的转化效率[20]。本实验室前期研究发现,对种子切割方式、光照强度、共培养时间和转化过程中的激素浓度等条件进行优化,可以提高杜仲遗传转化效率,现已初步建立了一套杜仲遗传转化体系[18,20],然而在遗传转化过程中,愈伤组织再生的不定芽数量仍较少,且难以生根,严重降低了遗传转化效率。夏启中等研究指出,不同培养基质在杜仲离体培养过程中对愈伤组织的分化和再生有不同的影响[14],由此推测培养基质对杜仲遗传转化同样具有较大影响。植物组织培养过程中的基本培养基有B5、MS、WPM、H和White等[15],其中,B5培养基中的铵盐浓度较低[25],利于提高遗传转化过程中愈伤组织的诱导率和分化率;WPM为低盐培养基,其培养基中的硝态氮和氨态氮比值相对较高[26],利于阳性芽根原基的形成及发育;而MS培养基中的营养元素种类齐全且比例合适,属于富集元素平衡培养基,对根和芽的诱导效果适中[16,27],目前是杜仲组织培养过程中最常用的培养基。本研究发现,3种基质中,B5培养基的确可以促进杜仲不定芽再生,获得较高的出芽率,而相较于另外2种培养基,WPM培养基则具有明显的生根优势。本研究通过筛选基本培养基来对杜仲遗传转化幼苗再生体系进行改良,确定了以B5培养基(含3μmol·L-16-BA和3μmol·L-12-IP)促进不定芽再生以及WPM培养基(含1μmol·L-1NAA)诱导生根的联合使用条件对杜仲遗传转化的外植体进行培养,从而有效地提高了杜仲遗传转化幼苗数量,进一步为后续杜仲功能基因的研究提供转基因材料。
本研究在对杜仲进行遗传转化时,采用2种含不同启动子和筛选标记的表达载体,以期检测培养基质的适用性。研究发现,2种载体虽然在不定芽的诱导上存在数量差异,但其在不同培养基质中有一致的生长趋势,由此认为本研究所获得的优化体系对不同载体均可适用。实验中不定芽诱导数量上存在的差异可能是由于卡那霉素相较于草铵膦对不定芽的诱导有更明显的抑制作用。因此,在构建杜仲遗传转化载体时,宜选择含草铵膦筛选标记的载体。综上所述,本研究对杜仲转基因再生体系进行了优化,进一步保证了转基因杜仲幼苗的获得率及存活率,为后续杜仲功能基因的研究提供了技术支持。
