CaN/NFATc1通路与骨癌痛发生机制的研究进展*
2019-06-29崔文静倪佳艳综述王菊勇审校
崔文静,倪佳艳 综述,王菊勇 审校
200032 上海,上海中医药大学附属龙华医院 肿瘤科
癌性疼痛是肿瘤患者最为常见的临床症状之一,大量临床数据表明, 50%以上恶性肿瘤患者在疾病进展过程中出现骨转移并引起疼痛[1]。严重者导致病理性骨折、截瘫等,使患者生活质量和生存率下降[2]。如何有效缓解癌性疼痛已经成为抗肿瘤治疗中亟待处理的问题[3]。近期研究[4-5]发现钙调神经磷酸酶(calcineurin,CaN)/活化T细胞核因子(nuclear factor-activated T cell,NFATc)1通路在骨癌痛发生发展中有重要作用。本文就CaN/NFATc1信号通路的最新研究进展进行简要综述,为今后骨癌痛的精准治疗寻求新的突破口。
1 CaN/NFATc1通路的概述
CaN也称钙调神经磷酸酶,是目前唯一已知的细胞内钙调素依赖性丝氨酸/苏氨酸蛋白磷酸酶,主要以催化磷脂酰丝氨酸和磷脂酰苏氨酸的脱磷酸化为主[6-7],靶向作用于NFAT转录因子[8]。CaN是由一个结合钙调素(calmodulin,CaM)的催化亚单位(CnA)和一个结合Ca2+的调节亚单位(CnB)1:1比例紧密结合而成的异源二聚体。其中,CnA是全酶催化以及调节的核心,由521个氨基酸组成,分子量为60kD,含有催化区域、CnB结合域、自身抑制域、钙调素结合域四个区域。CnB由168个氨基酸组成,分子量为19kD,与CaM有30%~50%的序列同源性[9-10]。虽然CaN与Ca2+结合部位存在于CnB,但是Ca2+介导的信号传导需要Ca2+/CaM先结合到CaNA的调节区域,在两者共同刺激下,CaN能够使细胞浆中的NFAT脱磷酸化,引起NFAT向核内转位以及完成后续的转录活动[11]。
NFAT是T细胞中主要的转录调节因子,它的失调可能导致肿瘤的发生。NFAT有5个成员:NFAT1(NFATc2)、NFAT2(NFATc1)、NFAT3(NFATc4)、NFAT4(NFATc3)和NFAT5[12-14]。其中,NFATc1是人破骨细胞分化中起主要作用的诱导调控因子[15]。人类和小鼠的NFATc1均为全长约150kb的转录DNA。NFATc1是破骨细胞分化过程中的重要转录因子,其N-末端结构域结合CaN去磷酸化而介导NFAT核转位,C-末端与DNA序列特异结合并和激活子蛋白1(AP-1)共同发挥作用;其C-末端还包含了一个20kDa大小的残基416-591(NFATc1-DBD)也可以特异结合DNA。NFATc1活化有三步:脱磷酸、核易位、提高DNA亲和力[16]。静息状态下NFATc1以高度磷酸化、无活性状态存在于细胞质中。激活后从细胞质转运进入细胞核,并转录出破骨细胞相关的特异性基因[抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP),组织蛋白酶K(cathepsin K,CTSK)和基质金属蛋白酶-9(matrixmetallopeptidase 9,MMP-9)][17]。综上可知,NFATc1在破骨细胞的分化中具有重要作用。
生理骨代谢时,破骨细胞(osteoclast, OC)是主要骨吸收细胞,清除旧骨的矿物质;成骨细胞(osteoblast, OB)是骨生成细胞,先形成类骨,然后矿化形成新骨[18]。两者共同维持骨骼更新与生长,保持骨骼硬度与韧性[19]。当癌细胞转移到骨髓时,癌细胞释放的甲状旁腺激素相关肽可以生成核因子-κB受体活化因子配体(receptor activator of nuclear factor kappa-B ligand,RANKL)[20],RANKL与OPG竞争性结合核因子-κB受体活化因子(receptor activator of nuclear factor kappa-B,RANK),激活下游NFATc1等细胞因子,最终导致OC的增生、活化和肥大。OC重吸收骨质使骨质微环境酸中毒,活化后的OC对痛觉敏化起关键作用[21],同时又有骨质破坏和癌细胞直接侵袭神经产生疼痛,并且这促使肿瘤细胞刺激感觉神经加重骨癌痛(图1)。
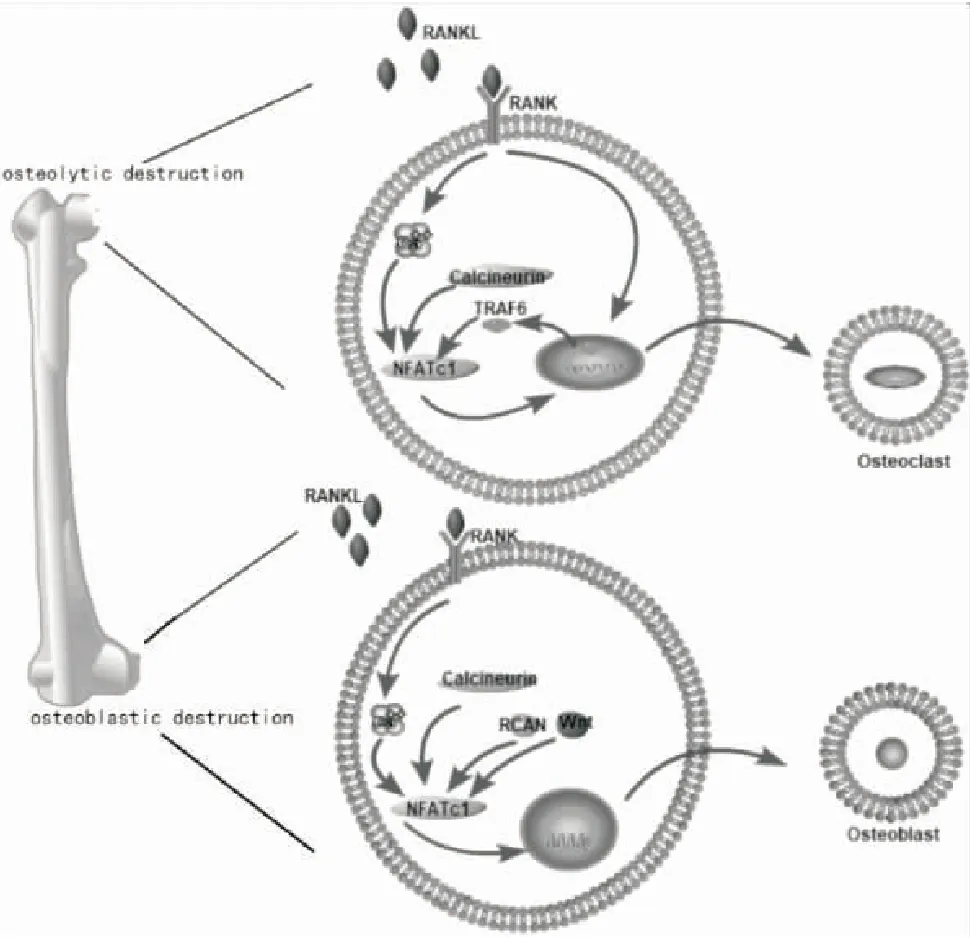
图1 骨癌痛信号通路图
Figure 1. Signaling Pathway in Cancer Induced Bone Pain
Osteolytic destruction:RANKL binds to RANK and Tumor necrosis factor receptor associated factor 6 in the cytoplasm to form a complex, and then targets NFATc1 to initiate osteoclast adhesion and differentiation.When Ca2+increases, CaN and Ca2+bind to form a complex which combined with NFATc1 and dephosphorylates it. NFATc1 enters the nucleus and binds to DNA, induces gene transcription of osteoclasts, and makes osteoclast precursor cells mature osteoclasts.Osteoblastic destruction:CaN dephosphorylates NFATc1, translocates the nucleus and transcripts NFAT. Overexpression of RCAN in osteoblasts synergizes with Wnt signal to differentiate osteoblasts, and induces proliferation and differentiation of osteoblasts with some factors.
2 CaN/NFATc1通路在癌症骨转移引发骨癌痛中的作用机制
NFAT可以促进肿瘤转移,在三阴性乳腺癌、肝癌、前列腺癌、非小细胞肺癌肿瘤组织中发现NFATc1过表达,体内体外实验证实Ca2+/CaN/NFATc1信号通路参与了乳腺癌细胞的侵袭和转移[22]。肿瘤的骨转移类型分为:溶骨型、成骨型和处于二者之间的混合型,前期研究中CaN/NFATc1信号通路与溶骨型、成骨型关系最为密切[23],转移到骨后的癌细胞导致骨骼结构改变,并引起疼痛。
2.1 CaN/NFATc1通路与溶骨性骨肿瘤疼痛
溶骨性骨转移引起的疼痛是最为常见的一种骨癌痛类型,在溶骨性骨转移发生过程中,肿瘤细胞分泌各种促进OC分化、增殖的可溶性因子,与骨细胞和骨基质构成相互调节的复杂网络,进而促使溶骨性骨转移发生,其产生的相关蛋白又促进肿瘤细胞的生长和生存,形成“恶性循环”[24]。在这一过程中,RANKL与RANK结合后将肿瘤坏死因子受体相关胞浆因子6转移到胞质区,与RANK/RANKL结合为复合体,最终作用于NFATc1等细胞核转录调控因子,而NFATc1可调控诸多基因表达,启动OC黏附和分化[25-26]。另一方面,在细胞内游离Ca2+增加时,CaN与Ca2+结合形成复合物后与NFATc1结合并使其去磷酸化,NFATc1在受体作用下转运入核与DNA结合,也可诱导OC特异性基因转录[27],从而使破骨前体细胞分化为成熟OC,成熟OC活化后可重吸收骨质,使骨髓微环境处于酸性状态中,骨髓微环境的改变促使骨癌痛痛觉敏化,同时增生活化的OC对骨的侵袭,形成骨质破坏发生微小骨折,这又引起骨膜表面的伤害性感觉神经元和神经支配,引发并加重疼痛[28]。
2.2 CaN/NFATc1通路与成骨性骨肿瘤疼痛
成骨性骨转移肿瘤与其它类型相比生长较慢,少或无溶骨性骨破坏,不易引起病理性骨折[29],但患者也会表现出持续性疼痛。CaN可引起NFATc1脱磷酸化,核内转位,提高NFAT转录[12],钙调神经磷酸酶调节因子在破骨前体细胞中过度表达减弱OC分化,而在OB细胞中过度表达,促进OB的分化[30]。有研究发现NFATc1在增生的OB中大量表达,并协同Wnt信号表达实现OB的增殖[31]。以常见的前列腺癌骨转移为例,转移后的肿瘤细胞产生成纤维生长因子及CXCR4、基质金属蛋白酶、内皮素-1与DKK-1(Dickkopf related protein 1)、骨形态发生蛋白质类等因子,引起骨细胞增殖、分化和骨形成[32];在此过程中先是OC破坏骨表面,为OB生成肿瘤提供合适条件,骨质非正常的溶解和生长可发生压迫在此骨组织造成缺血坏死、病理性骨折和高钙血症,引起疼痛感[33],成骨性骨转移与溶骨性骨转移的不同之处在于骨组织微环境所释放的细胞因子,成骨性骨转移释放的细胞因子主要是促成骨形成,但最终都导致骨破坏,引起疼痛。
3 CaN/NFATc1信号通路与骨癌痛治疗
CIBP的治疗由单纯三阶梯止痛到联合或交替应用镇痛药物[34],止痛方法的进步仍旧无法实现完全止痛。靶向疗法在癌症治疗中的广泛应用启示临床医生与研究人员,虽然溶骨性骨转移和成骨性骨转移引起的疼痛有其独特的发展机制,但靶向抑制CaN/NFATc1基因表达是治疗各类骨癌痛的思路之一。目前的骨癌痛治疗研究中发现,唑来膦酸通过下调NFATc1的蛋白及其mRNA分子水平治疗骨癌痛[35]。金丝桃素是环烷类化合物,有研究证实金丝桃素可抑制NFATc1信号通路,减少Ca2+震荡,作用于OC能抑制乳腺癌的侵袭和转移并预防骨转移导致骨破坏的发生,避免因骨质破坏引发的疼痛[36]。Src激酶是一种非受体蛋白酪氨酸激酶,参与了癌细胞生长、OC降解及信号传导,达沙替尼是Src激酶抑制剂,可延缓骨癌痛大鼠模型疼痛[37]。有研究证实淫羊藿中淫羊藿次苷Ⅰ及代谢产物淫羊藿次苷Ⅱ在体内外均能通过抑制c-Fos蛋白调控NFATc1基因表达,抑制OC生成以达到预防OC对骨的侵蚀作用,这对治疗骨癌痛新药开发有重要意义[38]。锌是一种重要微量元素,Park等[39]发现锌可作用于Ca2+-CaN-NFATc1信号通路抑制OC分化,因此锌或可作为由NFATc1激活引起的骨质疾病的预选治疗药。马齿苋是中药常见的清热解毒药,但有研究发现马齿苋可以抑制RANKL信号传导以诱导c-fos和NFATc1表达水平下调,对骨溶解动物模型有保护作用[40]。无论是现代医学靶向药,还是中医药中单味药提取物或中药复方,对CaN/NFATc1通路的作用是探索骨癌痛治疗的开端,运用药物靶向CaN/NFATc1通路调控基因表达,抑制OB、OC异常增殖是治疗骨癌痛的思路之一。
4 总结与展望
骨癌痛是一种具有炎症性疼痛和神经性疼痛的复杂的慢性疼痛[41],严重影响癌症患者的生活,目前镇痛方法主要是局部放疗、双磷酸盐及三阶梯镇痛法, 但尚缺乏更精准的靶向治疗。现代医学的靶向治疗是更精准的治疗方法[42],对CaN/NFATc1信号通路的研究是治疗骨癌痛的理论依据,如何通过这一通路减少患者的疼痛的发生,并减轻治疗的副作用是我们思考的问题。本课题组正在探索中药外用通络散结凝胶治疗骨癌痛大鼠OPG/RANKL/RANK通路的机制,并将进一步探讨外治法对CaN/NFATc1通路的调控作用,为骨癌痛治疗提供新思路。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
猜你喜欢
杂志排行
肿瘤预防与治疗的其它文章
- 基于公共数据库分析脯氨酸羟化酶3在非小细胞肺癌中的表达及预后价值
- 肿瘤体积及瘤体缩减率在同步放化疗的宫颈癌患者预后中的价值*
- ADC值评估早期宫颈癌淋巴管侵犯的价值*
- 中性粒细胞/淋巴细胞比值对早期原发乳腺弥漫大B细胞淋巴瘤的临床特征及预后的影响*
- 1989~2014年中国胃癌发病率与统计年鉴指标的相关性分析*
- Clinical Benefit of Epidermal Growth Factor Receptor-Tyrosine Kinase Inhibitors Plus Radiotherapy for Epidermal Growth Factor Receptor-Mutated Metastatic Non-Small Cell Lung Cancer: A Retrospective Analysis on Real World Data
