血清巨噬细胞迁移抑制因子和白细胞介素10水平与重症脓毒症患者生存时间的相关性
2019-06-28许玉环马琴琴
陈 琛,苏 华,许玉环,马琴琴
(河北北方学院附属第一医院:1.重症医学科;2.检验科,河北张家口 075000)
脓毒症是指由感染引起的全身炎症反应综合征,是住院患者死亡的主要原因之一[1]。早期全身炎症反应综合征(SIRS)的特征在于促炎介质的表达,其后是发展代偿性抗炎症反应综合征(CARS)[2-3]。研究表明,促炎介质的表达可能引发一系列早期反应从而导致早期死亡[4-5]。巨噬细胞迁移抑制因子(MIF)是全身性炎性反应的一种重要调节因素,其过表达可能导致严重脓毒症的早期死亡[6-8]。此外,小鼠模型实验显示白细胞介素-10(IL-10)在感染后12 h内达到峰值,表明早期IL-10水平升高也可能是造成机体炎性反应不足和控制感染失败的原因[9]。本研究通过比较不同生存时间的两组严重脓毒症患者的血清MIF和IL-10水平,探讨血清MIF和IL-10水平与严重脓毒症患者生存时间的相关性,现报道如下。
1 资料与方法
1.1一般资料 连续收集2015年7月至2017年7月于本院住院接受治疗的135例重症脓毒症患者入组。入选标准:(1)根据脓毒症国际诊断标准[10],被确诊为脓毒症患者;(2)年龄大于18岁,精神状况良好;(3)患者生存时间小于72 h或大于30 d。排除标准:(1)不愿参与本研究的患者;(2)不能进行正常交流的患者。本研究已获得所有研究对象的知情同意,并获得医院伦理委员会批准。根据患者生存时间将其分为A、B两组,A组生存时间小于72 h,B组生存时间大于30 d;其中A组15例,男8例,女7例,B组120例,男65例,女55例。记录患者的性别、年龄和心血管功能障碍(收缩压<90 mm Hg,平均动脉压<65 mm Hg,或收缩压降低> 40 mm Hg)、呼吸系统障碍(双侧肺部浸润,动脉氧分压与吸入氧分量之比<300 mm Hg)、肾功能损害[血清肌酐水平>2 mg/dL或尿量持续2 h<0.5 mL/(kg·h)]、肝功能损害(总血清胆红素水平>2 mg/dL)、乳酸代谢障碍(血清乳酸水平>2 mmol/L)和血液功能障碍(血小板计数<100×109/L)等信息。
1.2方法 收集所有患者清晨空腹血样,将血液收集在无菌试管中,离心并将血清分装到Eppendorf管中并在-70 ℃储存直至分析。血清MIF和IL-10水平采用酶联免疫吸附(ELISA)试剂盒(MIF:RayBiotech,Norcross,GA,USA;IL-10:Biolegend,San Diego,CA,USA)测定。

2 结 果
2.1两组一般资料对比 本研究两组的一般资料见表1。两组间性别、年龄、呼吸功能障碍和肾、肝功能损害情况差异无统计学意义(P>0.05);而在心血管功能障碍、乳酸代谢障碍和血液功能障碍3方面差异有统计学意义(P<0.05)。

表1 两组一般资料对比
2.22组血清MIF和IL-10水平比较 A组血清MIF和IL-10水平分别为(7 633±658)和(883±312)pg/mL,B组血清MIF和IL-10水平分别为(2 598±764)和(583±276)pg/mL;A组的血清MIF和IL-10水平均显著高于B组,差异有统计学意义(P<0.05)。见表2。
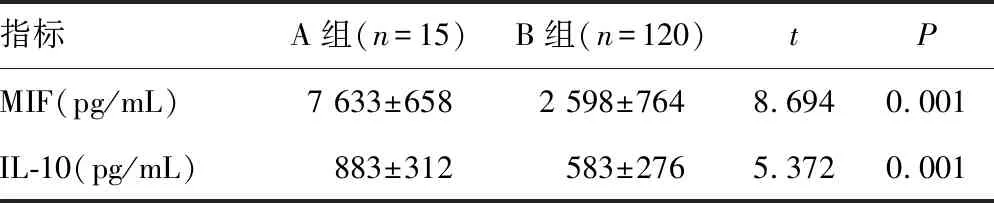
表2 2组巨噬细胞迁移抑制因子和IL-10
2.3单因素分析 单因素分析显示心血管功能、乳酸代谢和血液功能障碍,以及MIF和IL-10水平升高均为脓毒症死亡风险因素(P<0.05)。见表3。

表3 脓毒症死亡风险的单因素分析
2.4多因素分析 将单因素分析中显著的变量纳入多因素分析,结果显示心血管功能、乳酸代谢和血液功能障碍,以及MIF和IL-10水平升高均为脓毒症死亡风险因素(P<0.05)。

表4 脓毒症死亡风险的多因素分析
3 讨 论
一般来讲,脓毒症的两阶段模型由最初的促炎阶段和随后的抗炎阶段组成。而本研究表明,在患有严重脓毒症的患者中同时发生促炎细胞因子和抗炎细胞因子如MIF和IL-10水平升高的现象,这与TAMAYO等[11]和CHUANG等[12]的研究结果类似,表明严重脓毒症的早期阶段同时存在促炎和抗炎反应。早期研究报道IL-10与严重脓毒症患者48、72 h、15、28 d病死率有显著相关性[13]。而在最近发表的使用细胞因子多重分析的研究中,IL-10并不是48 h死亡率的预测因子,但它是28 d死亡率的显著预测因子[14]。然而,本研究表明IL-10水平升高与72 h死亡风险显著相关,与上述结果不同,推测可能有以下原因:(1)患者的来源不同,同时各项研究的方法以及质控标准不同;(2)采集血样的时间不同,可能导致血清因子测定的水平差异;(3)测量细胞因子水平的方法不同。这些都可能导致不同研究间的差异性。
高MIF水平和肾上腺不良反应与严重脓毒症患者的早期死亡有关[15-16]。本结果表明,MIF水平升高是严重脓毒症患者死亡风险的独立风险因素之一。结合以前的研究结果,表明脓毒症两阶段模型中初始均会发生促炎阶段。此外,在脓毒症大鼠模型中腹膜内注射重组MIF会诱导弥散性血管内凝血(DIC),而在DIC脓毒症患者中也发现持续的MIF水平升高及可溶性纤维蛋白和低蛋白C活性增强[17]。因此,推测MIF和蛋白C活性水平之间存在显著负相关,而该相关性可能参与脓毒症患者快速死亡结局,但这仍需要在未来的工作中进一步探索。
IL-10是由多种类型细胞分泌的有效内源性免疫抑制剂细胞因子,包括T辅助(Th)2细胞、单核细胞、巨噬细胞、树突细胞和上皮细胞。它抑制Th1促炎性细胞因子,包括干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、IL-1b、IL-8、IL-12和IL-21。MIF是全身炎性反应的关键介质,由垂体前叶和免疫细胞分泌,主要是T细胞。它刺激促炎细胞因子包括TNF-α、IFN-g、IL-1b、IL-6、IL-8和IL-22的表达和分泌。本研究结果证实,由于严重脓毒症而在72 h内死亡的患者具有显著的MIF和IL-10水平升高现象。下一步研究将聚焦于Th1细胞分泌的促炎性细胞因子是否在严重脓毒症患者的高MIF和IL-10水平的双重作用下产生。此外,笔者也将探讨Th1/Th2细胞在严重脓毒症患者中的差异表达谱。
4 结 论
本研究表明MIF和IL-10水平升高是重症脓毒症患者快速死亡的风险因素。而MIF和IL-10的自发表达是否影响严重脓毒症患者中Th1/Th2相关细胞因子的表达,从而形成不同结局,值得进一步研究。
