福建省福清地区马铃薯病毒病病原的分子检测
2019-06-27杨小龙陈细红蔡伟
杨小龙 陈细红 蔡伟

摘要 2017年调查福建福清地区马铃薯病毒病的发生情况,以明确该地区马铃薯主要病毒病原。共采集了46份疑似感染病毒的马铃薯植株,提取总RNA,利用RTPCR技术进行分子检测,结果表明,福清地区危害马铃薯的病毒有马铃薯Y病毒Potato virus Y(PVY)、马铃薯卷叶病毒Potato leaf roll virus(PLRV)、马铃薯S病毒Potato virus S(PVS),检出率分别为56.52%、17.39%和10.87%,以PVY检出率最高,说明PVY是危害该地区马铃薯样品的主要病毒病原。通过病毒复合侵染进行分析,发现该地区存在病毒复合侵染马铃薯现象。研究结果可为福清地区马铃薯种薯的引进和病毒病害防治提供参考依据。
关键词 福清地区; 马铃薯病毒; RTPCR; 检测与鉴定
中图分类号: S 435.32
文献标识码: ADOI: 10.16688/j.zwbh.2018095
Abstract The aim of this study is to investigate the occurrence of potato viruses in Fuqing area, Fujian province, and to diagnose the main viruses causing major diseases. In 2017, 46 infected potato plant samples were collected from Fuqing area, and the total RNA was extracted from the infected potato leaves. From these samples, PVY, PLRV and PVS were detected via the conventional RTPCR techniques, and the detection rates were 56.52%, 17.39% and 10.87%, respectively, while other viruses were not detected. The analysis of complex infection showed that complex infection existed in potato plants in this area. This study can provide reference for the introduction of seed potato and the management strategy of virus diseases control in Fuqing area.
Key words Fuqing area; potato virus; RTPCR; detection and identification
马铃薯Solanum tuberosum L.是茄科茄属一年生草本植物,起源于南美洲安第斯山地区,是一种兼具营养价值和药用价值的食用块茎作物[1]。马铃薯用途广泛,既可以食用,也可以作为工业原料,具有较高的经济价值,是世界四大粮食作物之一,与小麦、水稻、玉米、高粱并称为世界五大作物。马铃薯在我国种植范围广,2007年我国马铃薯种植面积和总产量均排世界第一[2]。随着马铃薯种植面积不断扩大,马铃薯受病毒病危害也愈发严重。马铃薯病毒病是引起马铃薯品种退化的主要原因,已经成为马铃薯上重要的病害之一,严重影响马铃薯的产量和质量,一般使马铃薯减产20%~50%,危害严重时可达80%以上,严重制约了马铃薯的生产[3],给农业经济造成巨大的损失。目前,国内外已报道的可侵染马铃薯的病毒有近40种,类病毒1种[4]。我国常见的、并且危害比较严重的有马铃薯Y病毒Potato virus Y(PVY)、马铃薯X病毒Potato virus X(PVX)、马铃薯卷叶病毒Potato leaf roll virus(PLRV)、马铃薯S病毒Potato virus S(PVS)以及马铃薯M病毒Potato virus M(PVM)[57]。PVY是感染马铃薯的重要病毒之一,也是分布最为广泛的病毒,几乎所有马铃薯种植区都有该病毒。通常马铃薯感染PVY后会减产20%~40%,若同时还感染PLRV,PVX,马铃薯纺锤形块茎类病毒Potato spindle tuber viroid (PSTVd)等病毒及类病毒,其减产可达60%~80%[89]。目前,PVY全基因组结构分析与分子变异的情况是其主要的研究方向。高芳銮等[10]对中国14个省采集的马铃薯Y病毒CP基因分子变异进行了研究。PLRV广泛分布于马铃薯种植区,可通过种薯、蚜虫等方式进行传播,其单独侵染可导致马铃薯减产30%~90%,与其他病毒复合侵染可致绝收[11]。PSTVd是危害马铃薯的重要类病毒,也是第一个被发现的类病毒。PSTVd 导致马铃薯品质急剧退化,马铃薯严重减产[12]。此外,世界已报道的感染马铃薯的病毒还有安第斯马铃薯潜隐病毒 Andean potato latent virus(APLV)、马铃薯黄矮病毒Potato yellow dwarf virus(PYDV)、马铃薯帚顶病毒Potato mop top virus (PMTV)、马铃薯V病毒potato virus V(PVV)、苜蓿花叶病毒Alfalfa mosaic virus(AMV)和烟草脆裂病毒Tobacco rattle virus(TRV)等。
對病毒病的防治目前尚无有效药剂,现阶段主要以预防为主,高效可靠的病毒检测是预防的重要前提[13]。目前广泛应用于马铃薯病毒检测的方法主要有血清学方法和分子生物学方法[14],其中以反转录聚合酶链式反应(reverse transcriptionPCR, RTPCR)技术最为成熟,并越来越多地应用于马铃薯病毒检测上。聂峰杰等[15]应用RTPCR技术对宁夏马铃薯脱毒种薯进行了病毒检测。Kumar等[16]应用多重RTPCR同时检测侵染马铃薯的5种病毒。沈林林等[17]采用多基因联合方法对福清产区马铃薯Y病毒株系组成进行鉴定。福建省马铃薯的种植面积和产量占全国比例较少,福清地区作为福建省马铃薯重要的种植生产区,属于中国马铃薯南方冬作区,近年来,福清地区马铃薯受病毒病的危害日益加剧,给马铃薯的产量和质量带来了严重的影响,因此,明确福清地区马铃薯病毒病发生情况和病毒种类,对福清地区马铃薯病毒病的防控具有重要意义。目前还没有该地区侵染马铃薯的主要病毒种类的相关研究报道。本研究利用常规反转录聚合酶链式反应(RTPCR)对福清地区马铃薯进行病毒的检测,明确了该地区马铃薯病毒病发生情况和病毒种类,为福清地区马铃薯种薯的引进和病毒病害防治提供参考依据,为促进该地区马铃薯种薯产业发展提供技术支持。
1 材料与方法
1.1 材料
2017年,在福建省福清地区采集花叶、斑点、褪绿、卷叶皱缩、黄化、小叶黑点等疑似感病的马铃薯样品46份,对其编号后立即储存于-80℃的冰箱里备用。
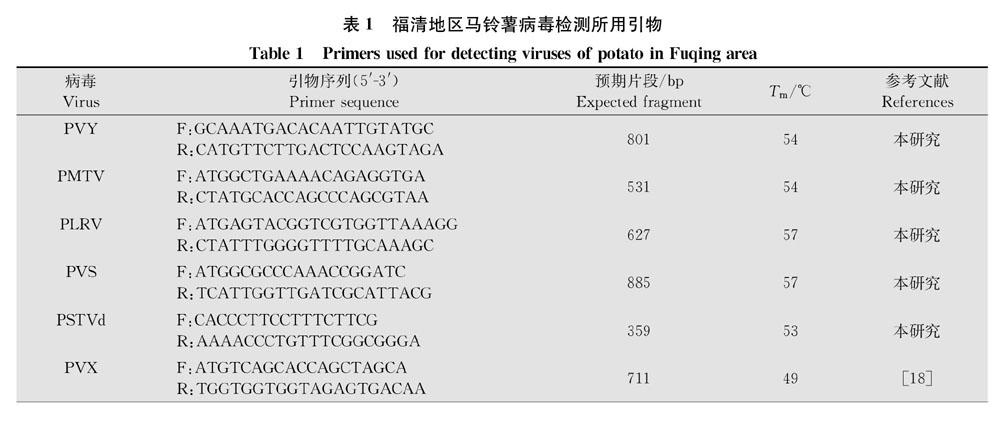
TransZol Up Plus RNA提取试剂盒购自北京全式金生物技术有限公司,MMLV反转录酶、抑制酶和2×Green Master Mix购自Promega公司,其他生化试剂均为分析纯;所有特异性引物由上海生物工程有限公司合成(表1)。
1.2 总RNA提取和cDNA的合成
采用TransZol Up Plus RNA 提取试剂盒提取RNA。提取前,预先配制好需要加入无水乙醇的试剂,称取鲜重为0.1 g的马铃薯叶片,加液氮研磨呈粉状,再根据试剂盒说明书操作,最后将得到的总RNA立即保存于-80℃冰箱。
将提取的RNA反转录合成cDNA。向PCR反应管中分别加入样品总RNA 3 μL,随机引物1 μL,ddH2O 7 μL,72℃ 10 min,冰上5 min。继续分别加入MMLV RT 5×buffer 5 μL,10 mmol/L dNTP Mix 2 μL,MMLV Reverse Transcriptase 1 μL,RNase Inhibitor 1 μL,42℃ 1 h,72℃ 10 min,-20℃备用。
1.3 PCR扩增及凝胶电泳
马铃薯样品PCR扩增体系:2×Green Master Mix 12.5 μL,上游引物1 μL,下游引物 1 μL,cDNA 2 μL,补足ddH2O 到25 μL。PCR反应条件:94℃ 3 min;94℃ 30 s,退火 45 s(各引物的退火温度见表1),72℃ 1 min,共35 个循环;最后,72℃ 10 min。PCR扩增结束后,取5 μL PCR产物,用1.5%琼脂糖凝胶进行电泳检测。在120 V恒压条件下电泳25 min后,在凝胶成像系统上查看结果并保存。
1.4 PCR产物克隆、测序及序列分析
将PCR扩增产物回收纯化、克隆后,送上海生工生物工程技术服务有限公司测序,利用BLAST对克隆后测定的序列进行相似序列的比较分析。
2 结果与分析
2.1 福清地区侵染马铃薯的病毒种类
2.1.1 PVY的检测结果
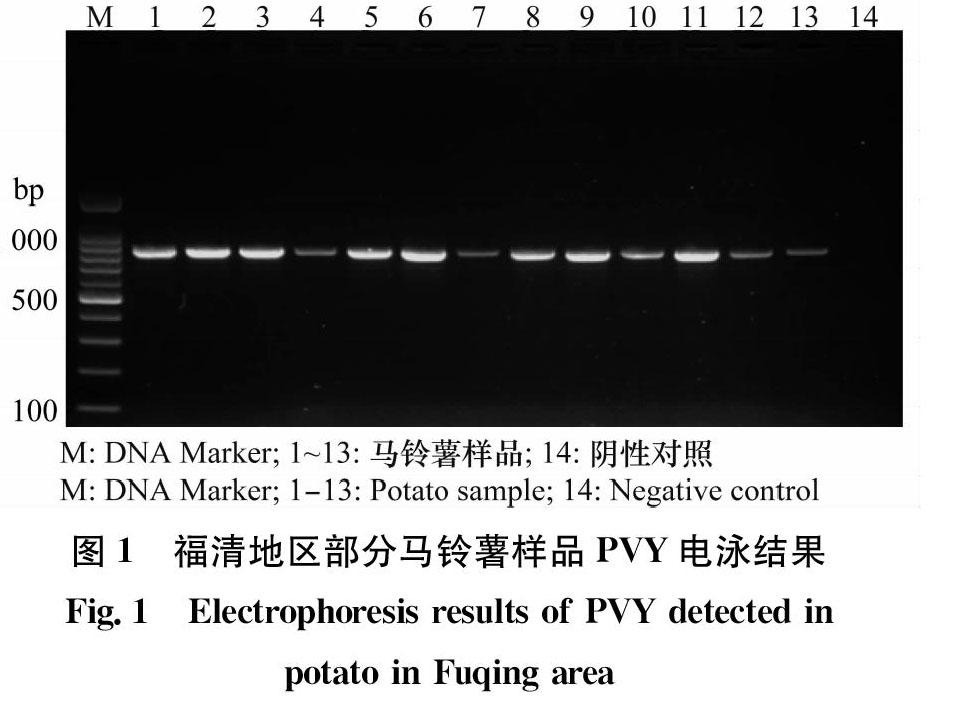
采用PVY特异性引物(表1)从46份样品中,总共检测出26份样品感染了PVY病毒,其中部分样品电泳结果如图1所示。结果显示,阳性样品扩增出长度为801 bp的目的条带,阴性(健康马铃薯叶片)对照未扩增到相应的片段。
2.1.2 PLRV的检测结果
该地区采集的46份马铃薯样品中,共8份样品出现了PLRV特异性扩增条带(图2),长度为627 bp,且与预期片段大小一致,而阴性对照未出现任何扩增条带。
2.1.3 PVS的检测结果
利用PVS特异性引物对福建省福清地区的采集的46份马铃薯疑似带毒样品进行RTPCR扩增,共5份扩增产物在1.5%琼脂糖凝胶电泳呈阳性条带(图3),与预期片段885 bp相一致,而阴性对照未出现任何扩增条带。
2.2 PCR产物的克隆和测序结果
将马铃薯Y病毒(PVY)、马铃薯卷叶病毒(PLRV)、马铃薯S病毒(PVS)阳性样品的PCR扩增产物,进行克隆、测序和序列分析,结果表明,从PVY阳性样品中获得801 bp的目的片段,其核苷酸序列与已报道的PVY分离物(GU07400)CP核苷酸序列同源性为99.5%;从PLRV阳性样品上获得627 bp的目的片段,其核苷酸序列与已报道的PLRV分离物(FJ859023)CP基因序列同源性为99.8%;从PVS阳性样品上获得885 bp的目的片段,其核苷酸序列与已报道的PVS分离物(Y15625)CP基因序列同源性为95.3%。序列分析结果证实,PVY、PLRV和PVS阳性样品中扩增到的目的片段与已报道的各病毒CP核苷酸序列高度同源,进一步验证了3种病毒扩增产物的特异性。
2.3 病毒检出率
对福建省福清地区采集的46个马铃薯样品检测结果进行统计,结果(表2)表明,PVY、PLRV、PVS检出率分别为56.52%、17.39%和10.87%,以PVY检出率最高,说明PVY是危害该地区马铃薯的主要病毒病原。此外,检测结果表明,福清地区马铃薯病毒存在复合侵染,主要为PVY和PLRV复合侵染,复合侵染率为4.35%。
3 结论与讨论
福清市位于福建省东南沿海一带,是福建省马铃薯主要种植生产区之一。近年来,福清地区马铃薯受病毒病的危害日益严重,给该地区马铃薯生产造成了巨大的经济损失。目前,关于福清地区马铃薯主要病毒种类尚未见调查研究报道。近年来国内外已报道的侵染马铃薯的病毒及类病毒超过40种,其中在我国危害比较严重的有PVY、PVX、PVS、PVM、PLRV和PVA。PVA、PYDV、PMTV、PVV、PSTVd 5种病毒被列入我国进境植物检疫性有害生物名录。PMTV在国外研究报道较多,国内较少。该病毒随土壤中的马铃薯粉痂菌Spongospora subterranea进行传播,病毒在粉痂菌休眠孢子内部至少可存活2年,在生产实践中难以发现该病毒。PSTVd是唯一被發现侵染马铃薯的类病毒,其寄主范围广。PSTVd引起的病害发现于1922年,但直到1967年及以后的研究中才逐渐认识引起该病害的病原[25]。本研究利用常规RTPCR技术对福清地区疑似感病的马铃薯样品进行主要病毒种类的检测鉴定。结果在该地区检出PVY、PLRV和PVS,其检出率分别为56.52%、17.39%和10.87%。其中,PVY检出率最高,说明PVY是危害该地区马铃薯的主要病毒。通过对该地区马铃薯病毒复合侵染情况进行分析,发现该地区存在病毒复合侵染现象,以PVY和PLRV复合侵染为主。此外,本研究利用PVA、PYDV、PMTV、PVV和PSTVd 5种病毒特异性引物对福清本地马铃薯样品进行检疫性病毒检测,均未检出这5种检疫性病毒。目前,还没有任何药剂能对马铃薯病毒进行有效防治,现阶段的防治方法主要是脱毒种薯的生产和抗病毒病品种的选育。采用脱毒种薯是预防病毒病最有效的一项措施,现已在马铃薯生产上应用广泛。本研究采用13对特异性引物对福清地区46份马铃薯样品进行病毒病原检测,明确了该地区马铃薯病毒病发生情况和病毒种类,其结果可为福清地区马铃薯脱毒种薯的生产和抗病毒病品种的选育提供保障,同时还可为该地区马铃薯种薯的引进和病毒病害防治提供参考。
参考文献
[1] SALAZAR L F.马铃薯病毒及其防治[M].阎文昭,张勇飞,译.北京:中国农业科学技术出版社,2000.
[2] 张威,白艳菊,高艳玲,等.马铃薯主产区病毒病发生情况调查[J].黑龙江农业科学,2010(4):7173.
[3] 吴丽萍,王蒂,司怀军,等.马铃薯S病毒的RTPCR检测[J].中国马铃薯,2006,20(4):200203.
[4] WANG Biao, MA Yanli, ZHANG Zhibo, et al. Potato viruses in China [J]. Crop Protection, 2011, 30: 11171123.
[5] SOLOMONBLACKBURN R M, BARKER H. Breeding virus resistant potatoes (Solanum tuberosum): a review of traditional and molecular approaches [J]. Heredity, 2001, 86: 1735.
[6] 钟婷婷,蒲志刚,何俊蓉,等.四川省马铃薯主产区最新病毒病普查及血清学鉴定[J].西南农业学报,2008,21(1):9699.
[7] 白艳菊,文景芝,杨明秀,等.西南地区与东北地区马铃薯主要病毒发生比较[J].东北农业大学学报,2007,38(6):733736.
[8] 陈士华,刘晓磊,张晓婷,等.中国部分马铃薯产区马铃薯Y病毒(PVY)的株系分化与鉴定[J].河南农业大学学报,2011,45(5):548551.
[9] 冯光惠,杜虎平,李夏隆,等.陕北地区马铃薯Y病毒的RTPCR检测及其序列分析[J].山西农业科学,2014,42(9):941944.
[10]高芳銮,沈建国,史凤阳,等.中国马铃薯Y病毒的检测鉴定及CP基因的分子变异[J].中国农业科学,2013,46(15):31253133.
[11]冯光惠,杜虎平,李夏隆,等.陕北地区马铃薯卷叶病毒的RTPCR检测与序列分析[J].湖北农业科学,2014,53(19):47344736.
[12]DIENER T O. Potato spindle tuber “virus”. IV. A replicating, low molecular weight RNA [J].Virology, 1971, 45(2):411428.
[13]吴兴泉,陈士华,谢联辉.马铃薯X病毒的分子鉴定与检测技术[J].河南农业科学,2006(2):7275.
[14]杨雪芹,向本春,施磊.马铃薯脱毒及脱毒苗检测技术的研究进展[J].安徽农学通报,2007,13(8):98100.
[15]聂峰杰,詹红,张丽,等.RTPCR技术对宁夏马铃薯脱毒种薯病毒检测的研究[J].植物保护,2016,42(5):188193.
[16]KUMAR R, JEEVALATHA A, BASWARAJ R, et al. A multiplex RTPCR assay for simultaneous detection of five viruses in potato [J]. Journal of Plant Pathology, 2017, 99(1): 3745.
[17]沈林林,邹文超,高芳銮,等.采用多基因联合方法鉴定福建长乐和福清产区马铃薯Y病毒株系组成[J].中国农业科学,2016,49(20):39183926.
[18]张威,白艳菊,范国权,等.应用三重RTPCR技术检测三种马铃薯病毒[J].中国马铃薯,2015(3):162166.
[19]KOENIG R, ZIEBELL H. Sequencemodified primers for the differential RTPCR detection of Andean potato latent and Andean potato mild mosaic viruses in quarantine tests[J]. Archives of Virology, 2014, 159(5): 11691173.
[20]AQSIQ.SN/T 1135.7-2009马铃薯A病毒检疫鉴定方法[S].20090902.
[21]XU Huimin, DAUBIN J, NIE J. Genomic variability in Potato virus M and the development of RTPCR and RFLP procedures for the detection of this virus in seed potatoes [J]. Virology Journal, 2010, 7(1): 25.
[22]AQSIQ.SN/T 1135.10-2013马铃薯V病毒检疫鉴定方法[S].20130830.
[23]文朝慧,南志标.甘肃省张掖地区苜蓿花叶病病原的检测[J].草业学报,2015,24(4):121126.
[24]RIGA E,LARSEN R,EASTWELL K,et al.Rapid detection of tobacco rattle tobravirus in viruliferous Paratrichodorus allius from greenhouse and field specimens [J]. Journal of Nematology,2009,41(1):6063.
[25]李学湛,吕典秋,白艳菊,等.应用NASH方法檢测马铃薯类病毒(PSTVd)[J].中国马铃薯,2001(2):8788.
(责任编辑:杨明丽)
