湘西地区猕猴桃细菌性溃疡病抗性资源筛选及其抗性机理研究
2019-06-27崔丽红高小宁张迪
崔丽红 高小宁 张迪
摘要 由Pseudomonas syringae pv. actinidiae (Psa)引起的潰疡病是猕猴桃生产中威胁最大的细菌性病害。种植抗病品种是防治猕猴桃溃疡病最有效途径,猕猴桃抗源是抗病育种的物质基础。本试验通过离体接种,在室内评价了4个不同种的7个猕猴桃资源及品种对溃疡病的抗性。结果表明:供试材料离体叶片、枝条接种溃疡病菌后,其发病时间、病斑大小、发病率差异明显。按病斑大小排序,其抗性强弱依次为毛花猕猴桃‘M9808>对萼猕猴桃‘S9801>美味猕猴桃‘M06>美味猕猴桃‘米良1号>中华猕猴桃‘Z12>中华猕猴桃‘东红>中华猕猴桃‘红阳(CK)。其中,毛花猕猴桃‘M9808抗病性最强,表现为发病最晚,离体叶片、枝条分别于接种后10 d、20 d发病,比对照推迟了8 d、10 d;病斑最小,为对照的1/25、1/11;发病率最低,为对照的1/28、1/10。抗病性相关酶活性比对发现,不同材料的PAL、CAT、POD酶活性差异较大,抗性材料均高于感病材料,且峰值出现时间早于感病材料。其中,毛花猕猴桃‘M9808的PAL峰值最高,接种后5 d出现,比对照早10 d;CAT、POD峰值接种后10 d出现,比对照早5 d。说明毛花猕猴桃‘M9808对溃疡病抗性最强,可作为今后猕猴桃抗病育种或抗性砧木的理想材料。这为猕猴桃抗病育种提供了理论依据,为猕猴桃溃疡病的防控提供了参考。
关键词 湘西地区; 猕猴桃细菌性溃疡病; 抗性资源
中图分类号: S 435.482.2
文献标识码: ADOI: 10.16688/j.zwbh.2018269
Abstract The bacterial canker caused by Pseudomonas syringae pv. actinidiae(Psa) is the most dangerous disease in the production of kiwifruit. Planting resistant varieties is the most effective way to control kiwifruit canker disease. In this study, we evaluated the resistance of seven kiwifruit resources and varieties by inoculation Psa in detached leaves and shoots. The results showed that the time of lesion appearance, lesion size, and incidence rate were significantly different in the tested materials. The tested kiwifruit resources and varieties were ranked according to the lesions size as follows: Actinidia eriantha ‘M9808>A.valvata ‘S9801>A.chinensis var. deliciosa ‘M06>A.chinensis var. deliciosa ‘Miliang 1>A.chinensis ‘Z12>A.chinensis ‘Donghong>A.chinensis ‘Hongyang(CK). Among these resource varieties, A.eriantha ‘M9808 had the strongest resistance to Psa. The symptoms occurred on the 10th and 20th day after inoculation in detached leaves and shoot respectively, which was delayed by 8 days and 10 days compared with the CK. The lesions were 1/25 and 1/11 and the incidence rates were 1/28 and 1/10 the CK in detached leaves and shoots, respectively. Meanwhile, its enzyme activities of PAL, CAT, and POD were significantly higher in resistant materials than the susceptible materials. Among these tested materials, the PAL activities were the highest and reached the maximum value at 5 days after inoculation in A.eriantha ‘M9808, 10 days ahead of the CK, and the peak of CAT and POD activities appeared at 10 days after inoculation, 5 days ahead of the CK. Therefore, A.eriantha ‘M9808 can be used as an ideal material for resistance breeding or resistant rootstock of kiwifruit.
Key words Xiangxi area; kiwifruit bacterial canker; resistance resource
猕猴桃细菌性溃疡病是由丁香假单胞菌猕猴桃致病变种Pseudomonas syringae pv. actinidiae (Psa)引起的毁灭性病害。自1984年在日本被发现[1]以来,现已有很多国家陆续发现该病,如意大利[2]、法国[3]、新西兰[4]等。我国1985年首次在湖南东山峰农场发现,3年间就致使该农场栽培的约133.3 hm2猕猴桃果园被毁[5]。此后该病连年发生,全国很多猕猴桃产区感染此病,损失严重。2015年湘西永顺、凤凰猕猴桃主栽区 ‘红阳果园发病率高达95.32%[6]。2016年重庆5个猕猴桃主要生产区中,‘红阳果园发病最重,有的果园发病率高达100%[7]。2017年四川14个猕猴桃主产区中,溃疡病发病面积占种植面积的26%[8]。
植物抗病性是植物减轻或抑制病菌侵染的遗传特性,现代农业中,利用植物抗病性是防治病害的重要措施。Psa是猕猴桃生产中最重要的病害,其危害程度与猕猴桃品种有关。李淼等[9]、申哲等[10]、张慧琴等[11]田间调查发现,不同猕猴桃品种溃疡病发病程度有明显差异。林文力等[6]通过随机抽样调查发现,湖南凤凰、永顺、吉首猕猴桃园的栽培品种中,‘金魁发病较轻,‘红阳发病最重。一般植物抗病性有固有和诱导两种类型,其中植物诱导抗性是因真菌、细菌、病毒等诱导因子侵袭而引起的,可使植物体内POD、PAL、SOD、CAT等抗病性相关酶活性发生一系列变化[12]。李庚飞[13]、李淼[14]、石志军等[15]、易盼盼[16]研究表明,猕猴桃体内相关酶活性与植株抗病性密切相关,感病品种感病后酶活性显著低于抗病品种。
湘西是湖南猕猴桃重要的生产基地,截至2014年,种植面积约为1万hm2,占全省种植面积的90%[17]。近年来,溃疡病致使当地很多猕猴桃园被毁,损失十分严重。为此,笔者特开展湘西地区猕猴桃溃疡病抗性资源筛选及其抗性机理研究,旨在筛选抗性强的猕猴桃资源,为湘西地区猕猴桃抗病育种提供理论依据,为猕猴桃溃疡病防控提供参考。
1 材料与方法
1.1 材料
试验材料均来自湘西民族职业技术学院试验园,包括:美味猕猴桃Actinidia chinensis var. deliciosa,品种‘米良1号和育种材料‘M06;中华猕猴桃A.chinensis Planch.,品种‘东红、‘红阳(对照)和育种材料‘Z12;对萼猕猴桃A.valvata Dunn,育种材料‘S9801;毛花猕猴桃A.eriantha Benth.,育种材料‘M9808。接种枝条为长势一致的一年生枝条,直径0.8 cm;叶片为当年生的健康嫩叶。
接种菌株为P.syringae pv. actinidia str. shaanxiM228(GCA 000344475.2),由西北农林科技大学植物保护学院果树病害生物学和综合防治实验室提供。将致病菌株M228接种至LB固体培养基上,25℃下培养36 h。挑单菌落至LB液体培养基中,于25℃、200 r/min摇床上培养36 h,而后6 500 r/min离心6 min,收集菌体,以备用。
1.2 方法
1.2.1 接种试验
1.2.1.1 离体叶片接种Psa
参考黄其玲等[18]和Zhao等[19]的方法(略改动),采用真空渗透接种。接种菌液的配制:收集M228菌体,用无菌PBS缓冲液(pH7.0)冲洗M228菌体2~3次,配制OD值为0.2的菌液,再稀释10-4,取30 mL菌液加入50 mL离心管中待用。将猕猴桃叶片用无菌水冲洗干净,避开叶脉,用打孔器(d=15 mm)打取叶盘,将叶盘分别放入盛有菌液的离心管中,每管45~50片叶盘,以PBS缓冲液为对照,用真空泵抽真空1 h,取出叶片,吸干叶盘表面水分,将其背面朝下平贴在0.8%水琼脂的培养皿上,每皿15片,置于L∥D=16 h∥8 h的人工气候箱中,昼夜温度16℃/10℃。并分别于接种后2、4、6、8和10 d观察叶盘发病情况,计算病斑面积/叶盘面积(用F表示)。每皿3次重复。
叶盘发病程度分级:0级,无病斑;1级,F为1%~10%;2级,F为11%~25%;3级,F为26%~50%;4级,F为51%~75%;5级,F为76%~100%。
病情指数=100×Σ(各级叶盘数×相对级值)/(总叶盘数×最高级值);
抗性评价:病情指数0~10为高抗(HR);11~25为抗病(R);26~40为耐病(T);41~65为感病(S);65以上为高感(HS)。
1.2.1.2 离体枝条接种Psa
参考Zhao等[19]的致伤接种法(略改动)。接种菌液配制:收集M228菌体,用无菌水制成菌悬浮液,调整OD600至0.2。采集健康的当年生猕猴桃枝条(d=8 mm,长15 cm),用0.6% NaClO表面消毒10 min,灭菌水清洗3~4次,自然晾干,用石蜡将两端封口。用已灭菌的刀片划伤树皮至木质部(宽1 mm)。以无菌水为对照,在伤口处接种M228菌液10 μL,每供试材料接种15根,3次重复。而后放入托盘,置于L∥D=16 h∥8 h,光照和黑暗时温度分别为16℃和10℃的人工气候箱中培养。于5、10、15、20和25 d分別测量病斑长度,并用Duncan法进行方差分析。
1.2.2 供试材料接种Psa后相关酶活性测定
1.2.2.1 酶液制备
参照 Given等[20]和孙红梅等[21]的方法(略有改动)制备离体枝条接种M228后0、5、10、15和20 d的酶液。称取样品0.5 g置于研钵中,加入0.05 mol/L PBS缓冲液(pH 7.8) 1 mL和少量PVP,冰浴,研磨成浆,转至EP管,用3 mL PBS缓冲液冲洗研钵,冲洗液转入EP管。在4℃、6 500 r/min离心30 min,取上清液(即酶液)。
1.2.2.2 PAL活性测定
参考易盼盼[16]和董汉松[22]的方法(略有改动)。以不加酶液为空白对照,将检测液3.1 mL(即2 mL pH 7.8 PBS冲液+1 mL 0.02 mol/L L苯丙氨酸+100 μL酶液)放于水浴锅内,30℃下反应30 min,在290 nm 处测OD值,计算PAL酶活性,以1 min内OD变化0.01为1个酶活性单位。
1.2.2.3 CAT活性测定
采用紫外光吸收法[23]。取0.05 mol/L PBS (pH 7.0)缓冲液100 mL,加入30%过氧化氢160 μL,摇匀,避光4℃保存。取2.9 mL CAT反应液,在30℃水浴锅中预热15 min,加入100 μL酶液,摇匀,快速盛入比色皿,在波长 240 nm下测OD初始值及3 min时的OD值,计算CAT酶活性,以1 min内OD变化0.1为1个酶活性单位。
1.2.2.4 POD活性测定
采用愈创木酚法[24]。量取0.05 mol/L PBS (pH 6.0)缓冲液50 mL,加入0.05 mmol/L愈创木酚28 μL,磁力搅拌器上(30℃)搅动,溶解,冷却后,加入30% H2O219 μL,摇匀,低温保存以备用。取3 mL POD反应液,加入30 μL酶液混匀,以加30 μL PBS缓冲液(pH 7.8) 为对照,在470 nm处测0、2 min的OD值,计算其POD酶活性,以1 min内OD变化0.01为1个酶活性单位。
1.3 数据处理
试验数据采用Excel和SPSS软件进行统计分析。
2 结果与分析
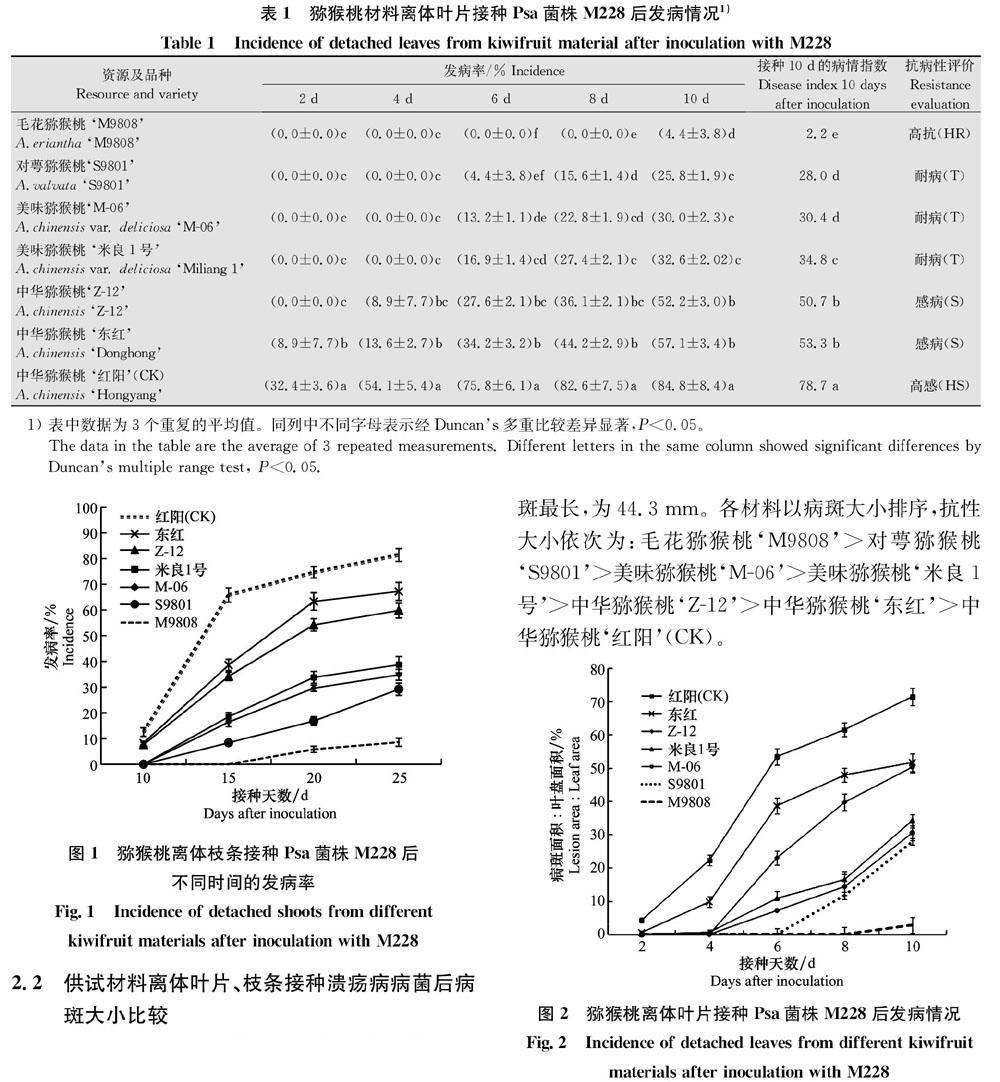
2.1 供试材料离体叶片、枝条接种溃疡病病菌后发病情况比较
从表1、图1可以看出,供试材料的离体叶片、枝条接种M228后开始发病的时间、发病率明显不同。其中,毛花猕猴桃‘M9808的离体叶片接种M228后10 d出现病状,发病率4.4%,病情指数为2.2,高抗,离体枝条接种M228后20 d出现病症,出现时间最晚,接种后25 d发病率仅为8.6%;对萼猕猴桃‘S9801、美味猕猴桃‘M06、‘米良1号离体叶片接种M228后6 d开始发病,10 d后的发病率分别为25.8%、30.0%、32.6%,病情指数分别为28.0、30.4、34.8,均为耐病,离体枝条接种M228后15 d出现病症,接种后25 d的发病率分别为29.2%、34.8%、38.7%;中华猕猴桃‘Z12离体叶片接种M228后4 d开始发病,接种后10 d的发病率为52.2%,病情指数为50.7,感病,离体枝条接种后10 d出现病症,接种后25 d发病率仅为59.8%;‘东红、‘红阳离体叶片接种M228后2 d开始发病,接种后10 d的发病率分别为57.1%、84.8%,病情指数分别为53.3、78.7,分别为感病、高感,离体枝条,接种M228后10 d出现病症,接种后25 d的发病率分别为67.2%、81.4%。
2.2 供试材料离体叶片、枝条接种溃疡病病菌后病斑大小比较
从图2~图5可知,供试材料离体叶片、枝条室内接种M228后,各材料的病斑大小差异显著(经Duncans方差分析,P<0.05)。其中,离体叶片接种后10 d,毛花猕猴桃‘M9808发病最轻,其病斑面积/叶盘面积(F)最低,仅为2.8%,,约为对照的1/25;对萼猕猴桃‘S9801次之,F为27.8%,约为对照‘红阳的2/5;‘红阳感病最重,F为71.4%。离体枝条接种Psa后25 d,毛花猕猴桃‘M9808的病斑最短,为3.4 mm,约为对照的1/11;对萼猕猴桃‘S9801次之,为11.3 mm,约为对照的1/4;对照病斑最长,为44.3 mm。各材料以病斑大小排序,抗性大小依次为:毛花猕猴桃‘M9808>对萼猕猴桃‘S9801>美味猕猴桃‘M06>美味猕猴桃‘米良1号>中华猕猴桃‘Z12>中华猕猴桃‘东红>中华猕猴桃‘红阳(CK)。
2.3 供试材料离体枝条接种Psa后相关酶活性比较
从图6~图8可看出,供试材料离体枝条接种M228后,各材料的PAL、CAT、POD酶活性差异较大,抗病品种的相关酶活性均比感病品种高,且酶活性峰值出现时间也较早。其中,毛花猕猴桃‘M9808的PAL峰值最高,接种后5 d出现,出现时间最早,比对萼猕猴桃‘S9801、美味猕猴桃‘M06、‘米良1号提早5 d出现,比中华猕猴桃‘Z12、‘东红、‘红阳提早10 d出现;其CAT、POD活性峰值也最高,接种后10 d出现,与对萼猕猴桃‘S9801、美味猕猴桃‘M06、‘米良1号峰值出现时间相同,但比中华猕猴桃‘Z12、‘东红、‘红阳提早5 d出现。
3 讨论
猕猴桃溃疡病致病性强、根除难、范围广、危害大。目前,对此病的防治主要采用化学药剂与栽培措施相结合的方式。如Serizawa等[25]、阳廷密等[26]、秦虎强等[27]的田间试验结果表明,200 μg/mL链·土霉素1 g/L、80%乙蒜素EC 10倍液、72%农用硫酸链霉素SPX 2.0 mg/mL等药剂预防效果较好。30余年来,国内外学者在栽培上对猕猴桃溃疡病防治取得了一定成果,但防治效果均具有一定的局限性,生产中易受当年气候、地理位置、果园土质及果农管理水平的影响。近年来,由于长期频繁过量使用化学药剂,已引起病菌抗药性增强、农药残留物增多、果实品质下降等一系列问题。因此,栽培抗病品种是防治Psa最经济、有效、实用的方法,选育抗病品种、利用抗性资源作为砧木防治Psa,是今后研究工作的重點。
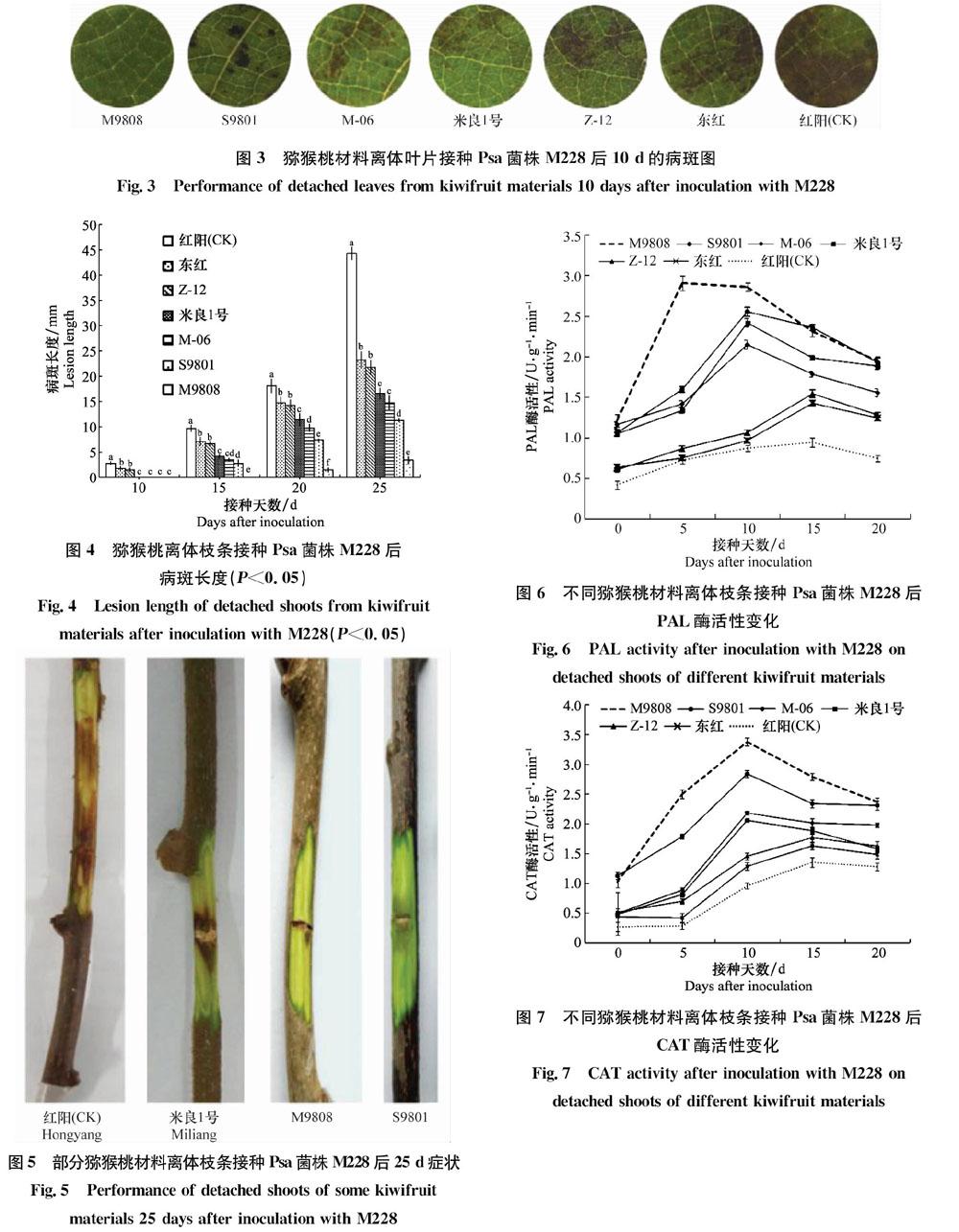
前人研究表明,猕猴桃体内相关酶活性与植株对Psa的抗性密切相关。李庚飞[13]、李淼[14]、石志军等[15]通过测定猕猴桃枝条感病前后相关酶的活性,发现枝条感病后抗病品种的相关酶活性均高于感病品种,与本试验的结果一致。易盼盼[16]通过测定5个品种盆栽苗接种Psa后的相关酶活性,发现各品种酶活性均显著增加,其中,抗病材料毛花猕猴桃‘M9808接种Psa后10 d其POD、PAL、CAT达到峰值,而中华猕猴桃‘红阳接种Psa后15 d其POD、PAL达到峰值,但CAT活性变化不大,这与本试验结果不同,这可能与供试材料枝干部位、粗度及酶液提取过程中的处理方法有关,具体原因有待进一步分析。
抗病资源是选育猕猴桃抗病品种的物质基础,猕猴桃种间对Psa敏感程度不同。石志军等[15]通过室内离体接种评价了3个猕猴桃种的24个不同品种及资源,发现3个毛花猕猴桃材料对Psa抗性强,而多数中华猕猴桃材料抗性较差;张慧琴等[28]通过室内离体接种评价了3个种的18个不同品种及资源,发现中华猕猴桃抗性最差,而美味猕猴桃的供试材料抗性差异较大;刘娟[29]通过室内离体接种,发现8个种25个雌性16个雄性猕猴桃资源及品种中,软枣猕猴桃‘魁绿(雄)高抗,毛花猕猴桃‘毛花(雄)中感,中华猕猴桃‘红阳(雌)中感,‘红阳(雄)感病,这与石志军等[15]的研究结论不一致,也与本试验的结果不同,这可能与接种菌株、接种方法和供试材料的枝干情况有关。几十年来,国内外关于猕猴桃品种对Psa的抗性研究较多,但多属中华猕猴桃、美味猕猴桃或毛花猕猴桃的品种或资源,其他猕猴桃种较少。湘西地区猕猴桃种植历史悠久,有美味、紫果、对萼、京梨等17个猕猴桃种[30]的野生资源,为猕猴桃抗性资源筛选和抗病育种工作的开展提供了丰富的材料来源。本试验选择了4个种7个猕猴桃材料,从种来看,毛花猕猴桃对Psa抗性最强,对萼猕猴桃次之,中华猕猴桃抗性最差;从资源及品种看,毛花猕猴桃‘M9808对Psa的抗性最强,对萼猕猴桃‘S9801次之,中华猕猴桃‘红阳最差。说明毛花猕猴桃‘M9808可作为今后抗病育种或抗性砧木的理想材料。但本试验选用的材料有限,下一步需扩大猕猴桃鉴定范围,进一步筛选高抗猕猴桃Psa的种质资源。
参考文献
[1] SERIZAWA S, ICHIKAWA T, TAKIKAWA Y, et al. Occurence of bacterial canker of kiwifruit in Japan: description of symptoms, isolation of the pathogen and screening of bactericides [J]. Annals of the Phytopathological Society of Japan, 1989, 55(4): 427436.
[2] FERRANTE P, SCORTICHINI M. Identfication of Pseudomonas syringae pv. actinidiae as causal agent of bacterial of yellow kiwifruit (Actinidia chinensis Planchon) in central Italy[J]. Journal of Phytopathology, 2009, 157: 768770.
[3] VANNESTE J, POLIAKOFF F, AUDUSSEAU C, et al. First report of Pseudomonas syringae pv. actinidiae, the causal agent of bacterial canker of kiwifruit in France [J]. Plant Disease, 2011, 95(10): 1311.
[4] EVERETT K R. Pseudomonas syringae pv. actinidiae and other pathovars of Pseudomonas syringae[J]. Australasian Plant Disease Notes, 2011, 6(1): 6167.
[5] 方炎祖,朱曉湘,王宇道,等.湖南猕猴桃病害调查研究初报[J].四川果树科技,1990(1):2829.
[6] 林文力,罗赛男,肖伏莲.湘西自治州猕猴桃溃疡病发生情况及防治措施探讨[J].湖南农业科学,2015(5):4244.
[7] 胡黎华,杨灿芳,熊伟,等.重庆猕猴桃溃疡病发生情况及影响因素调查[J].中国南方果树,2018,47(3):151152.
[8] 马利,尹勇,封传红,等.四川省猕猴桃溃疡病发生现状及绿色防控技术体系的建立[J].中国植保导刊2017,37(11):8083.
[9] 李淼,檀根甲,李瑶,等.不同猕猴桃品种对细菌性溃疡病的抗病性及其聚类分析[J].植物保护,2004,30(5):5154.
[10]申哲,黄丽丽,康振生.陕西关中地区猕猴桃溃疡病调查初报[J].西北农业学报,2009,18(1):191193.
[11]张慧琴,李和孟,冯健君,等.浙江省猕猴桃溃疡病发病现状调查及影响因子分析[J].浙江农业学报,2013,25(4):832835.
[12]VAN LOON L C. Induced resistance in plants and the role of pathogenesisrelated proteins[J]. European Journal of Plant Pathology, 1997, 103: 753765.
[13]李庚飞.猕猴桃体内酚含量保护酶活性与抗溃疡病关系的初步研究[J].福建林业科技,2009,36(4):131134.
[14]李淼.猕猴桃品种对细菌性溃疡病的抗性机制[D].合肥:安徽农业大学,2003.
[15]石志军,张慧琴,肖金平,等.不同猕猴桃品种对溃疡病抗性的评价[J].浙江农业学报,2014,26(3):752759.
[16]易盼盼.不同猕猴桃品种溃疡病抗性鉴定及抗性相关酶研究[D].杨凌:西北农林科技大学,2014.
[17]王仁才,熊兴耀,庞立.湖南猕猴桃产业发展的问题及建议[J].湖南农业科学,2015(15):124127.
[18]黄其玲,高小宁,赵志博,等.GFPuv标记猕猴桃溃疡病菌的生物学特性及其在土壤、根系中的定殖[J].中国农业科学,2013,46(2):282291.
[19]ZHAO Zhibo, GAO Xiaoning, HUANG Qiling, et al. Identification and characterization of the causal agent of bacterial canker of kiwifruit in the Shaanxi Province of China [J]. Plant Pathology, 2013, 95: 155162.
[20]GIVEN N K, VENIS N A, GRIERSON D. Phenylalanine ammonialyase activity and anthocyanin synthesis in ripening strawberry fruit [J].Journal of Plant Physiology,1988,133:2530.
[21]孙红梅,李天来,李云飞.低温解除休眠过程中兰州百合鳞茎酚类物质含量及相关酶活性变化[J].中国农业科学,2004,37(11):17771782.
[22]董汉松.植物诱导抗病性原理和研究[M].北京:科学出版社,1995.
[23]李合生,孫群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[24]郝再斌,苍晶,徐仲.植物生理实验技术[M].哈尔滨:哈尔滨工业大学出版社,2002.
[25]SETSUO SERIZAWA,赵宝权.日本猕猴桃溃疡病的症状、病原和防治药剂[J].国外农学.植物保护,1992(1):1113.
[26]阳廷密,王明召,张素英,等.猕猴桃溃疡病防治药剂药效评价[J].南方农业学报,2017,48(7):12311236.
[27]秦虎强, 赵志博, 高小宁, 等. 四种杀菌剂防治猕猴桃溃疡病的效果及田间应用技术[J]. 植物保护学报, 2016, 43(2): 321328.
[28]张慧琴,毛雪琴,肖金平,等.猕猴桃溃疡病病原菌分子鉴定与抗性材料初选[J].核农学报,2014,28(7):11811187.
[29]刘娟.猕猴桃溃疡病抗性材料评价及其亲缘关系的ISSR聚类分析[D].成都:四川农业大学,2015.
[30]陈一星.对湘西地区猕猴桃资源的调查[J].生物学杂志,2004,21(1):3839.
(责任编辑:杨明丽)
