具有除草活性的生防菌株GD-9发酵条件优化及菌剂制备
2019-06-27马永强朱海霞
马永强 朱海霞

摘要 为了明确具有除草活性的生防菌株GD9发酵过程中各因子的配比和最优条件,采用单因素试验对菌株最适碳源、氮源、载体、固态发酵基质进行了筛选,应用正交试验设计研究了碳源、氮源、初始含水量、接种量、初始pH、培养时间、培养温度7种因素对菌株活菌数的影响。试验结果表明菌株GD9最佳固态发酵条件为:氮源NaNO3 58.4 mg/g,碳源葡萄糖48.4 mg/g,培养基质最适初始含水量为258 mg/g,最适接种量为0.26 mL/g,初始 pH 7.6,最佳培养时间147.8 h,最佳培养温度30.7℃,最适宜的载体为黏土,分散剂为聚乙烯醇,稳定剂为膨润土,润湿剂为糊精。通过发酵试验结果制备生防菌株GD9的固体菌剂,该研究为菌剂的商品化生产奠定基础。
关键词 生防菌株; 除草活性; 发酵条件; 菌剂制备
中图分类号: S 451.1, S 476
文献标识码: ADOI: 10.16688/j.zwbh.2018255
Abstract In order to clarify the proportion and optimal conditions of various factors in the fermentation process of biocontrol strain GD9 with herbicidal activity, the single factor experiment was performed to screen the optimal carbon source, nitrogen source, carrier and solid fermentation substrate of the strain. The orthogonal experiment design was used to study the influences of carbon source, nitrogen source, initial water content, inoculation amount, initial pH value, culture time and culture temperature on the colony number of the strain. The experimental results showed that the optimal solid state fermentation conditions of strain GD9 were Nsource NaNO3 58.4 mg/g, Csource glucose 48.4 mg/g, 258 mg/g of initial water content of the culture medium, 0.26 mL/g of inoculation amount, the initial pH 7.6, 147.8 h and 30.7℃ of culture time and temperature, respectively. The optimal carrier, dispersant, stabilizer and wetting agent were clay, polyvinyl alcohol, bentonite and dextrin. The solid microbial inoculum of biocontrol strain GD9 was prepared through fermentation test results. This study laid a foundation for the commercial production of the microbial inoculum.
Key words biocontrol strain; herbicidal activity; fermentation conditions; preparation of microbial inoculum
农田杂草是农业生态系统的一个组成部分,直接或间接地影响着农产品的质量、产量和品质[1]。目前在生产上,农田杂草的防治一般采用人工防除和化学防除等方法。人工除草效率相对低、成本高,而长期采用化学防除易使杂草易产生抗药性,导致用药量增加、防效降低、环境污染等弊端[23]。与化学除草剂相比,微生物除草剂具有许多潜在的优势:(1)這类除草剂作用位点新颖,是现有化学除草剂未涉及的,有利于杂草的抗性治理;(2)这些天然产物可以为新的除草剂合成方案提供线索;(3)在低浓度时这些产物便可发挥较高生物活性;(4)微生物天然产物在环境中的半衰期比合成农药短得多,易迅速降解或解毒,因此登记试验比化学农药所用的时间短、资金少;(5)植物细胞培养技术、发酵技术、分子遗传学和基因工程最新发展把生产昂贵的天然产物防除杂草变成了现实[46]。微生物繁殖快,能广泛利用农副产品、工农业废水和废弃物等进行生产,微生物除草剂被认为是绿色、无公害农药,其防治对象不易产生抗药性,且药剂对农田生态环境影响小,有利于保护环境和农业可持续发展,已成为农田用药中的首选药剂[7]。
微生物除草剂的研究起步很晚,一些关键技术还没有解决,许多研究还处在试验阶段,真正商品化的很少,即使有,也只是作为化学除草剂的补充。但随着对微生物除草剂这一新的研究领域的认识不断加深,相信它一定会成为未来除草剂市场的主流[8]。近20多年来,国外已成功地开发了一些微生物除草剂,并取得了一定的经济效益。双丙氨膦(bialaphos)是第一个被开发成商品除草剂的放线菌Streptomyces viridochromogenes的代谢产物。双丙氨膦是一种可杀单子叶和双子叶植物的非选择性除草剂,常用于非耕地和果园防除一年生或多年生杂草,已在日本销售[9]。目前微生物除草剂已经越来越受到重视,其研究不仅仅局限在潜力菌株的筛选,更多的菌剂已被开发出来,各种助剂的使用使微生物除草剂正向专业化和规范化发展[10]。
链霉菌Streptomyces sp. GD9菌株是分离自大刺儿菜根系土壤中的一株放线菌,前期大量试验表明该菌株对一年生禾本科杂草野燕麦具有较好的致病作用,对野燕麦种子的萌发抑制率达90.1%,具有开发生防除草剂的潜力。本研究为了明确菌株GD9发酵相关碳源、氮源、载体、固态发酵基质、初始含水量、接种量、初始pH、培养时间、培养温度等因素对菌株活菌数的影响,为该菌株除草菌剂的研发和商品化生产提供理论依据。
1 材料与方法
1.1 材料
供试菌株:GD9是分离自大刺儿菜根系土壤中的一株放线菌,保存于青海省农林科学院植物保护研究所有害生物综合防治实验室。
高氏一号培养基:可溶性淀粉20 g、KNO31 g、K2HPO4 0.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g、琼脂16~18 g、蒸馏水1 L、pH 7.4~7.6。
高氏一号液体培养基:可溶性淀粉20 g、KNO31 g、K2HPO4 0.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01 g、蒸馏水1 L、pH 7.4~7.6。
碳源:可溶性淀粉、麦麸、蔗糖、葡萄糖、玉米粉、小麦粉。
氮源:大豆粉、酵母浸粉、蛋白胨、硝酸钠、硫酸铵、尿素。
固态发酵基质:羊粪、菜籽饼、小麦秸秆、麦麸、玉米粉。
载体及助剂:可溶性淀粉、CaCO3、糊精、羧甲基纤维素、海藻酸钠、羧甲基纤维素钠、拉开粉、十二烷基硫酸钠、木质素磺酸钠、白炭黑、膨润土、轻质碳酸钙、聚乙烯醇、腐殖酸、硅藻土、吐温、沙子、黏土、炉渣。
1.2 菌株活化
制备高氏一号培养基,倒平板使其冷却、凝固待用;从冰箱中取出4℃条件下保存的菌株,使其恢复到室温状态, 用接种针挑取适量菌丝在高氏培养基上划线,之后放入28℃培养箱黑暗培养7 d,挑取其中部分菌丝接种到新的培养基中培养,重复此步骤2~3次,从而得到生长良好的菌落(图1)。
1.3 最适碳、氮源的筛选
用高氏1號为基础培养基进行碳源筛选试验,将可溶性淀粉、麦麸、蔗糖、葡萄糖、玉米粉、小麦粉作为碳源,按质量分数2%的量加入高氏1号培养基中,搅拌均匀,121℃高压灭菌30 min,在超净工作台中倒入灭菌的培养皿中待其冷却凝固,将活化后生长旺盛的菌落打8 mm菌饼, 菌丝面朝下接种于培养基中央,放入28℃恒温培养箱黑暗培养,定期测量菌落直径和孢子悬浮液的OD值。以不添加碳源的培养基为对照组,选出菌落生长好的碳源。每组设置3个重复。
用高氏1号为基础培养基进行氮源筛选试验,将大豆粉、酵母浸粉、蛋白胨、硝酸钠、硫酸铵、尿素作为氮源,按2%的量加入高氏1号培养基中,用不添加氮源的培养基作为对照组,以同样的方法选出菌落生长好的氮源。每组设置3个重复。
孢子悬浮液OD值测定:用载玻片将菌落上的孢子轻轻刮下,加入5 mL超纯水,用单层干净无菌纱布过滤除去菌丝,得到孢子悬浮液。用分光光度计在600 nm波长下测其OD值,选出产孢量最佳的碳源[12]。以同样的方法,选出产孢量最高的氮源。
1.4 固态发酵基质筛选
选用菜籽饼、玉米粉、羊粪、麦麸和小麦秸秆等价格低廉的农副产品下脚料作为固态发酵基质。每瓶中小麦秸秆10 g、羊粪15 g、菜籽饼25 g、玉米粉 25 g、麦麸25 g分别放入150 mL的三角瓶中,按质量分数2%的量加入所筛选出来的最适碳氮源、适量的自来水,充分搅拌均匀,经121℃、30 min高温高压灭菌后,冷却到室温。在超净工作台里每瓶接种菌液5 mL后在28℃恒温培养箱进行培养,观察记录菌落生长状况,以不接菌液的固态基质为空白对照;用分光光度计测定经过滤的菌悬液OD值,筛选出产孢量高的固态发酵基质。每组设置3个重复。
1.5 正交试验优化培养条件
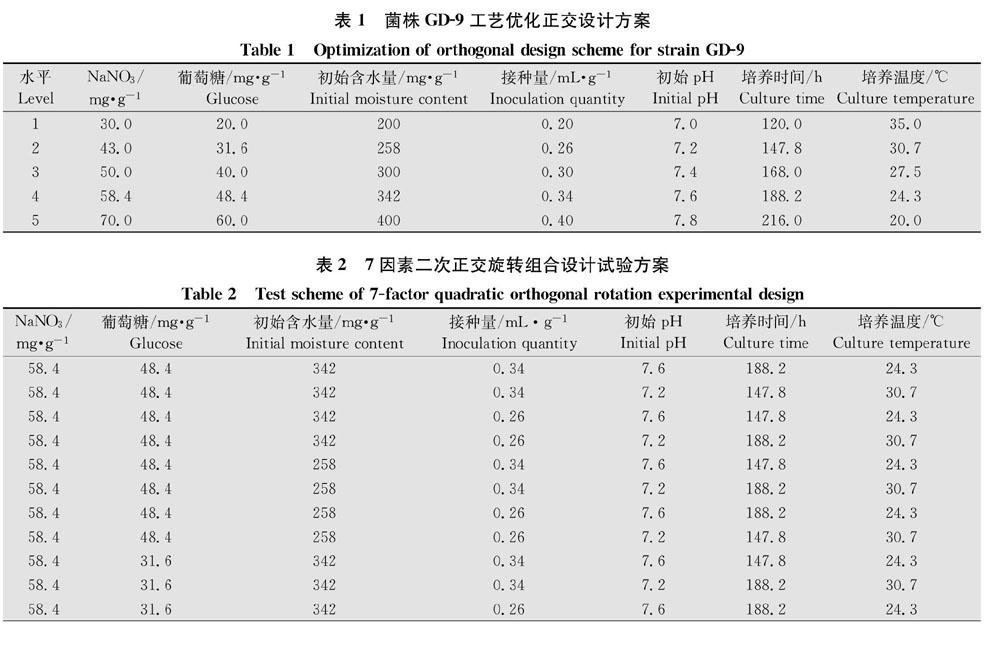
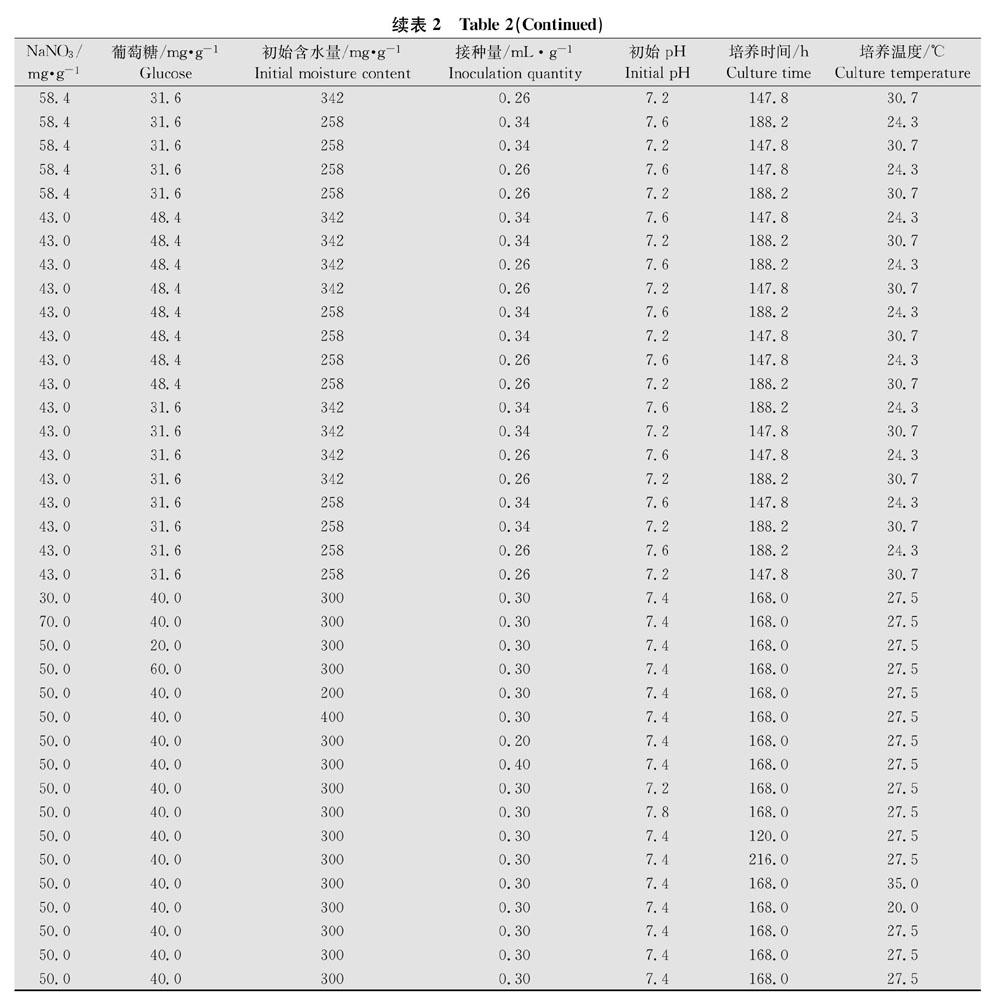
采用L25(57)正交表,测定碳源、氮源、初始含水量、接种量、初始pH、培养时间、培养温度7个因素对菌株GD9活菌数的影响,每种因素各取5个水平(表1),对菌株GD9固态发酵条件相关上述7个因素进行正交设计得到49个处理(表2)。根据最适碳氮源和固态发酵基质的筛选结果,选用麦麸∶羊粪=1∶1作为固态发酵基质,葡萄糖作为碳源,硝酸钠作为氮源,根据配方配制不同处理的固态发酵培养基,经121℃灭菌30 min,冷却到室温后,依次接入GD9发酵液,搅拌均匀,置于生化培养箱中28℃静置培养。不同处理自然风干、粉碎,平板菌落计数法测定不同处理的活菌数。每个处理设3次重复。
1.6 载体筛选及剂型制备
用高氏1号为基础培养基进行载体单因素试验,将初筛出来的载体硅藻土、膨润土、拉开粉、白炭黑及助剂羧甲基纤维素、羧甲基纤维素钠、木质素磺酸钠等按质量分数2%的量加入高氏1号培养基中,搅拌均匀,121℃高压灭菌30 min,在超净工作台中将含不同载体或助剂的培养基倒入灭菌的培养皿中,待其冷却凝固,将活化后生长旺盛的菌落打8 mm菌饼, 菌丝面朝下接种于培养基中央,放入28℃恒温培养箱黑暗培养,定期测量菌落直径和孢子悬浮液OD值。以不添加载体的基质为对照组,选出菌落生长好的载体。每组设置2个重复。根据前几步所筛选的最适碳氮源、固态发酵基质及正交试验优化的最佳培养条件进行菌剂的研制。在最适固态发酵基质中加适量的水、2%的碳氮源,121℃、30 min高温高压灭菌后,冷却到室温。每个白盆0.7 kg基质,接种菌液160 mL,用手搅拌均匀后用保鲜膜封口室温培养。
1.7 数据分析
全部数据分析在DPS 6.50 数理统计分析软件上进行。
2 结果与分析
2.1 最适碳氮源筛选
分别于培养第5、7 和9天测定菌株GD9在不同碳氮源培养基上的菌落直径和孢子悬浮液OD值,结果见表3、表4。GD9在葡萄糖培养基上菌落生长最快,菌落直径最大,葡萄糖培养基与其他碳源处理孢子悬浮液OD值之间存在极显著性差异,在可溶性淀粉和麦麸培养基上菌落直径略小,在小麦粉培养基上最小。在硝酸钠培养基上菌落直径最大,且与其他氮源处理孢子悬浮液OD值之间存在极显著性差异;尿素培养基完全抑制菌落生长。结合菌落形态、菌落直径和孢子悬浮液OD值,最终筛选最适碳源为葡萄糖,最适氮源为硝酸钠。
2.2 固态发酵基质筛选
利用孢子悬浮液分光光度值判断不同固态基质的产孢量大小。从表5可以看出,菌株GD9生长较好的固态基质为:羊粪>麦麸>菜籽饼>小麦秸秆>玉米粉;孢子悬浮液OD值方差分析结果表明,羊粪培养基上GD9产孢量与其他基质间存在极显著差异,菜籽饼、玉米粉、麦麸和小麦秸秆之间不存在显著性差异。因此,GD9菌株的最适产孢固态发酵基质为羊粪。
2.3 正交试验优化培养条件
菌株GD9固态发酵的正交试验统计结果(表6)表明,试验的7种因素中极差R值从大到小依次为:氮源(4.72)、碳源(3.69)、初始含水量(3.51)、培养温度(3.48)、接种量(2.85)、初始pH(2.59)、培养时间(2.56)。因此,影响菌株GD9固态发酵条件的因素作用由大到小依次为:氮源>碳源>初始含水量>培养温度>接种量>初始pH>培养时间。从各水平的统计A值比较来看,菌株GD9的最佳固态发酵条件为:氮源硝酸钠58.4 mg/g、碳源葡萄糖48.4 mg/g、初始含水量258 mg/g、接种量0.26 mL/g、初始 pH 7.6、培养时间147.8 h、培养温度30.7℃。
2.4 载体及助剂筛选
表7可以看出:黏土培养基上菌落生长最快,菌落直径最大,且黏土培养基上得到的孢子悬浮液OD值最高,与其他载体培养基的孢子悬浮液OD值之间存在极显著差异,膨润土、聚乙烯醇及糊精处理的次之;拉开粉和海藻酸钠载体处理的孢子悬浮液间不存在显著差异,完全抑制菌丝生长,菌落直径为8.0 mm,孢子悬浮液OD值为0。其余载体处理孢子悬浮液OD值之间均存在极显著差异。
综合菌落形态、菌落直径和孢子悬浮液OD值得出,菌株GD9最适载体和助剂为黏土、膨润土、聚乙烯醇、糊精。
2.5 剂型研制
根据所筛选的最适碳氮源、固态发酵基质及正交试验优化的最佳培养条件进行菌剂的研制。在羊粪∶麦麸=1∶1的固态发酵基质中按质量分数加25.8%水、2%碳氮源(葡萄糖、硝酸钠),121℃、30 min高温高压灭菌后,冷却到室温。每个白盆0.7 kg基质,接种菌液160 mL,搅拌均匀后用保鲜膜封口室温培养。
将GD9菌剂按质量分数60%、黏土30%、膨润土1%、糊精3%、聚乙烯醇6%的比例混合,按照一定的工艺,初步试验探索得到稳定性强、可均匀分散的易溶于水的可湿性粉剂。
3 结论与讨论
本试验通过对具有除草活性的菌株GD9的活化,最适碳氮源、固态发酵基质、载体的筛选以及采用正交试验优化培养条件。得出以下结论:
以菌落直径和孢子悬浮液OD值为指标筛选最适碳氮源以及载体和助剂,筛选出最适碳源为葡萄糖,最适氮源为硝酸钠,最适载体及助剂为黏土、聚乙烯醇、膨润土、糊精。
用菌落计数法和孢子悬浮液OD值测定法对最适固态发酵基质和最优培养条件的筛选中,筛选出最适固态发酵基质为羊粪;影响菌株GD9固态发酵条件的因素作用由大到小依次为:氮源>碳源>初始含水量>培养温度>接种量>初始pH>培养时间。菌株GD9的最佳固态发酵条件为:氮源硝酸钠58.4 mg/g、碳源葡萄糖48.4 mg/g、初始含水量258 mg/g、接种量0.26 mL/g、初始pH7.6、培养时间147.8 h、培养温度30.7℃。
生防菌固态发酵基质的选取一般都是容易获得、价格低廉的农副产品下脚料,在农业生产上既绿色、无公害,又可保護环境,符合农业可持续发展的要求[14]。本研究中生防菌株GD9的固态发酵适用于大批量生产,得到的菌剂易保存,方便储存和运输。
微生物除草剂的开发应用比化学农药的开发存在更大的难度,其药效受外界环境影响很大,所以选择合适的载体助剂是生物农药开发的关键。生物农药助剂的功能,就在于改善农药的一些物理或化学性能,最大限度地发挥药效及安全施药[15]。
本试验已筛选出了最适合的载体及助剂,后续试验可将GD9菌剂60%、黏土30%、膨润土1%、糊精3%、聚乙烯醇6%的比例进行混合,按照一定的工艺,初步试验探索得到稳定性强、可均匀分散的易溶于水的可湿性粉剂。最终筛选研制出防除效果较好的除草剂剂型,为微生物除草剂的研究提供理论依据。
参考文献
[1] 梁巧玲,马德英.农田杂草综合防治研究进展[J].杂草科学,2007(2):3536.
[2] 崔新倩.花生田杂草化学防除现状及趋势[J].农药科学与管理,2011,14(12):156158.
[3] 黄石旺,刘正日,陈和春,等.现代农业发展中除草剂的危害及对策[J].现代农业科技,2010(14):2829.
[4] CUTLER H G, Perspectives on discovery of microbial phytotoxins with herbicide activity [J]. Weed Technology,1988(2): 525532.
[5] 丁建清.生物防治——杂草综合防治的重要内容[J].杂草学报,1995,9(1):6064.
[6] 陈燕芳,丁伟,丁吉林,等.天然产物除草剂研究进展[J].杂草科学,2007(2):15.
[7] LI Yongquan, SUN Ziling, ZHUANG Xiaofeng, et al. Research progress on microbial herbicides [J]. Crop Protection, 2003, 22(2): 247252.
[8] 仉欢,王开运.微生物除草剂研究进展[J].杂草科学,2010(2):18.
[9] 藤森岭.微生物源农药杂草防除[J].农业技术,1993,48(1):1821.
[10]ZHANG Jinlin, ZHANG Lihui, LIU Yingchao, et al. The herbicidal activity of mutant isolates from Botrytis cinerea[J]. Agricultural Sciences in China, 2006, 5(8): 622628.
[11]马娟,董金皋.微生物除草剂与生物安全[J].植物保护,2006,32(1):912.
[12]涂璇.辣椒疫霉生防菌筛选及生防菌剂应用研究[D].杨凌:西北农林科技大学,2004.
[13]郭亮,刑晓旭,郑学明,等.重铬酸钾溶液对细菌活性的影响[J].山东畜牧兽医,2009,30(2):48.
[14]曹红娣.农药可湿性粉剂生产工艺的改进[J].上海农业科技,2005(6):7779.
[15]张剑,董晔欣,张金林,等.一株具有高除草活性的真菌菌株[J].菌物学报,2008,27(5):645651.
(责任编辑:田 喆)
