滇池流域富磷退化山区主要优势植物对土壤酶活性的影响
2019-06-26吴晓妮付登高赵洛琪
黄 娜, 周 苡, 吴晓妮, 付登高, 赵洛琪
(1.云南大学 生态学与环境学院/云南省高原山地生态与退化环境修复重点实验室, 昆明 650091;2.昆明市第二职业中等专业学校, 昆明 650228; 3.昆明学院 生命科学与技术系, 昆明 650214)
如何选择对退化山地环境适生的植物,进而有效地构建控制水土流失或面源污染输出的植物群落是生态修复及水体富营养化治理的重点内容[1]。植物的选择除了取决于植物本身对退化立地环境的适应性上,植物对立地环境的改良作用也非常重要。一般而言,植物对立地土壤环境的改良主要体现在对土壤性质改善,既包括植物对土壤物化性质上的改良,也包括植物对土壤生物属性的影响。土壤酶,作为土壤质量的重要生物活性指标[2],不仅是促进土壤物质转化的重要物质及土壤养分变化的重要参与者,而且还直接或间接影响着土壤一系列的生物化学反应,对生态系统的物质循环产生重要影响[3-4]。
土壤酶在一定程度上可以表征植物修复措施对土壤的改良作用[5-7]。不同生活型植物在土壤酶的改良效能上表现不同,如对黄土高原丘陵沟壑区的研究表明蔗糖酶和碱性磷酸酶表现为灌木>乔木>草本,而脲酶和过氧化氢酶则表现为乔木>灌木>草本。研究表明土壤有机质和氮含量对土壤酶活性具有重要的促进作用[8]。然而,在土壤磷素,尤其是土壤磷素含量较高的生态退化区域,不同生活型植物对土壤酶的影响目前还少见报道。
滇池是我国富营养化最严重的湖泊之一。滇池南岸作为我国著名的磷元素富集区,占据了滇池流域总面积的13%。退化山区土壤中极高的磷负荷极易产生淋溶和侵蚀并随着地表径流汇入滇池,进而对滇池水体安全构成了巨大的威胁[9]。有效恢复退化山区植被是控制水土流失及水体富营养化控制的有效措施之一。目前该区域内广泛分布着许多适生优势物种,但这些物种对土壤生物性质的影响还未见报道。因此,本研究选取滇池流域富磷退化山区不同生活型的优势物种云南松(Pinusyunnanensis),蔗茅(Erianthusrockii),白茅(Imperatacylindrica),马桑(Coriarianepalensis),紫茎泽兰(Eupatoriumadenophorum)为研究对象,分析不同物种根际土与根区土主要土壤酶的活性,比较不同植物对土壤酶活性的根际效应,并综合评价植物对土壤酶的影响,为富磷区植被的恢复等提供一定数据支持,并为滇池流域群落结构与功能改善及其他类似区域的生态修复、面源污染防治提供一定借鉴。
1 材料与方法
1.1 研究区概况
研究区域位于滇池流域南部的柴河子流域内,该区域是滇池流域富磷区的主要集中分布区,同时也是滇池流域3个面积超过300 km2的子流域之一。柴河子流域(24°36′—24°37′N,102°41′—102°42′E),海拔1 936~2 236 m,地貌为丘陵山地。河流自东南向西北汇入滇池,流域面积为306.18 km2,全长48 km。该区域干湿两季分明,年平均气温14.6℃,年平均降水量925.4 mm。土壤类型为山地黄红壤、棕红壤。该区域内土壤pH值为7.8,土壤全氮为0.71 mg/g,土壤全磷为7.31 mg/g,有机质为3.06%。该区域地带性植被为亚热带半湿润常绿阔叶林,因人类活动影响,几乎已没有成片分布。在受人工扰动的退化山地中,灌草丛及云南松林是该区域主要植物群落类型,马桑、蔗茅、白茅及外来物种紫茎泽兰是灌草丛主要优势物种,云南松是云南松群落的主要建群种。随后典型外来物种紫茎泽兰入侵该区域,并成为优势物种之一。
1.2 样品采集与处理
在柴河流域富磷退化山区选择典型的灌草丛及云南松林,并确定坡向、坡位相似的样地,各样地设3个样方,其中灌草丛和云南松林样方大小均为10 m×10 m,样地之间的距离不少于100 m。在灌草丛样方中随机选择植株高度相对一致的马桑、蔗茅、白茅及紫茎泽兰各9株生长良好的植株,每个样地各3株;在云南松样方中,选择6株高度及胸径相似且长势良好的云南松,每个样方各2株。
采集过程中,首先除去表面的枯枝落叶层,根据不同植物根系的分布空间,在0—20 cm的深度采集马桑、蔗茅、白茅及紫茎泽兰的植物根系,轻轻抖落附在根上的土壤作为根区土,剩下的根系和土壤在自封袋中抖动作为根际土。在0—30 cm的深度采集云南松的根区土和根际土,从云南松树干基部开始逐段、逐层挖去上层覆土,追踪根系的延伸方向,然后沿侧根找到须根部分,剪下分枝,并将须根带土取出,同样抖落须根上的土壤作为根区土,把粘附在细根上的土壤收集后作为根际土。土壤样品放于4℃的车载冰箱内带回实验室用于土壤酶活性的测定。
1.3 土壤酶分析
土壤酶活性测定参照《土壤酶及其研究法》[10]。其中土壤脲酶采用苯酚钠—次氯酸钠比色法;土壤磷酸酶采用磷酸苯二钠比色法;土壤蛋白酶采用茚三酮比色法;土壤纤维素酶采用二硝基水杨酸比色法。
1.4 数据处理与分析

2 结果与分析
2.1 不同植物根际土与根区土的脲酶活性
不同植物根际土与根区土的脲酶活性见图1,从图1可以看出:根区土脲酶含量为0.32~0.99 mg/(g·d),而根际土含量在1.47~2.60 mg/(g·d)。根际土脲酶含量从大到小顺序依次为:云南松>蔗茅>紫茎泽兰>
白茅>马桑。根区土脲酶含量从大到小顺序依次为:云南松>白茅>马桑>紫茎泽兰>蔗茅。方差分析表明根际土脲酶含量均显著高于根区土。对于根际土与根区土而言,云南松的脲酶含量无论是根际土还是根区土均显著高于其他4种植物。蔗茅、白茅、马桑和紫茎泽兰根际土与根区土之间均未有显著差异。
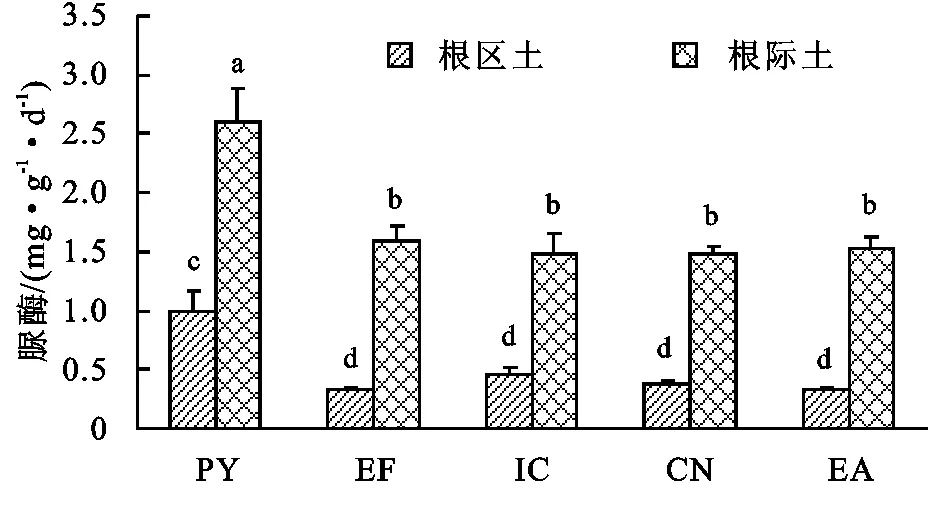
注:不同字母表示不同植物根际土与根区土的酶活性在0.05水平上具有显著差异,PY为云南松,EF为蔗茅,IC为白茅,CN为马桑,EA为紫茎泽兰,下图同。
图1 不同植物根际土与根区土的脲酶含量
2.2 不同植物根际土与根区土的磷酸酶活性
不同植物根际土与根区土的磷酸酶含量见图2,酸性磷酸酶含量为2.89~3.57 mg/(g·d),碱性磷酸酶含量为1.83~2.87 mg/(g·d)。其中根际土酸性磷酸酶含量均高于根区土,但只有蔗茅和马桑呈现显著差异,而云南松、白茅和紫茎泽兰根区土与根际土之间酸性磷酸酶含量并没有显著差异。根际土碱性磷酸酶含量也均高于根区土,但只有白茅未呈现显著差异,而云南松、蔗茅、马桑和紫茎泽兰根区土与根际土之间碱性磷酸酶含量都呈现出显著差异。

图2 不同植物根际土与根区土酸性及碱性磷酸酶含量
2.3 不同植物根际土与根区土的蛋白酶酶活性
不同植物根际土与根区土的蛋白酶含量见图3,其中根际土蛋白酶含量均显著高于根区土。对于根际土而言,紫茎泽兰的蛋白酶含量最高,为312.39 μg/(g·d),马桑的最低,为178.41 μg/(g·d),但蔗茅、白茅、云南松和紫茎泽兰之间并未呈现显著差异,只有马桑根际土的蛋白酶含量显著低于蔗茅、白茅和紫茎泽兰。对于根区土而言,白茅含量最高,为107.55 μg/(g·d),紫茎泽兰含量最低,为60.65 μg/(g·d),其中云南松、蔗茅、白茅和马桑之间的蛋白酶含量并无显著差异,但4种植物均显著高于紫茎泽兰的根区土蛋白酶含量。
2.4 根际土与根区土的纤维酶活性
不同植物根际土与根区土的纤维素酶含量见图4,其中紫茎泽兰根际土纤维素酶含量最高,为2.12 mg/(g·3 d),云南松根区土含量最高,为0.81 mg/(g·3 d)。根际土纤维素酶含量依次为:紫茎泽兰>马桑>蔗茅>白茅>云南松;根区土纤维素酶含量依次为:云南松>白茅>马桑>紫茎泽兰。其中紫茎泽兰的根际土中的纤维素酶含量显著高于白茅和云南松,云南松根区土中的纤维素酶含量显著高于其他4种。整体而言,除云南松外,其他4种植物对根际土纤维素酶的激发效应都比较高。

图3 不同植物根际土与根区土蛋白酶含量
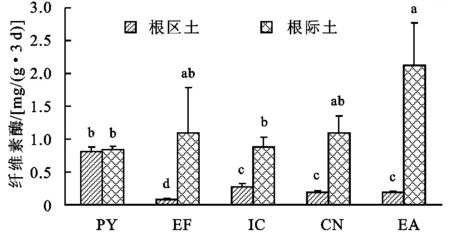
图4 不同植物根际土与根区土纤维素酶含量
2.5 不同植物对土壤酶的根际效应
不同植物对土壤酶的根际效应均表现为正的根系效应(表1)。其中蔗茅对脲酶、纤维素酶的根际效应比较明显,其根际效应为3.91,12.64;紫茎泽兰对脲酶、蛋白酶及纤维素酶的根际效应也比较明显,其根际效应分别为3.59,4.15,10.46。植物对酸性磷酸酶及碱性磷酸酶的根际效应都小于1,说明不同植物对磷酸酶的根际效应均不明显。针对不同土壤酶而言,5种植物对脲酶和纤维素酶的根际效应相对较强,其次为蛋白酶,最弱的为酸性磷酸酶及碱性磷酸酶。

表1 不同植物对土壤酶的根际效应
2.6 植物对土壤酶活性的综合影响效益
植物对土壤酶活性的综合影响效益见表2,植物对根区土土壤酶活性的综合影响效益最高的是云南松,其次依次为白茅、马桑、蔗茅和紫茎泽兰;植物对根际土土壤酶活性的综合影响效益最高的是紫茎泽兰,其次依次为云南松、蔗茅、白茅和马桑。综合根区土和根际土的综合影响效益,则表现为云南松对土壤酶活性的综合影响效益最高,蔗茅的最低,高低顺序依次为云南松>白茅>紫茎泽兰>马桑>蔗茅。
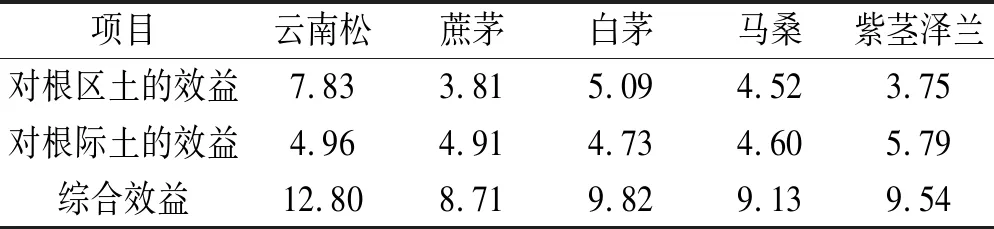
表2 不同植物对土壤酶活性的综合影响效益
3 讨 论
3.1 不同生活型植物对富磷退化山区土壤酶活性的影响
柴河流域富磷退化山区多分布于上坡位,能够在该区域存活生长的物种必须能够适应干旱、高磷、缺氮的环境[11]。通过前期调查发现,该区域大多分布耐旱、抗干扰能力较强的物种,且禾本科和菊科所占比例较大[12]。除此之外,在该区域还广泛分布着固氮物种马桑及滇中优势乔木云南松。分析比较常见优势物种在富磷退化山区中对土壤的改良作用对该区域的生态修复具有重要意义。
在富磷退化山区,土壤氮是限制因素,植物要生存就必须适应氮缺乏的生境,在这种生境下,植物通常通过根际分泌物以此增强根际土壤微生物的活性,进而增加对氮素的转化作用,以减少氮素对植物的影响。其中脲酶和蛋白酶都是土壤氮循环的重要组成成分,且均受到土壤氮素含量等因素的影响[13-16]。本研究结果表明不同植物对脲酶及蛋白酶活性的影响表现为云南松影响下的土壤脲酶活性最高,蔗茅、白茅及紫茎泽兰影响下的土壤蛋白酶活性最高,说明这几种植物可以通过影响土壤氮循环相关的酶活性来增加根际可利用氮含量,以适应缺氮环境;而马桑根际土脲酶及蛋白酶活性最低,原因可能是马桑作为固氮物种,本身生物学属性决定了可以从大气中固定氮,来适应低氮生境,故无需过多增加根际酶活性来提高氮的转化能力。
富磷退化山区土壤另外一个特征就是高磷环境。在较高的土壤磷素背景条件下,研究已表明高磷会限制磷酸酶的活性,减少土壤有机磷向无机磷转化[13]。本研究发现5种植物对根际土无论是酸性磷酸酶还是碱性磷酸酶的提高改善能力均不明显,这主要原因是当地富磷环境磷不再是影响植物生长的限制因子,因此植物不需花费能量来改善根际根区磷酸酶含量来增加磷素的转化[17],故植物对磷酸酶的影响并未像其他酶一样显著。
土壤纤维素酶是在碳素循环过程中一个很重要的酶,可将纤维素逐步分解为葡萄糖,进而提高土壤的碳源,促进其他养分的释放,从而有助于土壤微生物的生长,对土壤有显著的改良作用,因此纤维素酶活性是表征土壤微生物和土壤肥力的重要标志[18-19]。纤维素酶的活性主要决定于输入土壤有机质物料的性质,尤其是其碳氮比[20-21]。相比其他植物,云南松根区土壤纤维素酶活性较高,可能是由于当地云南松林有较厚的凋落物层,增加了土壤的C/N,促进了土壤纤维素分解菌的繁殖[18]。对于根际土,紫茎泽兰根际土纤维素酶活性最高,说明紫茎泽兰通过增加纤维素酶提高根际可利用碳,以增加根际微生物生物量,促进土壤养分循环[22]。
3.2 不同生活型植物对土壤酶活性的根际效应
不同植物根际土与根区土的所有酶活性均呈现出根际土高于根区土,即表现出一定的正根际效应。这主要有两个方面的原因:一是根系能够分泌酶类物质进入土壤,二是土壤酶活性与微生物是分不开的,根系直接影响的土壤范围是微生物特殊的生境,根际内微生物数量总是比根际外要高得多,当微生物受到环境因素刺激时,便不断向周围介质分泌酶,致使根际内外酶活性存在很大的差异[23-24]。根际土壤酶活性的提高,将有利于可利用性氮养分在根际中累积,进而有助于土壤养分的循环。在5种植物中,紫茎泽兰作为外来入侵物种,可明显改变入侵土壤的理化性质,进而影响土壤微生物的群落结构和代谢[23]。研究发现紫茎泽兰入侵通过改变土壤理化性质和土壤微生物群落结构,进而促进土壤酶活性,显著提高了土壤脲酶、磷酸酶、蔗糖酶的活性,为自身生长创造了有利的土壤环境[25]。在5种土壤酶中,其中脲酶和纤维素酶表现出的根际效应较高,说明在富磷退化山区,氮和碳作为限制因子在一定程度上制约植物的生长,因此,植物通过提高其根际效应来缓解或减少氮、碳对植物生长的限制作用。
通过植物对土壤酶活性的综合影响效益比较来看,云南松最高,蔗茅的最低。但是蔗茅在对土壤脲酶及纤维素酶上的根际效应明显。说明其对富磷退化山区具有较高的适应性。因此单从通过酶活性筛选富磷退化山区的修复植物还不够全面,应结合其他参数,如理化性质、生态水文过程及在群落构建过程中的作用等综合评价不同植物的修复效能,以期在实际生态修复中达到理想的效果。
4 结 论
(1) 云南松影响下的根区土及根际土脲酶活性最高,分别为0.99,2.60 mg/(g·d);紫茎泽兰影响下的土壤蛋白酶活性最高,为312.39 μg/(g·d);云南松根区土及紫茎泽兰根际土其纤维素酶活性最高,分别为0.81,2.12 mg/(g·3 d);5种植物其土壤酸性及碱性磷酸酶活性变化较小。
(2) 通过根际效应比较发现5种植物对脲酶和纤维素酶的根际效应相对较强,其次为蛋白酶,最弱的为酸性磷酸酶及碱性磷酸酶。
(3) 结合植物对根区土及根际土酶活性的影响进行综合效应比较,5种植物高低顺序依次为云南松>白茅>紫茎泽兰>马桑>蔗茅。土壤酶活性高低不仅可以反映植物对土壤生物性质的影响,也能反映植物对立地环境的适应方式,因此,评价植物在富磷退化山区的恢复潜力,还应结合植物对土壤理化性质、生态水文过程及在群落构建过程中的作用等进行综合评价。
