马齿苋结合态多酚和自由态多酚抑制肝癌细胞HepG-2增殖及诱导细胞凋亡的研究
2019-06-24王浩毓赵惠玲李宏全
王浩毓,赵惠玲,李宏全*
(1.山西农业大学 动物科技学院,山西 太谷 030801;2.太原师范学院 生物系,山西 太原 030012)
原发性肝癌是一种常见的恶性肿瘤,在全世界恶性肿瘤的发病率中占第5位,在肿瘤引起死亡的排名中居于第3位[1],具有高发病率、高侵袭性、高转移率、预后差等临床特点。因其发病的分子机制至今没有明确而成为较为难治疗的疾病之一[2]。随着早期诊断技术的提高,患者的存活率也开始有一定提高,但仍有一部分晚期肝癌难以切除,且易转移和复发[3]。肝癌的治疗方法主要是综合治疗,包括化疗、放疗、手术切除、免疫治疗以及介入治疗等[4]。单孔腹腔镜的普及为肝癌的手术治疗做出了一定的贡献,为减轻患者疼痛,减少术后感染提供了保障,但对于晚期肝癌来说,并未做到根本性改善[5]。除此之外,临床上还有射频消融 (RFA)、高频热疗 (HFH) 以及树突状细胞-细胞因子诱导的杀伤细胞 (DC/CIK)等较为新型的治疗方式,但因投入应用的案例还较少,而无法详细了解其疗效[6]。到目前为止,依然没有出现能彻底消灭癌细胞,并且副作用较小的治疗方案。因此,开发高效、低毒的新型抗肝癌药物仍是当务之急。
马齿苋(PortulacaoleraceaL.)是我国一种传统中药材,具有清热解毒、凉血止血的功效,主治热痢脓血、热淋、带下、痛肿恶毒、丹毒[7],其提取物已被证实具有抗氧化、抗肿瘤[8]、增强免疫、抗衰老[9]、抗炎、抑菌[10]、保护神经元[11]、降血糖[12]等作用。马齿苋中含有槲皮素、山柰酚、木犀草素[13]以及3,4-二羟基苯乙醇等[14]多种多酚。
多酚是广泛存在于植物性食物中一种化合物,具有很好的抗氧化作用,且经流行病学数据证明是安全无毒的,并对人类健康有持久有利的影响[15]。近年来,人们对多酚进行了更加深入的研究,并发现该化合物具有除抗氧化外还具有更广泛的作用。于萍[16]曾发现葡多酚可促进正常乳腺细胞的增殖活性并呈现剂量效应关系,但对乳腺癌细胞增殖活性有抑制作用且呈一定的浓度依赖关系。Shan等[17]从枣中提取结合态多酚,并发现其在裸鼠肿瘤模型中表现出了抗肿瘤活性,且对正常器官不造成损伤。史江颖等[18]发现谷糠结合态多酚对人肝癌细胞(HepG-2)、人宫颈癌细胞(Hela)、人乳腺癌细胞(MCF-7)、人结肠癌细胞(HCT-7)具有显著的增殖抑制作用。
多酚根据其存在的形态可分为自由态(或游离态)多酚和结合态多酚。自由态多酚一般为单体形式,并以物理方式吸附于植物性食物基质中。因此,自由态多酚易溶于有机溶剂或水。结合态多酚则是由共价键与植物细胞壁等基质结合,因此较难提取,一般采取酸或碱水解提取。本文以马齿苋自由态多酚(free polyphenol inPortulacaoleraceaL, FPPO)和结合态多酚(bound polyphenol inPortulacaoleraceaL., BPPO)为干预材料,以肝癌细胞HepG-2为模型,对马齿苋多酚抑制HepG-2肝癌细胞增殖及诱导HepG-2凋亡作用进行了初步研究,旨在寻找低毒有效的抗肝癌药物。
1 材料和方法
1.1 试验材料
1.1.1 细胞株
肝癌细胞株 HepG-2,由山西省肿瘤医院中心实验室郭素堂教授惠赠。
1.1.2 药物与试剂
马齿苋 (PortulacaoleraceaL.) 采集于山西省寿阳县朝阳镇中曲村的田间,并由北京师范大学生命科学学院刘全儒教授鉴定,确认为野生马齿苋;Caspase-3、Caspase-8、Caspase-9酶活性检测试剂盒、Bradford法蛋白检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、JC-1线粒体膜电位检测试剂盒均购于碧云天生物技术;RPMI Medium1640培养基、二甲基亚砜、胰蛋白酶、没食子酸、磷酸二氢钾、氯化钠、氯化钾、碳酸钠、盐酸、丙酮、正己烷、乙酸乙酯、氢氧化钠等均购于北京索莱宝;四季青无支原体胎牛血清购于浙江天杭生物科技股份有限公司。
1.1.3 主要仪器
流式细胞仪购自美国BD公司;离心机购自德国Hettich科学仪器公司;超纯水仪购自英国ELGA公司;分光光度计购自中国济南博华仪器有限公司;CO2培养箱购自英国RS Biotech公司;倒置显微镜购自日本OLYMPUS株式会社;酶标购自瑞士TECAN公司。
1.2 试验方法
1.2.1 马齿苋结合态与自由态多酚的提取与含量测定
自由态多酚的提取:将采集到的马齿苋室温下干燥,用粉碎机粉碎成粉末,过80目筛,分析天平称取20 g粉末,加入-20 ℃预冷的75%丙酮500 mL 搅拌20 min,4 000 r·min-1离心10 min,收集上清液,沉淀按上述步骤再处理一遍并收集上清。将2次收集到的上清液 45 ℃ 旋转蒸发至200 mL,并依次分装在10 cm 培养皿中,经冷冻干燥机持续处理24 h,即得到FPPO[17]。
结合态多酚的提取:将提取自由态多酚后的残留物中加入200 mL 2 mol·L-1的NaOH 进行消化反应,室温下搅拌1 h,加HCl 使 pH=7以终止反应,再加入200 mL己烷,反应20 min除去脂质,4 000 r·min-1离心10 min, 收集上清,重复上述步骤一次。将收集到除脂后的液体中加入200 mL 乙酸乙酯提取20 min, 4 000 r·min-1离心10 min, 收集除脂的液体,重复上述步骤3次。将提取液45 ℃旋转蒸发至200 mL,真空冷冻干燥,最终得到BPPO[17]。
马齿苋多酚的含量测定:以没食子酸为标准品,福林酚法检测多酚的浓度,以标准曲线为y=0.1932x-0.0207(R2=0.994)计算自由态和结合态多酚的含量。
1.2.2 HepG-2细胞培养
冷冻的HepG-2细胞复苏后,在无菌操作状态下接入细胞培养瓶中,加入含10%的胎牛血清1640培养基,放到37 ℃、5% CO2培养箱中培养。期间观察更换培养基。待HepG-2细胞对数生长至培养瓶底95%时,传代培养。
1.2.3 MTT法检测FPPO和BPPO对HepG-2细胞的抑制率
当HepG-2细胞对数生长至培养瓶底的95%时,0.2%胰酶消化,1 000 r·min-1离心5 min,1640培养基悬浮,调整细胞浓度为6×104个·mL-1,每孔100 μL接入96孔板中,37 ℃、5% CO2培养箱中培养过夜,更换新的加入多酚的培养基,多酚浓度梯度为0、0.05、0.1、0.15、0.2、0.3、0.4 g·L-1,每个浓度平行5个孔,培养12 h、24 h和36 h后,加入20 μL MTT, 37 ℃、5% CO2培养箱中培养4 h后,吸去液体,加入150 μL DMSO,酶标仪摇动10 min,570 nm波长测定吸光度值。根据抑制率/%=(A对照组-A实验组)/A对照组×100%计算不同浓度和不同时间多酚作用下的抑制率。
1.2.4 细胞形态学观察
将传代培养的HepG-2细胞调整浓度至5×104个·mL-1,接入12孔板中,每孔1 mL,37 ℃、5% CO2培养箱培养12 h且完全贴壁后,更换新的加入多酚的培养基,多酚浓度梯度为0、0.1、0.2、0.3 g·L-1,培养24 h,OLYMPUS倒置显微镜拍照(20X)观察。
1.2.5 流式细胞术实验
1.2.5.1 BPPO对HepG-2细胞周期影响实验
传代悬浮的HepG-2细胞,调整浓度至5×104个·mL-1,接入直径6 cm的皿中,每皿3 mL,摇匀,37 ℃、5% CO2培养箱中培养过夜,更换含有BPPO的培养基,BPPO浓度分别为0、0.1、0.2、0.3 g·L-1,每个浓度重复3次。培养24 h后,0.2%胰酶消化,PBS洗涤2次,70%酒精固定24 h,PBS洗涤固定液,调整细胞浓度为1×106个·mL-1,加入100 μL RNaseA,再加入400 μL PI,避光反应30 min,流式细胞仪检测。
1.2.5.2 BPPO诱导HepG-2细胞凋亡实验
HepG-2细胞传代、铺皿、BPPO干扰、胰酶消化PBS洗涤离心后,加入195 μL AnnexinV-FITC结合液,5 μL AnnexinV-FITC,10 μL碘化丙啶,摇匀,避光反应15 min,流式细胞仪检测。
1.2.5.3 BPPO对HepG-2细胞线粒体膜电位影响实验
HepG-2细胞BPPO干扰、胰酶消化、PBS洗涤与1.2.5.1相同,PBS洗涤离心后,加入1640培养基和JC-1染色工作液各500 μL,37 ℃恒温箱中温浴20 min,JC-1染色缓冲液洗涤离心后悬浮HepG-2细胞,流式细胞仪检测。
1.2.6 BPPO对HepG-2细胞Caspase-8、Caspase-3、Caspase-9酶活性影响实验
HepG-2细胞经BPPO干扰、胰酶消化、PBS洗涤离心后,加入100 μL裂解液,冰浴裂解15 min,根据Caspase-3、Caspase-8、Caspase-9检测试剂盒说明书加样,摇匀后37 ℃反应90 min,酶标仪检测A405吸光度值,计算Caspase酶活力单位。
1.3 统计分析
每个样品至少3次重复,结果以平均值±标准差(mean ± SD)表P<0.05示。方差分析及相关性分析采用SPSS 22.0统计软件分析,多重比较采用S-N-K法。柱形图、线型图采用SPSS 22.0软件绘制。细胞周期图、细胞凋亡图、线粒体膜电位图由FACSCalibur流式细胞仪生成。显著性水平为P<0.05 或P<0.01。
2 结果与分析
2.1 马齿苋结合态多酚和自由态多酚的含量
丙酮作为常用的有机溶剂可以将FPPO溶出,并去除大部分杂质。用NaOH处理残留物,可以使BPPO与植物基质间的化学键高效水解,游离到溶剂当中。利用福林酚法检测多酚含量,代入用没食子酸建立的标准曲线中,测得BPPO浓度约为5.912 g·L-1,FPPO为8.267 g·L-1。20 g马齿苋干粉末最终提取出约71 mg BPPO,264.5 mg FPPO。FPPO的提取率显著高于BPPO(见表1)。
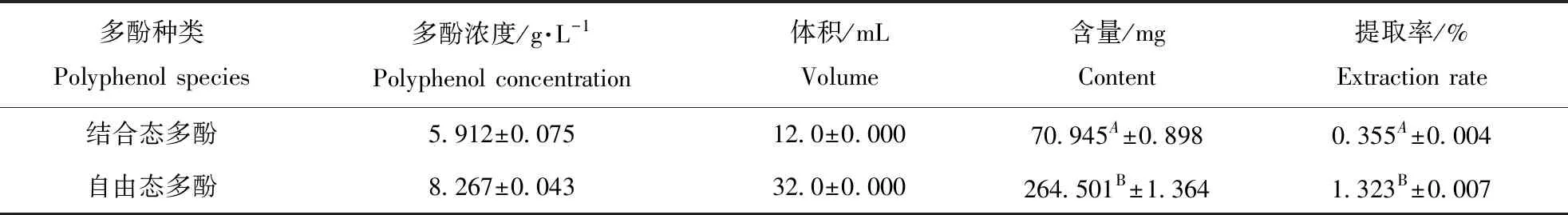
表1 BPPO和FPPO含量/mgTable 1 The contents of bound and free polyphenols in Portulaca oleracea L.
注:A、B、C...等大写字母表示检测指标达到0.01显著性水平差异,a、b、c...等小写字母表示检测指标达到0.05显著性水平差异。
Note:the capital letters (A, B, C etc) indicate that the significant differences between each of detection indexes have reached a level of 0.01 (P<0.01), the lower case letters (a, b, c etc) indicate that the significant differences between each of detection indexes have reached a level of 0.05 (P<0.01).
2.2 马齿苋两种形态多酚对HepG-2肝癌细胞的抑制作用
BPPO对HepG-2细胞的抑制率呈剂量依赖性增长,0.4 g·L-1时抑制率最高(图1,图2)。随着处理时间的增加(12、24、36 h),其抑制率也逐步变强,36 h、0.4 g·L-1下的作用效果最强,抑制率达到了73%(见图1右)。FPPO由于作用效果太弱,在12、24 h抑制率几乎为0(图1B)。在相同时间内,BPPO对HepG-2的抑制作用在各浓度梯度上(0.0、0.05、0.1、0.15、0.2、0.3、0.4 g·L-1)均明显强于FPPO(图2)。
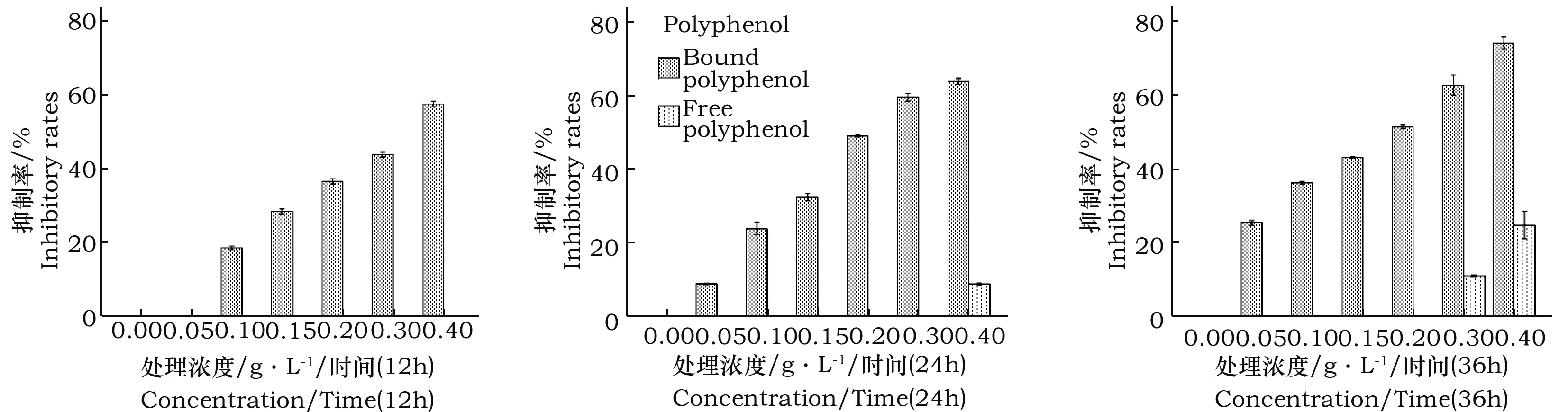
图2 相同处理时间、不同处理浓度下FPPO与BPPO对HepG-2肝癌细胞的抑制率比较Fig.2 Inhibition analysis of FPPO and BPPO on HepG-2 hepatoma cells at same treatment time
为了更明了地探究BPPO对HepG-2抑制效果与处理时间的关系,我们计算了结合态多酚不同处理时间下的IC50值。随着作用时间延长,IC50值极显著地减小。12 h、24 h、36 h的IC50值依次为0.325、0.273、0.216 g·L-1,三者之间均达到极显著性差异(P<0.01)。这说明BPPO对HepG-2细胞的抑制作用随着时间的延长而显著增强(图3)。
2.3 BPPO对HepG-2肝癌细胞形态结构的影响
由图4可见,在倒置显微镜下观察HepG-2肝癌细胞经BPPO处理24 h后的细胞形态,对照组细胞形态呈梭形,细胞之间紧密连接,贴壁牢固;HepG-2肝癌细胞经BPPO处理5 h开始回缩,逐渐变圆,细胞形态变化与BPPO的作用时间和浓度呈正相关,随着BPPO浓度增加,细胞变圆的数量增加,随着作用时间不断延长,圆形细胞脱离培养皿底部,漂浮到细胞培养液中。
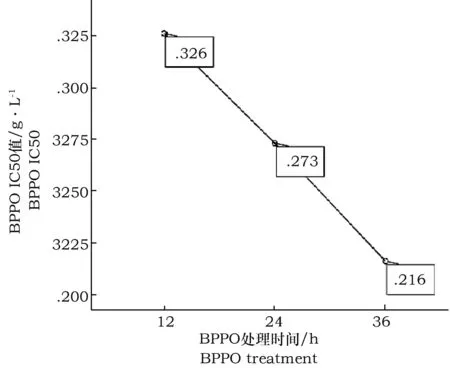
图3 BPPO不同时间作用于HepG-2肝癌细胞的半抑制浓度Fig.3 The half maximal inhibitory concentration of BPPO on HepG-2 cells at different time

图4 不同浓度BPPO作用下的HepG-2肝癌细胞形态图Fig.4 The HepG-2 cells’ morphology after treated by different concentration of BPPO
2.4 BPPO对HepG-2肝癌细胞周期的影响
本试验利用流式细胞仪检测了BPPO对HepG-2肝癌细胞周期分布的影响,由图5可见,与对照组相比,随着处理浓度的增加G1期细胞比例呈剂量依赖性显著下降(P<0.01);随着处理浓度的增加S期细胞的比例呈剂量依赖性增加(P<0.05),且除低剂量组之外,均极显著地高于对照组(P<0.01);G2期细胞比例随着处理浓度的增加呈剂量依赖性下降(P<0.05)。以上差异均具有统计学意义。这说明BPPO将HepG-2细胞阻滞在了S期。
2.5 BPPO对HepG-2肝癌细胞凋亡的影响
图6结果显示,在BPPO作用下,随着处理浓度增加,正常细胞的比率极显著地降低,早期凋亡和晚期凋亡的细胞比率极显著地增加。且在早期凋亡中,相比于对照组的1.72%,高剂量组的凋亡比例增加到了 54.62%,达到极显著性差异(P<0.01)。
2.6 BPPO对 HepG-2肝癌细胞Caspase-3、Caspase-8、Caspase-9酶活性的影响
图7结果表明,随着马齿苋结合态多酚处理浓度的增加,HepG-2肝癌细胞中Caspase-3、Caspase-8 酶活性随着处理浓度的增加,酶活性极显著地提高,在0.0、0.1、0.2、0.3 g·L-1浓度相互之间均达到极显著性差异(P<0.01)。Caspase-9酶活性也是随着BPPO处理浓度的增加而增加,0.1 g·L-1浓度处理与对照之间差异极显著(P<0.01),0.2、0.3 g·L-1处理与对照和 0.1 g·L-1浓度处理之间存在极显著差异(P<0.01)。
2.7 BPPO对HepG-2肝癌细胞线粒体膜电位的影响
图8为JC-1法检测的HepG-2肝癌细胞线粒体膜电位,结果显示,随着BPPO处理浓度的增加,线粒体膜电位下降程度极显著地提高,由对照组的 11.41%增加到了高浓度组的54.52%,达到极显著性差异(P<0.01)。
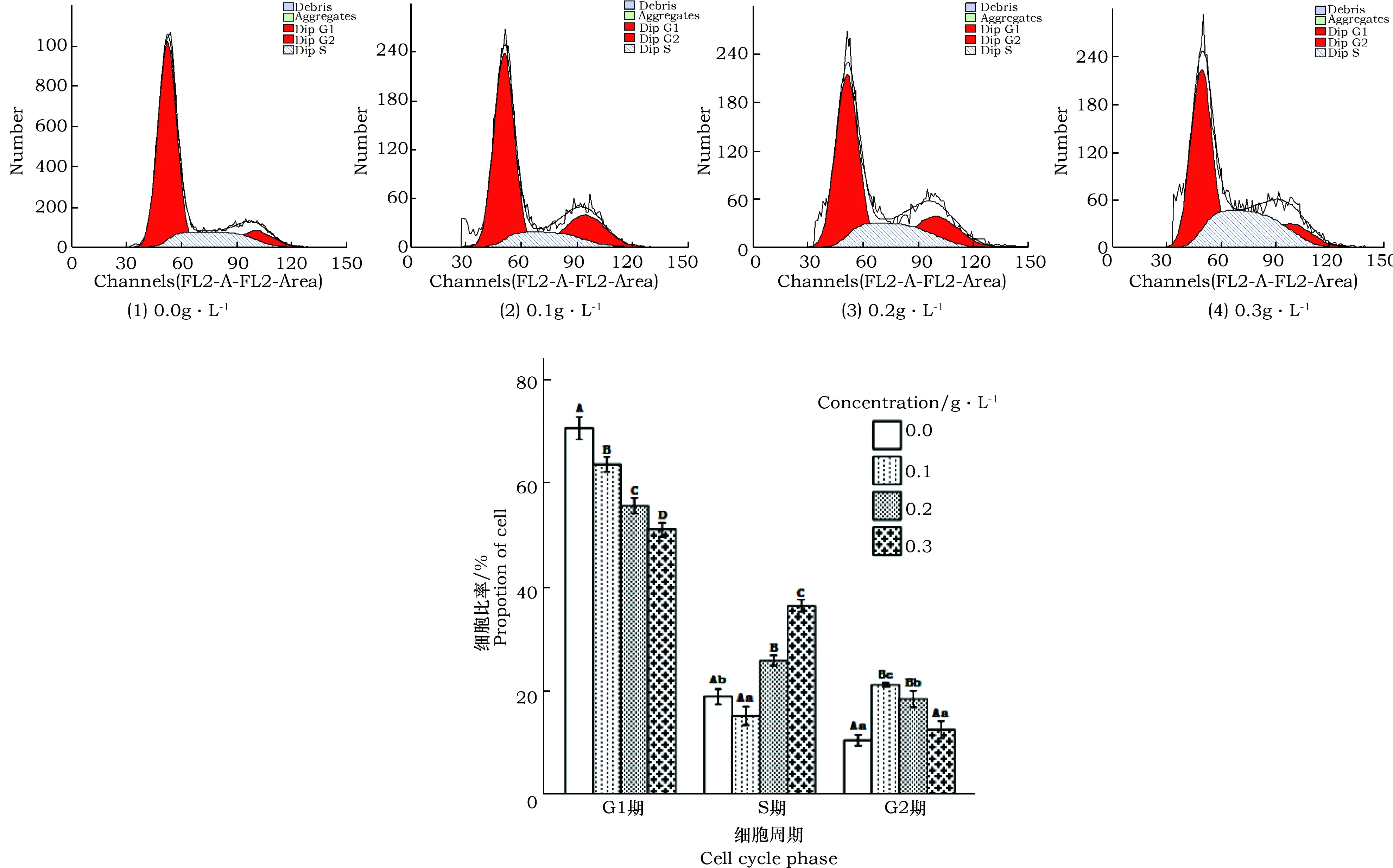
图5 不同浓度BPPO作用下的HepG-2肝癌细胞周期图Fig.5 The cell cycle diagrams of HepG-2 hepatoma cells after treated by different concentration of BPPOA、B、C...等大写字母表示检测指标达到0.01显著性水平差异,a、b、c...等小写字母表示检测指标达到0.05显著性水平差异,下图同。The capital letters (A, B, C etc) indicate that the significant differences between each of detection indexes have reached a level of 0.01 (P<0.01), the lower case letters (a, b, c etc) indicate that the significant differences between each of detection indexes have reached a level of 0.05 (P<0.01), the same as the figures below.
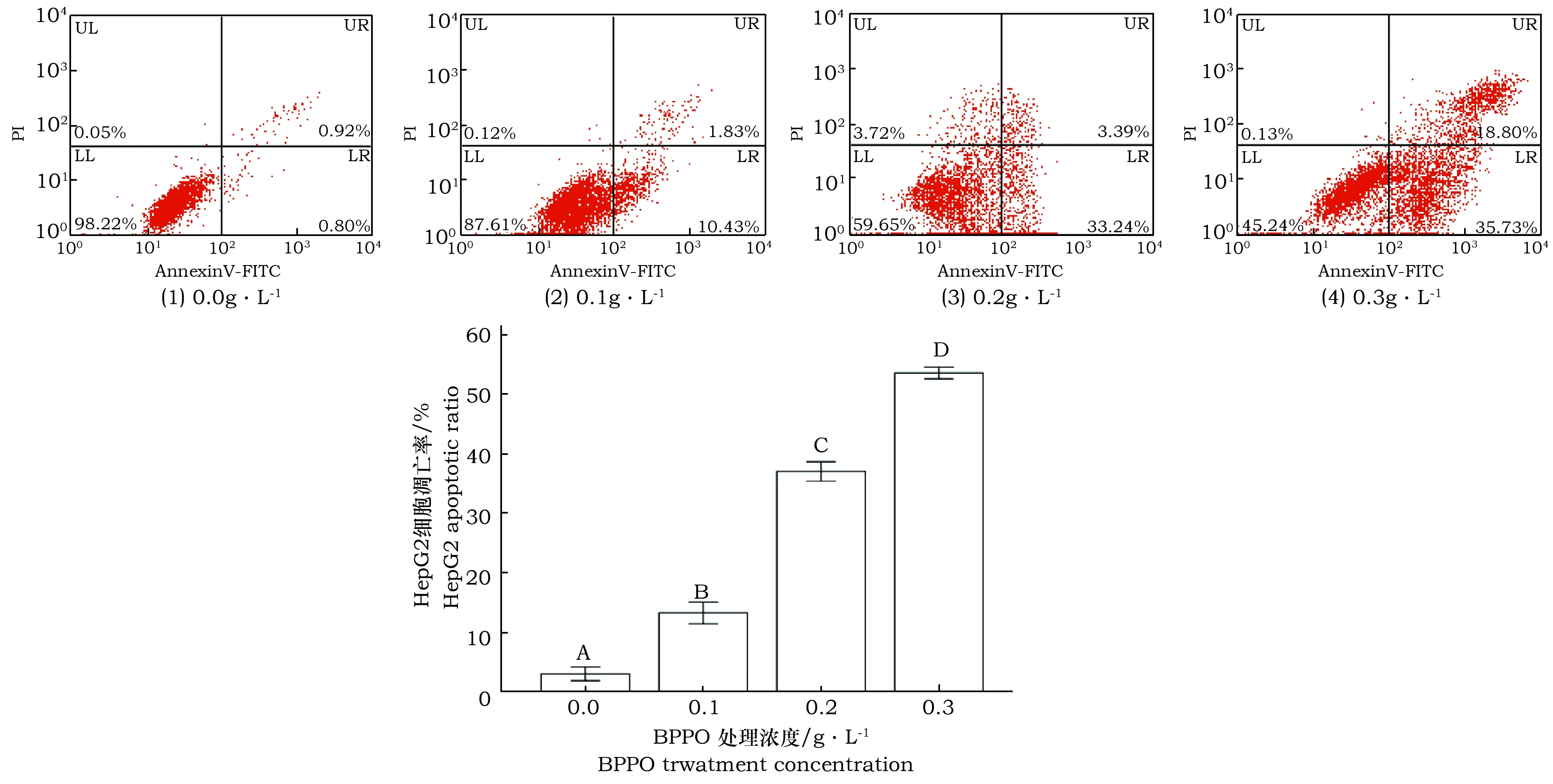
图6 AnnexinV-FITC染色检测到的HepG-2肝癌细胞凋亡图Fig.6 Apoptosis diagram of HepG-2 hepatoma cellsdetected by Annexin V-FITC staining after BPPO treatmentLL象限代表活细胞;LR象限代表早期凋亡;UR象限代表晚期凋亡;UL象限代表坏死。The LL quadrant represents living cells; the LR quadrant represents early apoptosis; the UR quadrant represents late apoptosis; the UL quadrant represents necrosis.

图7 BPPO对HepG-2 细胞Caspase-3、Caspase-8、Caspase-9酶活性影响Fig.7 Effects of BPPO on Caspase-3, Caspase-8 and Caspase-9 enzymes activity in HepG-2 cells

图8 JC-1法检测HepG-2肝癌细胞线粒体膜电位图Fig.8 Mitochondrial membrane potential detected by JC-1on HepG-2 hepatoma cells after treatment of different BPPO concentration
3 讨论
3.1 关于马齿苋多酚
马齿苋是一种常见的一年生草本植物,具有抗氧化、抗衰老和改善认知的功能。马齿苋抗肿瘤的作用在近年来也得到了验证。 Zhao等[19]研究表明,马齿苋中的水溶性多糖POL-P3b可以显著抑制宫颈癌HeLa细胞;Shen[20]发现马齿苋中的多种糖类都可以抑制sacroma 180在小鼠体内的增长。
多酚是植物次生代谢产物,广泛存在于蔬菜和水果以及种子的麸皮中[21]。多酚的主要功能为抗氧化和抗微生物[22]。近年来,人们发现多酚具有一定的抗癌作用。董丽华[23]研究发现,茶多酚能显著抑制人结肠癌Caco-2细胞,并诱导其凋亡;高晓天[24]研究发现白藜芦醇可诱导人肺癌细胞凋亡;章迅[25]研究发现石榴皮多酚能够抑制MDA-MB-231乳腺癌细胞的增殖。多种多酚都对HepG-2肝癌细胞具有抑制作用,史江颖[18]研究表明,谷糠结合态多酚对HepG-2肝癌细胞有明显的增殖抑制作用;Shan[17]研究表明,枣结合态多酚对HepG-2肝癌细胞也有明显的增殖抑制作用。
马齿苋富含山柰酚、芹黄素、木犀草素、杨梅素和槲皮素等多酚类化合物。因此,研究马齿苋中多酚的抗癌作用具有很大的临床意义,为天然药物治疗和缓解癌症提供了一定的基础理论依据。本实验从马齿苋中提取了BPPO和FPPO2种类型的多酚,并详细研究了该多酚对HepG-2肝癌细胞的抑制作用。
3.2 BPPO抑制HepG-2肝癌细胞增殖
本研究利用MTT法检测BPPO和FPPO对HepG-2细胞抑制率,结果表明(图1),BPPO能够抑制HepG-2肝癌细胞增殖,并具有时间和浓度依赖性,36 h BPPO的IC50值达到最低,为0.216 g·L-1(图3)。BPPO在24 h对HepG-2的IC50值为0.273,相同时间下谷糠结合态多酚对HepG-2的IC50值为0.84 g·L-1[18],枣结合态多酚对HepG-2的IC50值为0.3 g·L-1[17],均高于本实验的测定值,表明不同来源的结合态多酚对HepG-2肝癌细胞的敏感性是不同,BPPO的抑制作用优于枣结合态多酚和谷糠结合态多酚。
FPPO对HepG-2肝癌细胞作用相对较弱,其作用浓度0.4 g·L-1、作用时间36 h时抑制率仅为15.7%,抑制率达到30%以上时,才能确定细胞会发生凋亡,故本文着重对BPPO做了研究。
3.3 BPPO对HepG-2肝癌细胞周期的影响
S期是细胞DNA合成期。组蛋白也是在这一时期合成,染色体的构成离不开组蛋白。本研究结果表明,BPPO将HepG-2细胞阻滞在S期,而对该细胞的G1期和G2期没有显著影响,而G2期的细胞含量少于G1期和S期。说明BPPO可能破坏了HepG-2细胞内的碱基,损伤的碱基不能进行DNA合成,使G1期细胞减少,使G2期细胞无法大量合成有丝分裂所需蛋白,从而抑制肿瘤细胞的增殖,促进HepG-2肝癌细胞凋亡。BPPO还可能通过影响组蛋白的乙酰化修饰,进而影响细胞内的DNA的合成,这一推测还有待进一步探究[26]。Shan等[17]发现枣结合态多酚可将HepG-2肝癌细胞周期阻滞在S期,与本研究中的 BPPO作用结果一致。
3.4 BPPO诱导HepG-2肝癌细胞凋亡
本研究通过利用Annexin V/PI双染法流式细胞术(图5)证明了BPPO可诱导HepG-2肝癌细胞的凋亡。在此基础上,本研究通过探究BPPO对HepG-2肝癌细胞线粒体膜电位的影响以及其对膜受体通路的影响来进一步说明BPPO对 HepG-2细胞凋亡的作用机制。
在膜受体凋亡通路中,Caspase 8是关键,它在被诱导活化后可激活其效应物Caspase 3。Caspase 3 经激活后可水解成活性酶的形式,形成级联反应,催化DNA修复酶(polyADP-ribosepolymerase,PARP)的裂解,并在其他酶的协同作用下裂解整个细胞[27]。
经证明,多酚具有诱导Caspase 8激活的功能。李萍等[28]发现茶多酚能够激活ACC-M细胞中Caspase8, Gupta等[29]发现茶多酚可诱导人类前列腺癌细胞Caspase8活性增加。本研究利用Caspase检测试剂盒对BPPO作用下的HepG-2细胞中的Capase 8、Capase 3和Capase 9进行检测。结果显示Caspase 3和Caspase 8均有所升高,从而证明了BPPO通过膜受体通路诱导HepG-2细胞凋亡。此外,由于Caspase 9也升高,因此可推测HepG-2的凋亡和线粒体膜电位降低有关。
线粒体的变化同样可以诱导细胞凋亡。在细胞凋亡前期,细胞膜电位的降低,可使具有调控能量代谢和细胞凋亡双重功能的 CytC等释放于胞浆内,并与细胞凋亡酶活化因子1结合,在dATP的帮助下激活Caspase 9,进而激活Caspase 3,从而形成级联反应,使细胞凋亡[30]。同时,线粒体膜的损伤,也会使线粒体呼吸链受损,导致生成细胞三磷酸腺苷减少,加速了细胞凋亡进程[31]。
本研究在BPPO作用于HepG-2使其Caspase 9升高的基础上,对其线粒体膜电位进行检测。结果显示在BPPO处理后的HepG-2细胞的线粒体膜电位显著下降,从而证明BPPO可通过线粒体介导的内源性凋亡通路诱导细胞凋亡。
本研究表明,对HepG-2细胞而言,BPPO对其有较强的抑制作用,且呈剂量依赖型。FPPO对HepG-2细胞的影响则不明显。此外,BPPO很可能是通过通过激活膜受体通路和线粒体介导的内源性凋亡通路诱导HepG-2细胞凋亡,从而对肝癌细胞起到抑制作用。
肝癌由于其易复发易转移的特点,而成为一种很难治愈的疾病。近年来,人们不断尝试新的治疗方法,旨在摆脱毒副作用大的传统疗法。一些生物类药物在这方面取得一定进展,但仍不能成为符合预期的高效药物。马齿苋多酚作为一种纯天然提取物,在减少身体损伤,提高治愈率方面,具有很好的前景。
马齿苋的自由态多酚与结合态多酚对肝癌细胞的抑制功效的差异很可能是因为两者所含的酚类化合物有所不同。因此,我们下一步将基于此推测,对马齿苋多酚的种类进行更深入的研究,以期找到对肝癌细胞作用最大的酚类化合物,并利用小鼠模型探究其体内功能。
4 结论
综上所述,BPPO可以显著抑制HepG-2肝癌细胞的增殖,且具有时间和浓度依赖性,同时对细胞的形态也有明显的影响。BPPO可以阻滞HepG-2肝癌细胞周期至S期,并诱导细胞凋亡。Caspase-3、Caspase-8、Caspase-9酶活性的升高和细胞线粒体膜电位的下降表明,BPPO诱导细胞凋亡是通过是激活膜受体通路和线粒体介导的内源性凋亡通路来完成的。
