大豆HMGR基因家族的鉴定与表达分析
2019-06-24刁秀楠斛如媛高春艳张永坡王敏杜维俊赵晋忠岳爱琴
刁秀楠,斛如媛,高春艳,张永坡,王敏,杜维俊,赵晋忠*,岳爱琴*
(1.山西农业大学 文理学院,山西 太谷 030801;2.山西农业大学 林学院 山西 太谷 030801;3.山西农业大学 农学院,山西 太谷 030801)
大豆皂苷是大豆(Glycinemax(Linn.) Merr.)中一类重要的次生代谢产物[1],在植物生长发育过程中具有重要的生物功能,可引起植物的防御反应,使植物对病原菌、病毒和害虫等产生抗性[2~4]。大豆皂苷对人体也具有多种有益的生理功能,如抑制肿瘤细胞的增殖生长、抗脂质氧化、抗动脉粥样硬化以及通过促进甲状腺激素的分泌保护肝脏[5~8]。同时在工业生产中具有巨大的应用价值,可开发成发泡剂、乳化剂和稳定剂[9,10]。
大豆皂苷是三萜烯类化合物,主要由甲羟戊酸(MVA)途径合成。3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)是甲羟戊酸途径上游的第一个关键酶,不可逆的催化3-羟基-3-甲基戊二酰辅酶A(HMG-COA)生成MVA,是大豆皂苷合成途径的重要调控位点之一[11,12]。目前已从拟南芥[13]、水稻[14]、甜瓜[15]、欧榛[16]、长春花[17]、红豆杉[18]、丹参[19]、人参[20]、积雪草[21]、苦楝树[22]等多种植物中分离克隆出相应的HMGR基因。HMGR基因在植物中以基因家族形式存在,具有个数不等的同源基因。如:拟南芥中含有2个[13],橡胶树中存在5个[23],雷蒙德氏棉基因组中鉴定出9个[24]。同一植物中HMGR家族成员之间表达模式有差异,对MVA途径中碳流的调控具有重要作用[19,25]。
目前对于大豆HMGR基因家族在大豆皂苷合成途径中的调控机制的研究较少,因此,本研究通过对大豆HMGR基因家族进行鉴定、生物信息学分析和表达模式分析,为今后深入研究大豆皂苷的合成及大豆品质改良提供理论指导。
1 材料与方法
1.1 试验材料
1.1.1 大豆幼苗的培养
挑选籽粒饱满的武乡小黑豆种子,均匀的置于育苗盘中,盖两层湿润纱布,避光25 ℃发芽培养。选取胚轴3 cm左右且长势相同的发芽种子,将其转移至蛭石的营养钵中,每个营养钵中点播3粒,培养条件为25 ℃,光照16 h,黑暗8 h。待培养15 d长至三叶期后,取大豆幼苗根、茎、叶不同组织,立刻置于液氮速冻,在-80 ℃冰箱保存备用。
1.1.2 不同发育时期大豆籽粒的取样
2016年将武乡小黑豆种植于山西农业大学农作站。开花期对开花同一时间且在同一部位的花进行挂牌标记,分别在开花后25、32、40、50、60、70 d取大豆荚,立即剥取籽粒于液氮速冻,生物学重复3次,置于-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1GmHMGR基因家族的鉴定及生物信息学分析
利用Pfam数据库、HMMER3.0、PFAM和SMART软件搜索鉴定大豆基因组中的HMGR基因家族成员。利用ProtParam(http://web.expasy. org/protparam/)预测其理化性质,SOPMA(http://bip.weizmann.ac.il/bio tools /faq.html)进行二级结构分析。利用Clustalw程序对GmHMGR基因编码蛋白的氨基酸序列进行多序列比对,用MEGA 5.0软件利用邻接法(Neighbor-Joining algorithm)构建系统进化树。MEME(http://meme suite. org/)分析保守结构域,GSDS2.0(http://gsds.cbi.pku.edu.cn/)分析基因结构,MG2C2.0(http://mg2c.iask.in/mg 2c_v2.0/)进行染色体定位。
1.2.2 总RNA的提取及cDNA第一条链的合成
按照TRIzol©Ls Reagent试剂盒(Ambion,Invitrogen)说明书提取大豆材料总RNA,采用Eppendorf核酸蛋白测定仪检测样品RNA质量及浓度,利用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(全式金)反转录试剂盒反转录得到cDNA第一条链。
1.2.3GmHMGR基因家族的表达模式分析
利用Bio-Rad CFX96实时荧光定量PCR仪,采用TransStart©Tip Green qPCR SuperMix(全式金)试剂盒进行荧光定量PCR。根据GmHMGR1~GmHMGR8基因的序列差异,利用Primer Premier 6软件设计每个基因的实时荧光定量PCR特异引物,CYP2基因为内参基因(表1)。反应体系:2×TransStart©Tip Green qPCR SuperMix 10 μL,上下游引物各0.4 μL(10 μM),cDNA模板 2 μL,ddH2O补足至20 μL。反应程序:94 ℃ 30 s,94 ℃ 5 s,58 ℃ 15 s,72 ℃ 10 s,45个循环。每个样品3次生物学重复,3次技术重复。采用2-ΔΔCT法计算基因的相对表达量,GraphPad prism 6.01软件进行数据分析及绘图。

表1 实时荧光定量PCR特异引物序列Table 1 Primer sequences used in qPCR analysis
2 结果与分析
2.1 GmHMGR基因家族的鉴定和系统进化分析
根据Pfam数据库中HMGR基因家族的保守结构域(编号PF00368),利用HMMER3.0软件在大豆基因组中进行搜索,PFAM和SMART软件进一步确认,鉴定得到8个GmHMGR基因家族的成员。为了后续便于分析,将其以GmHMGR1~GmHMGR8的方式进行命名(表1)。
对本研究获得的 8个大豆及文献报道的 5 个巴西橡胶树[23]和9 个雷蒙德氏棉[24]的共 23个 HMGR蛋白进行进化分析,结果如图1。发现所有23个HMGR成员可以被清晰分成 4 组:ClassⅠ、ClassⅡ、ClassⅢ和 ClassⅣ,每组中都含有大豆HMGR成员。其中,GmHMGR6和7在ClassⅠ中,在雷蒙德氏棉中找到与其配对的同源序列,GmHMGR1、3和4在ClassⅡ中,与巴西橡胶树有同源序列,GmHMGR5和8在ClassⅢ中,在雷蒙德氏棉和巴西橡胶树中均能找到与其配对的同源序列,GmHMGR2单独在 ClassⅣ中,未找到其余物种中与其配对的同源序列。
2.2 GmHMGR基因家族编码蛋白的理化性质和二级结构
对GmHMGR蛋白家族进行理化性质预测发现各成员之间存在差异(表2)。结果显示GmHMGR5编码蛋白最长为608个氨基酸,GmHMGR2最短仅有80个氨基酸,其余5个GmHMGR蛋白在543~593个氨基酸之间。GmHMGR5分子质量最大,为64.96 kD,GmHMGR2最小仅有8.23 kD,其余GmHMGR蛋白分子质量54.49~63.29 kD。 GmHMGR1和3理论等电点最大均为8.24,GmHMGR2理论等电点最小为4.89。 由表2可知GmHMGR2不稳定系数为36.06,是稳定蛋白,其余GmHMGR蛋白不稳定系数均大于40,为不稳定蛋白。GmHMGR蛋白亲水性均大于0,为疏水性蛋白。
GmHMGR蛋白的二级结构的分布比重各不相同(表2)。结果表明,GmHMGR蛋白由α螺旋、延伸链、β转角和无规则卷曲4种结构组成,其中α螺旋和无规则卷曲分别大于35.00%和30.92%,所占比重较大。
2.3 GmHMGR基因家族的基因结构分析
对GmHMGR 蛋白序列进一步进行进化分析,结果如图2 A。发现这些蛋白可以被清晰的聚为4组,与图1的分组结果基本一致,只是不同组间的进化关系略有不同。对GmHMGR的CDS序列和对应基因序列进行内含子和外显子的结构分析结果如图2B。发现进化树中聚类在同一支的GmHMGR基因通常具有类似的基因结构。GmHMGR2具有2个外显子和1个内含子,其它GmHMGR基因均含有4个外显子,3个内含子,相应的外显子长度大致相同,只是内含子长度相差较大。
2.4 GmHMGR基因家族的保守结构域分析
对GmHMGR基因家族氨基酸序列进行保守结构域分析,结果显示GmHMGR蛋白含有5个保守元件(图2C、2D)。GmHMGR2蛋白只含有保守元件1,其余GmHMGR蛋白均有5个保守元件,且位置非常保守。GmHMGR蛋白的元件1和元件2分别含有NADP(H)结合基序(GTVGGGT和DAMGMNM),元件3中含有2个HMG-CoA结合基序(EMPI/VGY/FQI/LP和TTEGCLVA)。
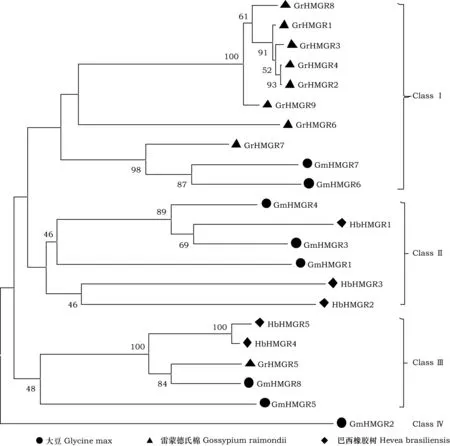
图1 GmHMGR基因家族的系统进化分析Fig.1 Phylogenetic analysis of GmHMGR gene family

基因名称Gene name基因IDGene ID长度/aaLength分子量/kDMW等电点PI不稳定系数Instability index亲水性平均值GRAVY二级结构/%Secondary structureα螺旋Alpha helix 延伸链Extended strand β转角Beta turn无规则卷曲Random coilGmHMGR1XM_003517069.454358.438.2447.500.1043.0917.865.8933.15GmHMGR2XM_014775260.2808.234.8936.060.4335.0026.255.0033.75GmHMGR3XM_003537651.355559.428.2447.920.0941.8017.126.1334.95GmHMGR4XM_003534178.459363.297.9244.130.0643.5116.196.0734.23GmHMGR5XM_006605513.360864.965.7848.350.1543.0917.938.0630.92GmHMGR6XM_003547838.458762.646.8342.510.0743.9516.876.1333.05GmHMGR7XM_003519426.455654.496.4744.100.1241.1917.997.3733.45GmHMGR8XM_003545508.456560.246.1851.020.1143.7217.176.9032.21
注:1.不稳定系数大于40,为不稳定蛋白;不稳定系数小于40,为稳定蛋白。2. 亲水性平均值为-2至2,负值为亲水性蛋白,正值为疏水性蛋白。
Note: 1. The instability index is greater than 40, which is unstable protein; the instability index is less than 40, which is a stable protein.2. The average hydrophilicity is -2 to 2, the negative value is hydrophilic protein, and the positive value is hydrophobic protein.
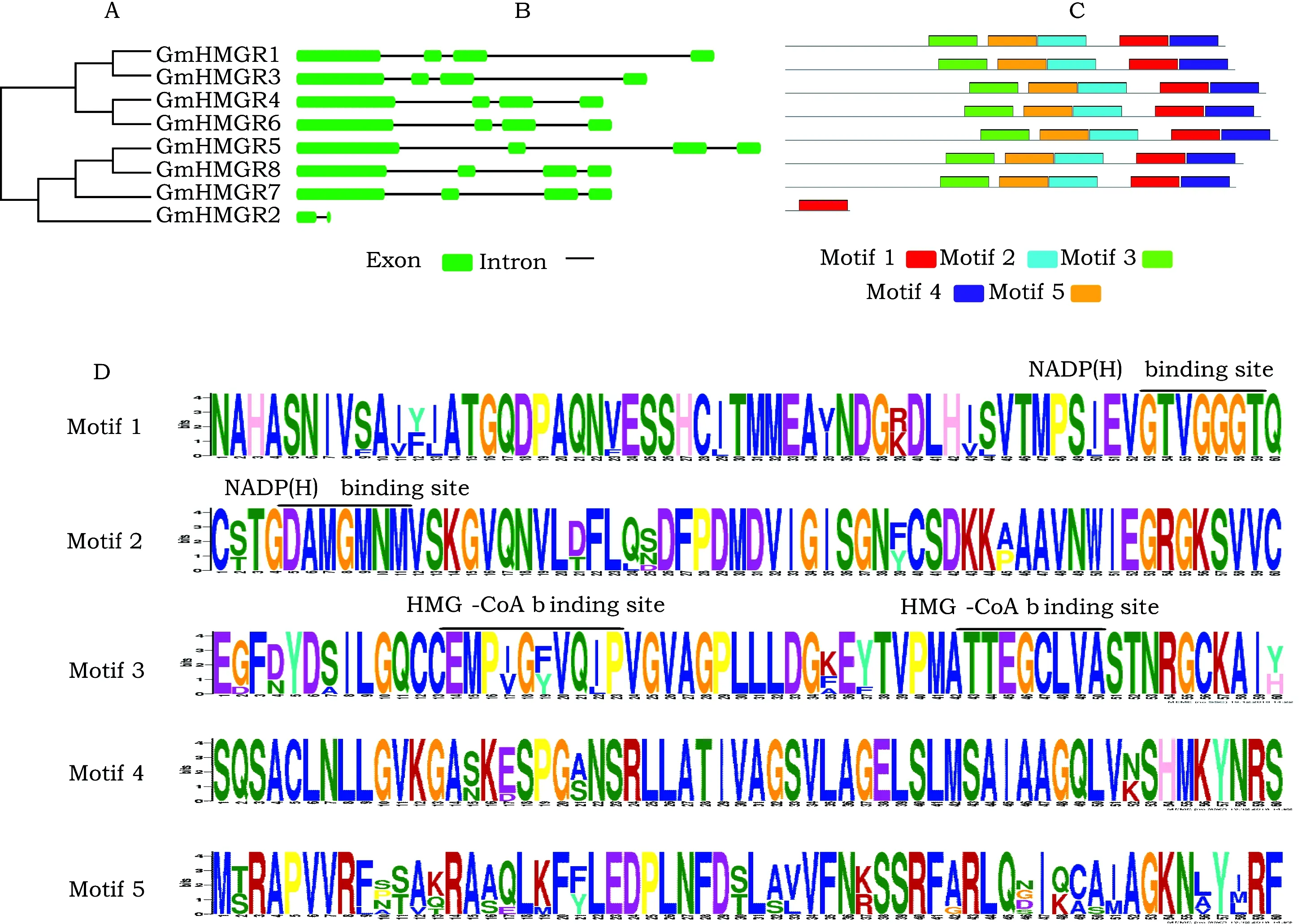
图2 GmHMGR基因家族的基因结构和蛋白保守结构域分析Fig.2 Gene structure and protein conservative domain analysis of GmHMGR gene familyA:GmHMGR基因家族的系统进化树;B:GmHMGR基因家族的基因结构;C:GmHMGR基因家族的保守结构元件分布;D:GmHMGR基因家族的保守结构域。A: Phylogenetic tree of GmHMGR gene family; B: Gene structure of GmHMGR gene family; C: Distribution of conserved structural elements of GmHMGR gene family;D: Conservative domain of GmHMGR gene family.
2.5 GmHMGR基因家族的染色体定位分析
根据GmHMGR基因在染色体上的位置信息,绘制GmHMGR基因家族染色体分布图,结果如图3。GmHMGR基因分布于8条染色体,GmHMGR1~GmHMGR8分别位于1、2、4、11、9、20、16、2、14号染色体上。

图3 GmHMGR基因家族的染色体定位分析Fig.3 Chromosome localization analysis of GmHMGR gene family
2.6 GmHMGR基因家族表达模式的分析
2.6.1GmHMGR基因家族不同组织表达模式的分析
对8个GmHMGR基因家族成员在武乡小黑豆苗期根、茎、叶不同组织中的表达模式进行分析,结果如图4。8个GmHMGR基因在根、茎、叶中均表达,且存在组织特异性。其中,相对其他成员GmHMGR2和GmHMGR5基因在苗期不同组织中表达量较低,GmHMGR6在根、茎、叶中表达量较高。GmHMGR基因家族成员在同一组织中的表达存在差异,GmHMGR1、GmHMGR3、GmHMGR4、GmHMGR5和GmHMGR6基因在叶中的表达量相对高于其他组织,而GmHMGR2、GmHMGR7和GmHMGR8则在茎中的表达量相对较高。
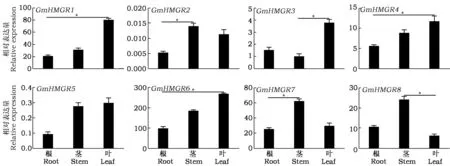
图4 GmHMGR基因家族在苗期不同组织中的表达分析Fig.4 Expression analysis of GmHMGR gene family in different tissues at seedling stage*表示差异显著(P<0.05)。*show significant difference at the 0.05 level.
2.6.2GmHMGR基因家族籽粒发育过程表达模式分析
对GmHMGR基因家族成员在武乡小黑豆不同发育时期籽粒中的表达情况进行分析,结果如图5。结果显示8个GmHMGR基因在不同发育时期籽粒中均能检测到表达,且具有不同的时空表达特性。GmHMGR1、GmHMGR2、GmHMGR3、GmHMGR5、GmHMGR7和GmHMGR8基因表达趋势一致,开花后40 d表达量最高,随后开始下降。GmHMGR4和GmHMGR6不同发育时期的籽粒的表达量呈现先增加后减少,再增加的趋势,GmHMGR4开花后70 d的籽粒表达量最高,GmHMGR6则在开花后32 d的籽粒表达量较高。在籽粒发育过程中,相对于GmHMGR基因家族的其它基因,开花后40 d的籽粒中GmHMGR3的表达水平最高,但开花后70 d的成熟籽粒中则是GmHMGR6的表达水平最高。

图5 GmHMGR基因家族在不同发育时期籽粒中的表达分析Fig.5 Expression analysis of GmHMGR gene family in seeds at different developmental stages*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。* show significant difference at the 0.05 level, **show extremely significant difference at the 0.01 level.
3 讨论与结论
通过在大豆全基因组的同源搜索,共鉴定出8个大豆HMGR基因,结果表明HMGR基因在大豆中是以基因家族形式存在的,这与其他植物中的研究结果一致[13~24]。大豆HMGR蛋白理化性质分析表明,GmHMGR基因编码80~608个氨基酸,相对分子质量介于8.23~64.96 kD,理论等电点变化为4.89~8.24,除GmHMGR2为稳定疏水蛋白外,其余GmHMGR蛋白均为不稳定疏水蛋白。二级结构分析结果显示,GmHMGR蛋白的α螺旋为35.00%~43.95%,延伸链为16.87%~26.25%,β转角为5.00%~8.06%,无规则卷曲为30.92%~34.95%,α螺旋和无规则卷曲是最丰富的二级结构元件,这与Liao等[18]对红豆杉的HMGR蛋白二级结构分析中,α螺旋和无规则卷曲比重分别为42.45%和40.77%的研究结果相一致。
本研究通过对GmHMGR基因家族进行系统进化和基因结构分析,发现除GmHMGR2基因具有1个内含子和2个外显子,其余GmHMGR基因均具有3个内含子和4个外显子,且进化分析中分为一组的GmHMGR基因的内含子及外显子长度类似,表明同属一组的GmHMGR基因可能具有更加相似的功能。对GmHMGR蛋白保守结构域进行分析,发现GmHMGR2只具有1个保守元件,其它基因则具有5个保守元件,且在基因中的位置高度保守。Darabi等[26]研究表明,在禾本科作物HMGR蛋白质的催化结构域中,存在4个极其保守的基序,2个HMG-CoA结合位点(EMPIGYQIP和TTEGCLVA)和2个NADP(H)结合位点(GTVGGGT和DAMGMNM)。8个大豆HMGR蛋白,除GmHMGR2蛋白只具有1个NADP(H)结合位点(DAMGMNM)外,其余蛋白均具有4个保守基序。GmHMGR2的基因结构与编码蛋白功能结构域与其他成员基因存在较大差异,推测其可能在其它HMGR基因调控中具有潜在作用。GmHMGR染色体定位表明,8个GmHMGR基因分别位于8条不同染色体上,相对比较分散。本研究对基因结构和蛋白结构分析得出的结果与Li等[27]研究中指出的所有植物HMGR基因家族基因和编码蛋白的结构高度保守及染色体分布均匀的结果相一致。
为初步了解大豆HMGR基因的功能,利用qRT-PCR技术对GmHMGR基因家族在武乡小黑豆根、茎、叶不同组织以及籽粒不同发育时期的表达情况进行了分析。结果表明,GmHMGR基因具有多样化组织和时空表达特征。相对其他成员基因,GmHMGR6基因在苗期根、茎、叶中表达量最高,籽粒发育过程中GmHMGR3在开花后40 d的籽粒中表达水平最高,但开花后70 d的成熟大豆籽粒中GmHMGR6的表达水平最高,因此推测GmHMGR6可能在大豆苗期根、茎、叶不同组织和成熟籽粒皂苷合成调控中比其它HMGR基因起着更为重要的作用。GmHMGR基因家族的表达模式存在差异,这一现象与前人的研究结果相符[23,24]。罗红梅等[28]对人参皂苷合成生物学关键元件PgHMGR2的研究发现花中表达量最高, 其次为叶和根,茎中表达量最低。Katoemori等[15]研究发现甜瓜授粉后,果实生长初期HMGR表达量上升,而生长末期下降。
大豆基因组中含有8个HMGR基因,具有保守的基因结构和蛋白结构域。所有HMGR基因在苗期根、茎、叶及不同发育时期籽粒中均能检测到表达,具有多样化的组织表达模式和时空表达特征。
