异恶唑草酮在环境介质中的挥发、土壤吸附和水-沉积物系统降解特性
2019-06-24张春荣单凌燕许振岚何红梅赵学平
张春荣,单凌燕,郭 钤,许振岚,何红梅,吴 珉,赵学平,*
(1.浙江省农业科学院 农产品质量标准研究所,省部共建农产品质量安全国家重点实验室(筹),浙江省植物有害生物防控重点实验室,农业农村部农药残留检测重点实验室,浙江 杭州 310021; 2.浙江省农产品质量安全中心,浙江 杭州 310003)
异恶唑草酮(isoxaflutole),化学名称为5-环丙基-4-[2-(甲磺酰)-4-(三氟甲基)苯甲酰]异恶唑(结构式见图1),是一种苗前选择性内吸除草剂,由罗纳-普朗克公司(现为拜耳公司)于2001年最早开发,最初主要应用于玉米田[1],主要通过植物的根部和叶面吸收后,经韧皮部与木质部传导至整个植株,目前广泛用于防除玉米、甘蔗和甜菜等作物的田间杂草,长期占据玉米田除草剂和对羟基苯丙酮酸双加氧酶(HPPD)抑制剂市场中第二的位置,成为替代甲草胺、乙草胺、异丙甲草胺和莠去津等除草剂的首选品种[2-3]。
异恶唑草酮除草剂杀草谱广,有效除草时期长,其广泛应用可能给人类带来潜在的健康风险或造成生态环境污染[4-5]。然而,目前关于异恶唑草酮的研究主要集中在其药效和残留等方面[4-10],有关其环境行为特性的研究较少。Lin等[6-7]研究了异恶唑草酮及其代谢物的水解和光解特性,结果表明,异恶唑草酮在土壤表面光解和水解较快,在土壤表面的光解半衰期为20~23 h,其水溶液(250 μg·L-1,pH 7.18,25 ℃)光解半衰期短于9 h。Alletto等[11]研究了异恶唑草酮及其代谢物在土壤中的吸附解吸特性,结果显示,异恶唑草酮及其代谢物在设施土壤中的吸附性能与有机质含量呈显著正相关。Ramanarayanan等[12]研究了异恶唑草酮及其主要代谢物的土壤降解特性,结果表明,异恶唑草酮在土壤中好氧降解较快,其半衰期为0.3~4.3 d。

图1 异恶唑草酮的结构式Fig.1 Structural formula of isoxaflutole
农药在土壤-水环境中的吸附、水-沉积物系统中的降解,及在环境中的挥发性是农药环境归趋的重要组成部分,是评价农药在环境中迁移降解的重要指标,对农药的安全性评价及科学使用具有重要意义[13-17]。本研究参照国家标准GB/T 31270—2014《化学农药环境安全评价试验准则》(以下简称《准则》),开展异恶唑草酮在土壤中的吸附、不同环境介质中的挥发性,以及不同来源水-沉积物系统中的降解特性研究,旨在为其科学合理使用和生态环境安全风险评价提供基础数据。
1 材料与方法
1.1 供试土壤及沉积物
供试土壤包括潮土、水稻土、红壤土和黑土,分别采自浙江省杭州市萧山区、余杭区,浙江省东阳市和黑龙江省哈尔滨市。4种土壤均为农田耕作层土壤,土样经自然风干后过2 mm筛,室温下保存备用。供试水-沉积物分别采自杭州西湖(湖泊)和杭州运河(河流)。水-沉积物先静置分层后去水,再经孔径2 mm筛网过滤,然后置于通气良好的开盖容器里。土壤和沉积物的基本理化性质见表1。
1.2 仪器设备
Agilent1260 液相色谱仪(UV 检测器),美国Agilent科技有限公司;AB104-S电子天平(精确至0.000 1 g),梅特勒-托利多国际贸易(上海)有限公司;R201旋转蒸发仪,上海申胜生物技术有限公司;HH-4恒温水浴锅,江苏金坛市江南仪器厂;SHZ-D(Ⅲ)循环水式真空泵,巩义市子华仪器有限责任公司;TD5A-WS台式大容量离心机,金坛市金坛仪器制造有限公司;恒温振荡器,苏州培英实验设备有限公司;DFNW-3L氮气发生器,上海精密科学仪器有限公司;气流式密闭系统装置,自制;空气泵,成都锐意机械设计中心。
表1 供试土壤和沉积物的主要理化性质
Table1Physiochemical properties of test soils and sediments
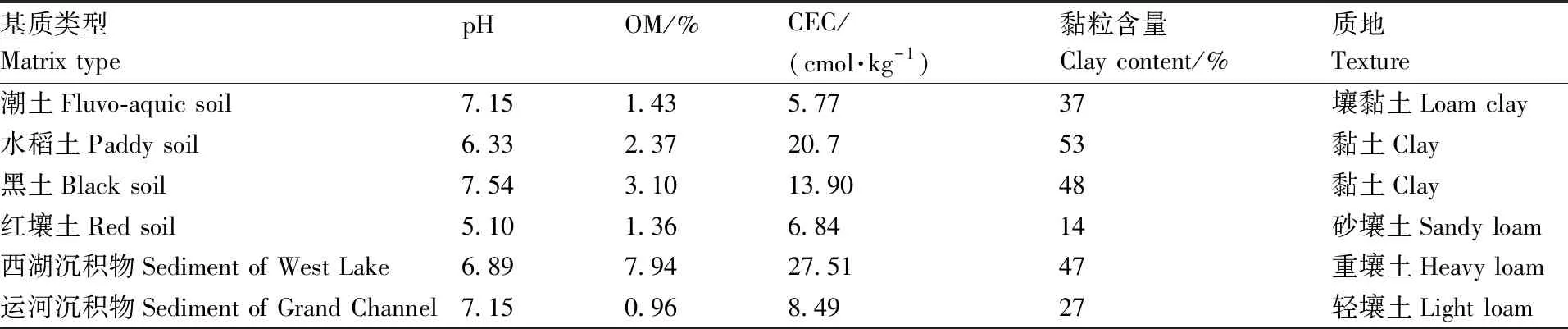
基质类型Matrix typepHOM/%CEC/(cmol·kg-1)黏粒含量Clay content/%质地Texture潮土Fluvo-aquic soil 7.151.435.7737壤黏土Loam clay水稻土Paddy soil6.332.3720.753黏土Clay黑土Black soil7.543.1013.9048黏土Clay红壤土Red soil5.101.366.8414砂壤土Sandy loam西湖沉积物Sediment of West Lake6.897.9427.5147重壤土Heavy loam运河沉积物Sediment of Grand Channel7.150.968.4927轻壤土Light loam
OM,有机质;CEC,阳离子交换量。下同。
OM, Organic matter; CEC, Cation exchange capacity. The same as below.
圆柱形玻璃培养瓶,直径8.5 cm,高18.0 cm。
1.3 主要试剂与耗材
异恶唑草酮原药(纯度为95%),百灵威科技有限公司;异恶唑草酮标准品(纯度为99.5%),Dr. Ehrenstorfer GmbH。C18-N小柱(500 mg,6 mL),博纳艾杰尔科技有限公司。
乙腈,色谱纯,美国Honywell公司。乙腈、丙酮、乙酸乙酯,分析纯,上海凌峰化学试剂有限公司;甲醇,分析纯,天津市大茂化学试剂厂;氯化钠,分析纯,兰溪市屹达化工试剂有限公司。
1.4 挥发试验
参照《准则》,试验设3级吸收,吸收液为乙腈,吸收液体积分别为70、50、50 mL。
1.4.1 玻璃表面(空气中)的挥发性试验
取0.5 mL体积质量为1 000 mg·L-1的异恶唑草酮原药储备溶液均匀地滴加在9 cm直径的玻璃培养皿中,待溶剂丙酮在室内常温下挥发干后,将培养皿置于气流式密闭系统中,在20~25 ℃、避光条件下,空气经硅胶干燥、活性炭净化后,以500 mL·min-1的流速通过密闭装置,使挥发出来的农药随气流通过吸收管,截留在吸收液中,24 h后测定吸收液及培养皿中异恶唑草酮的残留量。培养皿中余下的异恶唑草酮为残留量,吸收液中的为挥发量。同时,设置一个不经气流的对照(CK)试验。以下试验同。
1.4.2 水中的挥发性试验
取20.0 mL体积质量为4.0 mg·L-1的异恶唑草酮工作液于9 cm直径的玻璃培养皿中,置于气流式密闭系统运行24 h后,同1.4.1节操作,分别测定水和吸收液中异恶唑草酮含量。
1.4.3 土壤表面的挥发性试验
称取50.0 g土壤(红壤土和潮土)平铺于9 cm直径的玻璃培养皿中,均匀滴加5 mL体积质量为100 mg·L-1的异恶唑草酮原药工作液到土壤表层,再加纯净水使土壤持水量为饱和持水量的60%。置于气流式密闭系统运行24 h后,同1.4.1节操作,分别测定土壤和吸收液中异恶唑草酮含量。
1.5 土壤吸附试验
参照《准则》,采用振荡平衡法,称取3.0 g过孔径0.25 mm筛的供试土壤于150 mL具塞三角瓶中。
1.5.1 吸附动力学试验
试验选择潮土、水稻土和黑土的水土质量比为10∶1,红壤土的水土质量比为10∶1和2∶1。水土质量比10∶1处理:土壤样品中加入5.0 mL体积质量为5.0 mg·L-1的异恶唑草酮原药CaCl2溶液,再加入25 mL体积质量为0.01 mg·L-1的CaCl2溶液;水土质量比2∶1处理:土壤样品中加入5.0 mL体积质量为5.0 mg·L-1的异恶唑草酮原药CaCl2溶液,再加入1 mL体积质量为0.01 mg·L-1的CaCl2溶液。将以上处理置于(25±2)℃恒温振荡器中振荡,分别于4、8、12、18、24、30 h 取土壤悬浊液转移至离心管中,于4 500 r·min-1高速离心5 min,取上清液经乙酸乙酯萃取、乙腈定容后测定异恶唑草酮含量,计算吸附率,确定吸附平衡时间。
1.5.2 解吸试验及质量平衡试验
将1.5.1节恒温振荡器中振荡24 h处理离心后的土壤中加入与1.5.1节离心得到的上清液相同体积的0.01 mg·L-1CaCl2溶液进行振荡。振摇24 h后离心分离,测定上清液中被试物含量,再重复操作1次,合计2次上清液中的被试物含量,计算被试物解吸率。将上清液全部吸出后,测定土壤中的被试物含量。
1.5.3 吸附等温线试验
红壤土按照2∶1,水稻土、潮土和黑土按照10∶1的水土质量比,分别加入异恶唑草酮体积质量为0.050、0.50、1.0、2.0和5.0 mg·L-1的CaCl2溶液,于(25±2)℃条件下160 r·min-1振荡24 h,将土壤悬浮液转移至离心管中,4 500 r·min-1高速离心5 min,分别测定上清液及土壤中的异恶唑草酮体积质量。
上述试验吸附率、解吸率、质量平衡回收率及土壤吸附系数均根据《准则》进行计算。
1.6 水-沉积物系统降解试验
水-沉积物降解试验参照《准则》进行。具体如下。
预培养。分别称约150 g(干重 64.5 g)西湖沉积物、170 g(干重103 g)运河沉积物,放入圆柱形玻璃培养瓶中,加入与沉积物采集地相对应的地表水400 mL,使每个培养瓶中水和沉积物的体积比为4∶1、沉积物层厚度约为2.0 cm。在(25±2)℃、黑暗条件下,通入充足的空气或氮气,预培养10 d,使系统达到稳定状态。
好氧试验。预培养结束后,在通入空气的西湖水-沉积物、运河水-沉积物系统培养瓶水相中分别加入1 000 mg·L-1异恶唑草酮原药储备液2.0 mL,使得系统水相中异恶唑草酮的体积质量均为5.0 mg·L-1。加药后的培养瓶中分别继续通入充足的空气,在(25±2)℃、黑暗条件下进行培养,分别于0、0.25、0.5、1.25、1.5、2、2.5、3、3.5、4、5、6、8.25 d时取样,测定水相和沉积物相中异恶唑草酮含量。每处理设3个重复,并设空白对照。
厌氧试验:培养期间向培养瓶中通入氮气使其保持厌氧环境,其他同好氧条件下的水-沉积物系统降解试验。
1.7 样品提取
1.7.1 水样
取水样4~20 mL于分液漏斗中,加入20 mL乙酸乙酯,手动振荡提取1 min,收集上层乙酸乙酯提取液并置于平底烧瓶中,在40 ℃水浴下旋转蒸发至近干,氮气吹干,用5.0 mL色谱级乙腈定容,过0.45 μm滤膜,待测。
1.7.2 土样及沉积物
将所采的土壤样品和沉积物样品(20.0 g)转入150 mL具塞磨口三角瓶中,分别加入10 mL纯净水和50 mL乙腈,振荡提取30 min后过滤,滤液转入装有10.0 g氯化钠的具塞量筒中,振摇1 min,静置分层,然后吸取25 mL乙腈置于平底烧瓶中,在40 ℃水浴下旋转蒸发至近干,用5 mL体积分数为20%的甲醇水溶液溶解,待净化。C18-N净化小柱依次用5 mL甲醇、5 mL纯净水预淋,小柱内溶剂至干后将以上提取物转入净化小柱中,弃去淋出液,然后用5 mL体积分数为20%的甲醇水溶液淋洗,弃去淋出液,最后用5 mL色谱级乙腈洗脱,收集洗脱液过0.45 μm滤膜,待测。
1.7.3 吸收液提取
合并吸收液,于40 ℃水浴中浓缩至近干,氮气吹干后用5 mL乙腈定容,过0.45 μm滤膜,待测。
1.8 HPLC测定
色谱柱为Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);检测波长270 nm;柱温40 ℃;流动相为乙腈-水溶液(体积比70∶30);流速0.8 mL·min-1;进样量20 μL。
当土壤中异恶唑草酮添加水平为0.10~10.0 mg·kg-1时,平均回收率为90%~104%,相对标准偏差(RSD)为0.85%~5.6%;当沉积物中异恶唑草酮添加水平为0.10~5.0 mg·kg-1时,平均回收率为75%~91%,RSD为1.9%~5.3%;当水中异恶唑草酮添加水平为0.10~5.0 mg·L-1时,平均回收率为90%~105%,RSD为0.99~1.0%。异恶唑草酮在水体中的最低检出体积质量为0.012 5 mg·L-1;在土壤、沉积物中的最低检出体积质量为0.025 mg·kg-1。方法的准确度和精密度均满足农药残留分析的要求。
2 结果与分析
2.1 异恶唑草酮在不同介质中的挥发性
农药的挥发性直接关系到其在环境中的再分配与持留、归趋。通常,挥发性大的农药对环境的影响范围较大。不同介质中的挥发性试验结果(表2)表明,异恶唑草酮在吸收液中均未检出,其挥发量均<0.25 μg。异恶唑草酮在红壤土、潮土表面的挥发试验回收率分别为87.97%和6.41%,低于其在空气和水中的挥发试验回收率,表明异恶唑草酮在2种类型土壤中存在不同程度的降解,且在pH偏碱性的潮土中降解更快,因而回收率较低。该结果与Beltrn等[18]和Taylor-Lovell等[19]研究结果一致。异恶唑草酮在土壤中极易降解,其降解速率与土壤pH值具有显著的相关性,随pH上升,降解速率加快。
异恶唑草酮在不同介质中的挥发率值均≤1%,表明异恶唑草酮在空气、水和土壤表面较难挥发。
2.2 异恶唑草酮在土壤中的吸附特性
农药的吸附作用通常是指农药被土壤颗粒表面吸着的能力,是评价农药在土壤中移动性的重要指标。根据《准则》要求,解吸试验及吸附等温试验在黑土、潮土、水稻土上均采用10∶1水土质量比进行,在红壤土上采用2∶1水土质量比进行。吸附动力学试验结果(图2)表明:10∶1的水土质量比条件下,异恶唑草酮在黑土、潮土、水稻土和红壤土-CaCl2溶液中振荡24 h后达到吸附平衡,吸附率分别为54.5%、38.2%、35.8%、11.1%;2∶1水土质量比条件下,异恶唑草酮在红壤土-CaCl2溶液中振荡24 h后达到吸附平衡,吸附率为35.2%。异恶唑草酮在黑土、潮土、水稻土和红壤土中的解吸率分别为3.36%、2.94%、20.8%和24.2%,质量平衡试验回收率分别为49.3%、66.9%、77.6%和89.3%。Beltrn等[18]、Rice等[20]试验结果表明,异恶唑草酮的降解与酸碱性有一定的相关性,在不同酸碱性土壤中存在不同程度的水解,在碱性土壤中水解较快,这与吸附试验回收率结果一致。为获得准确的试验结果,在做吸附等温线试验时,采用直接方法测定水土两相中异恶唑草酮体积质量。
不同类型土壤的吸附试验结果如图3所示。当初始体积质量为0.050~5.0 mg·L-1时,异恶唑草酮在潮土、水稻土、黑土、红壤土中的吸附质量分数分别为0.031~2.26、0.059~6.12、0.190~2.27、0.052~4.35 mg·kg-1,4种土壤对农药的吸附量均随初始体积质量的增加而增大,异恶唑草酮在4种类型土壤中的吸附均符合弗罗因德利希(Freundlich)方程(表3)。异恶唑草酮在潮土、水稻土、黑土和红壤土中的吸附常数(Kd值)分别为0.640 6、1.376 2、0.816 9、1.289 5,均小于5,土壤吸附系数(Koc)值分别为77.2、100.1、45.4、163.5,均小于200,说明异恶唑草酮在土壤中吸附性较低。
表2 异恶唑草酮在不同介质中的挥发性试验结果
Table2Results of volatile test for isoxaflutole in different media

介质Media添加量Addition/μg残留量Residues/μg挥发量Valatilization/μg挥发率Valatilizationrate/%CK残留量Residuesin CK/μg回收率Recoveryrate/%空气Atmosphere555.64555.38<0.250.045549.0799.95水相Water86.5385.00<0.250.29085.4598.23红壤土表面Surface of Red soil514.44452.57<0.250.049457.8087.97潮土表面Surface of fluvo-aquic soil500.1632.04<0.250.05038.896.41

图2 吸附时间与吸附率的关系Fig.2 Relationship between adsorption rate and adsorption time
以吸附常数为因变量(y),分别以土壤的pH值、有机质含量、阳离子交换量和黏粒含量为自变量(x),进行单因子回归分析,结果如表4所示。土壤对异恶唑草酮的吸附能力与土壤有机质含量、阳离子交换量和黏粒含量呈正相关性,与土壤酸碱度呈负相关性。Alletto等[11]和Rice等[20]研究了异恶唑草酮及其代谢物在土壤中的吸附解吸特性,结果显示,异恶唑草酮及其代谢物在设施土壤中的吸附性能与有机质含量呈显著正相关,与土壤pH负相关,随着有机质含量增加及pH下降,吸附作用增强。
表3 异恶唑草酮在4种类型土壤中的吸附常数
Table3Absorption constant of isoxaflutole in four test soils
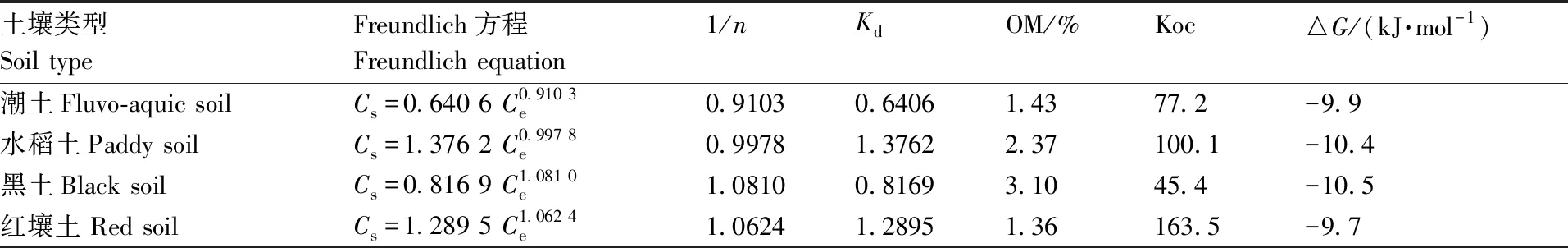
土壤类型Soil typeFreundlich方程Freundlich equation1/nKdOM/%Koc△G/(kJ·mol-1)潮土Fluvo-aquic soilCs=0.640 6 C0.910 3e0.91030.64061.4377.2-9.9水稻土Paddy soilCs=1.376 2 C0.997 8e0.99781.37622.37100.1-10.4黑土Black soilCs=0.816 9 C1.081 0e1.08100.81693.1045.4-10.5红壤土 Red soilCs=1.289 5 C1.062 4e1.06241.28951.36163.5-9.7
表4 异恶唑草酮在土壤中的Kd值与土壤理化性质的相关性分析
Table4Correlation betweenKdvalue of isoxaflutole and soil properties

土壤特性Soil property线性方程Linear equationrFPpHy=4.653-0.529x0.8512.6270.352OMy=0.629+0.137x0.2990.0980.806CECy=0.294+0.048x0.9427.8210.219黏粒含量Clay contenty=-0.944+0.041x0.8753.2690.322
r,相关系数。r, Correlation coefficient.
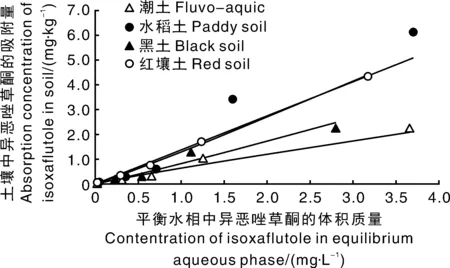
图3 异恶唑草酮在4种土壤中的吸附等温线Fig.3 Sorption isotherms equations of isoxaflutole in four test soils
土壤吸附自由能(△G)是反映土壤吸附特性的重要参数,可用于推断土壤的吸附机制:当吸附自由能变化∣△G∣<40 kJ·mol-1时为物理吸附;反之为化学吸附[15-16]。经测算,4种土壤对异恶唑草酮农药吸附的自由能变化均为负值,且∣△G∣值均小于40 kJ·mol-1,表明该吸附为物理吸附。
2.3 异恶唑草酮在水-沉积物系统中的降解特性
农药在水-沉积物系统中的降解作用,是影响农药在水生态系统的行为特性和归趋的重要因素。本试验选择南方具有代表性的湖泊水-沉积物系统和河流水-沉积物系统,在好氧与厌氧条件下,测定了异恶唑草酮在水-沉积物系统中的降解作用,为评价该农药生态环境的安全性提供相应的基础数据。
异恶唑草酮在水-沉积物系统中的试验结果如图4、图5所示。结果表明,异恶唑草酮在水-沉积物系统中的降解较好地遵循了一级动力学方程,整个试验过程中均未从沉积物中检出异恶唑草酮,这与其土壤吸附性弱的结果一致。异恶唑草酮在西湖水-沉积物和运河水-沉积物水相中降解均较快,其在水相中和水-沉积物整个系统中的消解半衰期一致,好氧降解半衰期分别为73.7 h和75.3 h,厌氧降解半衰期分别为42.3 h和43.0 h。有研究表明,异恶唑草酮的水解速率主要与pH值有关[12],运河水的pH为8.25、西湖水的pH为7.74,因而2种系统下的降解速率基本一致。在本研究中,水-沉积物系统中的降解以水解作用为主。

图5 异恶唑草酮在水-沉积物系统的降解曲线Fig.5 Degradation curve of isoxaflutole in water-sediment system
3 结论
本研究表明,异恶唑草酮在空气、水中和土壤表面的挥发率值均小于1%,挥发性较低,说明该药使用后因挥发作用产生的大气环境风险较低。异恶唑草酮在潮土、水稻土、黑土和红壤土中的吸附均符合Freundlich方程,Kd值分别为0.640 6、1.376 2、0.816 9和1.289 5,Koc值分别为77.2、100.1、45.4和163.5,属于土壤中难吸附的农药。土壤对异恶唑草酮的吸附能力与土壤有机质含量、阳离子交换量和黏粒含量呈正相关,与土壤酸碱度呈负相关。四种土壤对异恶唑草酮吸附的自由能变化均为负值,且绝对值均小于40 kJ·mol-1,均为物理吸附。
异恶唑草酮在水-沉积物系统中的降解遵循一级动力学方程,在西湖水-沉积物系统和运河水-沉积物系统中的好氧降解半衰期分别为73.7 h和75.3 h,厌氧降解半衰期分别为42.3 h和43.0 h,在湖泊水-沉积物系统和河流水-沉积物系统中均属于易降解农药。其在水-沉积物系统中的降解以水解作用为主,降解较快,其降解速率主要与水体的pH值有关,环境风险较小。
综上所述,异恶唑草酮在土壤、空气和水中难挥发,在不同质地土壤中难吸附,在水-沉积物系统中易降解,不易对周围环境及地下水造成风险。
