体外分离兔脂肪间充质干细胞多向诱导分化及鉴定的实验研究
2019-06-22许颖捷宋志强胡露露曾雪敏龚忠诚
许颖捷, 宋志强, 邵 博, 胡露露, 曾雪敏, 龚忠诚
(1新疆医科大学第一附属医院/附属口腔医(学)院颌面肿瘤外科, 2新疆维吾尔自治区口腔医学研究所, 乌鲁木齐 830054 )
髁突软骨部分缺损或退行性病变常常由颞颌关节骨关节病、肿瘤、创伤等多种病因侵及软骨层面而导致发生。软骨自身因匮乏神经血管其修复能力极其有限,当软骨损伤后,调动机体进行自身修复几乎是不可能的[1]。近年来软骨组织工程学的发展为此类问题带来了良好的应用前景,即用于临床修复软骨缺损或替代病变、缺损的组织器官,从而达到修复创伤和重建功能的目的[2]。 种子细胞、支架材料、生长因子是组织工程的三大结构[3]。大量体外研究表明干细胞增殖能力无限,具有多向分化潜能,其特性为构建组织工程软骨提供了理想种子细胞的可能性。Zuk等从人的脂肪中分离出脂肪间充质干细胞(adipose-derived stem cells, ADSCs),取材简易,量大且创伤小等特点是软骨组织工程种子细胞来源的绝对优势。近年来,ADSCs逐渐成为应用在组织工程中[4]。本实验对兔脂肪组织中的ADSCs进行分离培养及鉴定,检测其成脂、成骨、成软骨细胞分化的特性,为后期基于ADSCs作为种子细胞的软骨组织工程的研究提供更有力的实验依据。
1 材料与方法
1.1 实验动物新西兰大耳兔,体质量2.0~2.5 kg,由新疆医科大学第一附属医院动物实验中心提供。实验过程中对动物的处置严格遵守《关于善待实验动物的指导性意见》相关要求。动物伦理审核项目编号:IACUC20180411-13。
1.2 材料
1.2.1 主要试剂 DMEM/F12、H-DMEM培养液、0.25%胰蛋白酶、L-谷氨酰胺、青霉素/链霉素(HYCLONE公司,美国),Ⅰ型胶原酶(Worthington公司,美国),胎牛血清(FBS)、转铁蛋白(Insulin Transferrin Selenium, Gibco公司,美国),3-异丁基-1-甲基黄嘌呤(IBMX)、维生素C、吲哚美辛、β-磷酸甘油钠、L-脯氨酸、油红O、1%茜素红染色液(pH=4.2)、甲苯胺蓝(北京索莱宝公司,中国)、地塞米松(Dexamethasone)、胰岛素(Insulin)、细胞活性检测(CCK-8)试剂盒(Sigma公司,美国),转化生长因子β1(TGF-β1,Prope-tech公司,美国),FITC-小鼠单克隆抗体CD90、CD11b、兔单克隆抗体CD34、HLA-DR、FITC-鼠抗兔IgG(abcam公司,美国),DAB显色液(北京中杉金桥)。
1.2.2 仪器 流式细胞仪(BD FACSCalibur,美国)、超净工作台(SW-CJ-2FD,中国)、低速离心机(KDC-40,中国)、倒置显微镜(LEICA CTR400,德国)、二氧化碳恒温箱(HF240,中国)。
1.3 方法
1.3.1 ADSCs的分离与培养 成年新西兰大耳白兔经由耳缘静脉注射过量利多卡因处死,常规术前准备。取双侧腹股沟部脂肪组织存至培养皿中,转移至超净工作台,用含5%双抗的无菌PBS清洗3遍,尽量剔除脂肪组织中肉眼可见的筋膜和血管,眼科剪剪碎至约1 mm3大小,转移至50 mL离心管。加入等体积的0.1%Ⅰ型胶原酶,离心管封口后放入摇床消化(37℃,140 r/min,60 min)。加等体积终止液(含10%FBS的DMEM/F12)终止消化,2 000 r/min,4℃离心5 min,弃上层粘稠絮状组织及中层清液,留沉淀层。PBS清洗一次,DMEM/F12培养基(含10%FBS,1%双抗)重悬沉淀,200目细胞筛过滤;吸取滤液,接种至50 mL细胞培养瓶,放入37℃、5%CO2细胞培养箱培养。48~72 h后首次换液,之后每隔2天换一次液,待细胞生长至80%~90%融合时,用0.25%胰蛋白酶进行消化传代。使用倒置显微镜每日观察细胞生长情况及形态变化。
1.3.2 CCK-8法测定细胞生长曲线 取培养P3代ADSCs细胞,经0.25%胰蛋白酶消化,完全培养基重悬细胞,细胞计数后稀释至1×104个/mL,以每孔100 μL接种于8个96孔板,置于37℃、5%CO2培养箱中培养。正常培养组含培养液与细胞,对照组仅含培养液无细胞,每组各设6个复孔。按照使用说明书,每天取1个96孔板,连续7 d在波长为450 nm条件下酶标仪检测各孔的吸光度值,并绘制生长曲线。
1.3.3 ADSCs表面相关抗原的鉴定 取生长良好的P3代细胞,胰蛋白酶消化收集,使用适量缓冲液重悬,进行细胞计数,调整细胞浓度为2×107个/mL;在每个流式管中分别加入100 μL细胞悬液并做好标记,分别加入稀释后的CD90、CD11b荧光标记的小鼠单克隆抗体、CD34、HLA-DR荧光标记的兔单克隆抗体,室温避光孵育30 min,设置只加缓冲液的空白对照管1,CD34、HLA-DR检测管再加入FITC-鼠抗兔IgG室温避光孵育30 min,空白管加入鼠抗兔IgG作为同型对照同条件孵育。PBS清洗2次,1 000 r/min,离心5 min弃上清,重悬后用预先灭菌的300目滤网过滤后上机检测。
1.3.4 ADSCs诱导成脂及鉴定 将P3代ADSCs以5×107个/L的密度接种在6孔板中,用含10%FBS、1%双抗的H-DMEM培养4 d后吸去原培养液,贴壁率约80%,加入成脂诱导培养基(原培养基中加入1 μmol/L地塞米松,0.5 mmol/L的IBMX,100 μmol/L吲哚美辛和10 μg/ml胰岛素),继续培养,每2~3天更换一次培养基。待诱导7 d后用4%多聚甲醛固定0.5 h。油红O染液37℃下浸染30 min,PBS反复冲洗以去除多余染料,倒置显微镜观察染色情况。
1.3.5 ADSCs诱导成骨及鉴定 P3代ADSCs以108个/L的密度接种在6孔板中,用含10%FBS、1%双抗的H-DMEM培养4 d后吸去原培养液,更换培养基为矿化培养基(原培养基中加入100 nmol/L地塞米松、50 μg/mL维生素C和10 mmol/L β-磷酸甘油钠)。继续培养,每2~3天更换一次培养基。待诱导第7天时用4%多聚甲醛固定0.5 h,漂洗后用1%茜素红(pH=4.2)37℃浸染15 min,PBS反复冲洗,倒置显微镜观察染色情况。
1.3.6 ADSCs诱导成软骨及免疫组织化学检测 P3代培养于50 mL细胞培养瓶的ADSCs经0.25%胰蛋白酶消化后,在1.5 mL EP管内离心成为细胞团块,构建Pellet结构,团块含有的细胞数需>5.0×106个,之后添加含10%FBS、1%双抗的H-DMEM培养基1.2 mL,在恒温培养箱内培养24 h后更换培养液,添加软骨诱导液,为H-DMEM中添加2.5%FBS,40 μg/mlL脯氨酸,100 nmol/L地塞米松,50 μg/mL维生素C,1%ITS,10 ng/mL TGF-β1,继续培养,每2~3天更换一次培养基。待诱导21 d天后用4%多聚甲醛固定(>12 h),酒精梯度脱水(80%~100%),浸蜡、石蜡包埋、切片5 μm、脱蜡后进行HE及免疫组织化学检测。
2 结果
2.1 ADSCs形态随着原代细胞贴壁时间的延长,贴壁细胞数量逐渐增多,细胞形态逐渐趋于一致,胞浆延展成长梭形或者长三角形,约7~9 d贴壁细胞数量可达传代要求,此时贴壁面积约80%,细胞间胞膜接触挤压呈鱼群状,见图1。
2.2 细胞生长曲线的绘制根据CCK-8法连续8 d检测结果绘制生长曲线,P3代脂肪间充质干细胞生长曲线呈“S”形(图2),细胞潜伏期约2 d,第3天进入对数生长期,第5天达生长高峰,第6天逐渐进入平台期,细胞生长速度减慢(表1)。
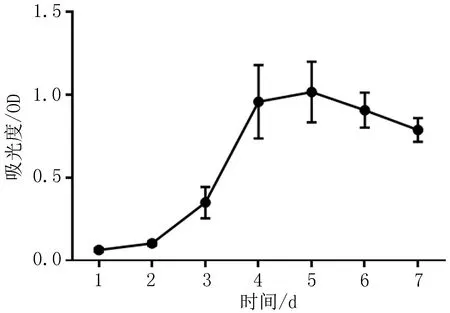
图2 脂肪间充质干细胞P3代生长曲线
表1 增殖曲线所测 A 值
2.3 细胞表面相关抗原的流式细胞术鉴定流式细胞术检测P3代ADSCs表面抗原结果见图3,细胞表达CD90阳性(87.72%),相反CD11b(0%)、CD34(0.03%)、HLA-DR(1.4%)呈阴性反应。
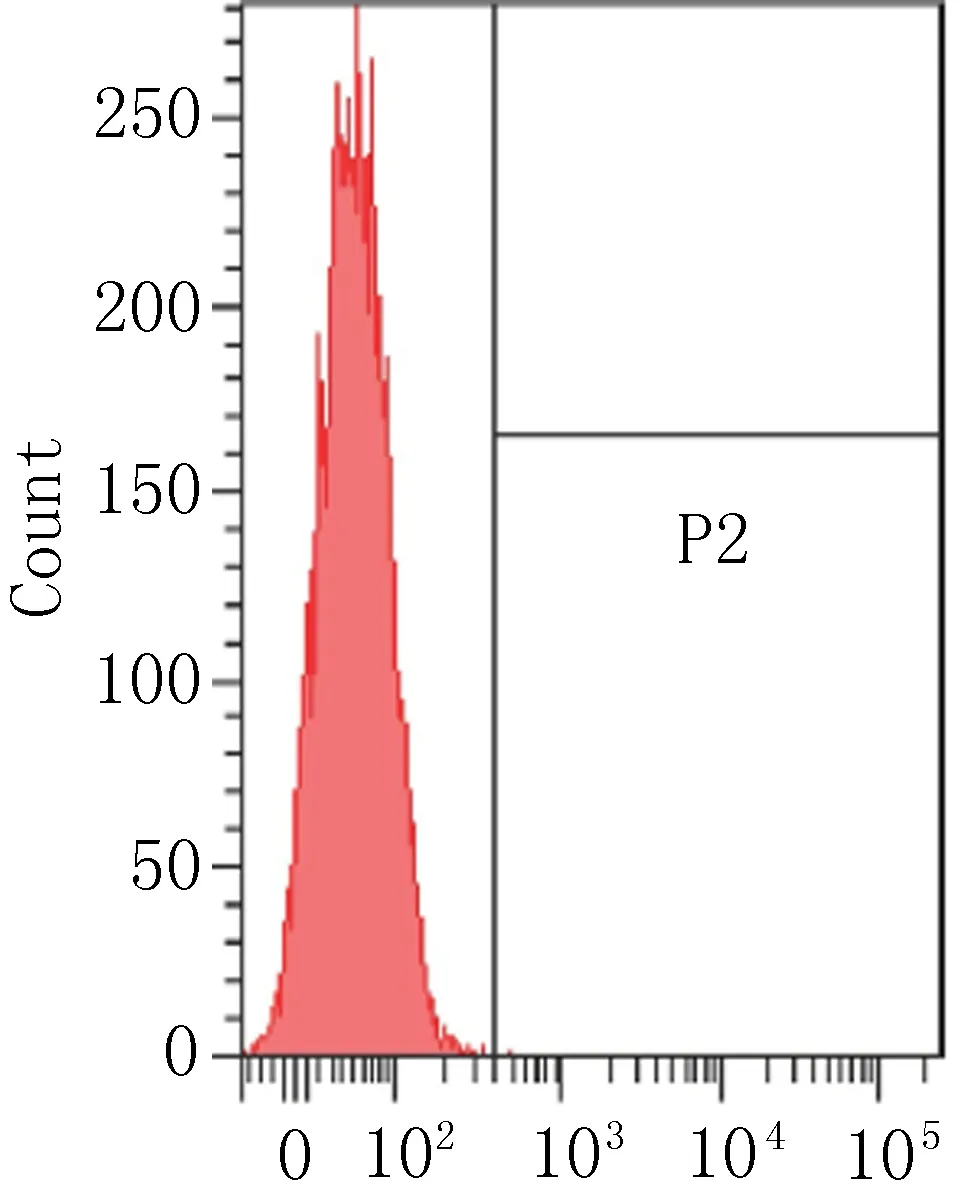
正常培养细胞
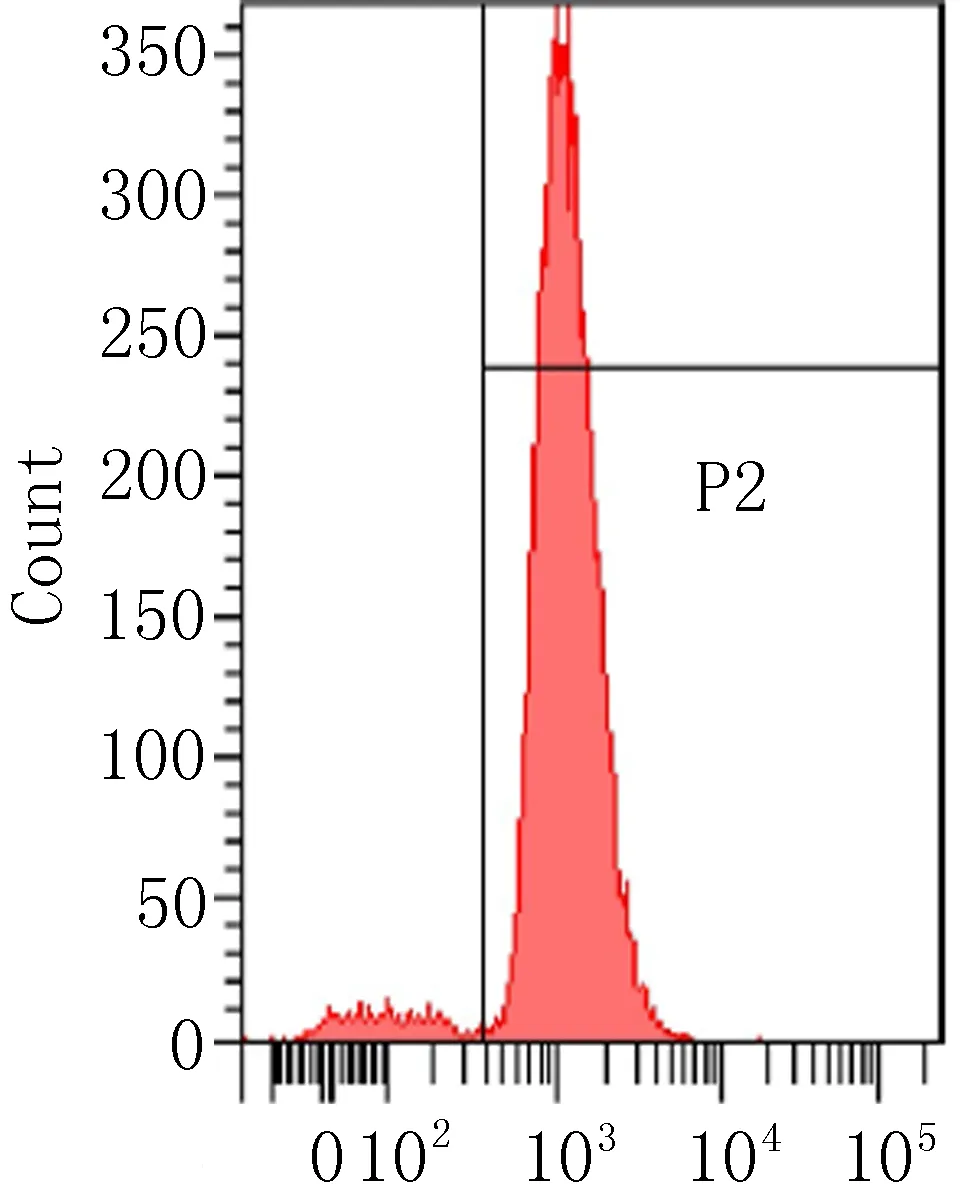
CD-90
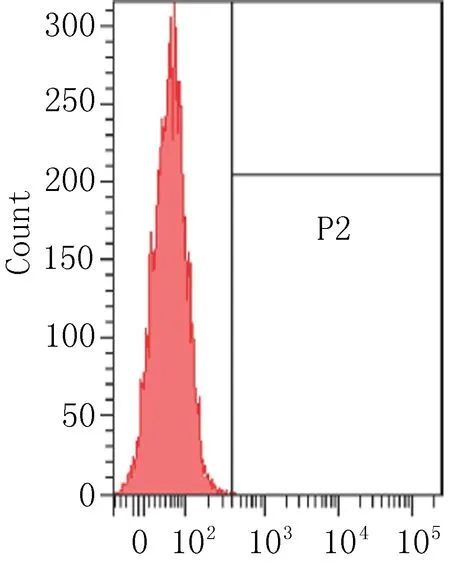
CD-11
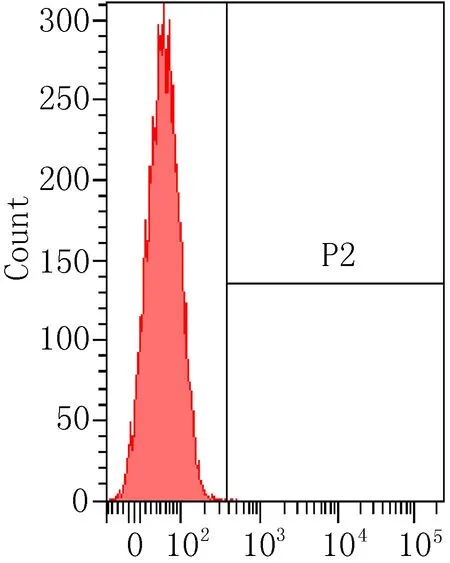
bCD-34
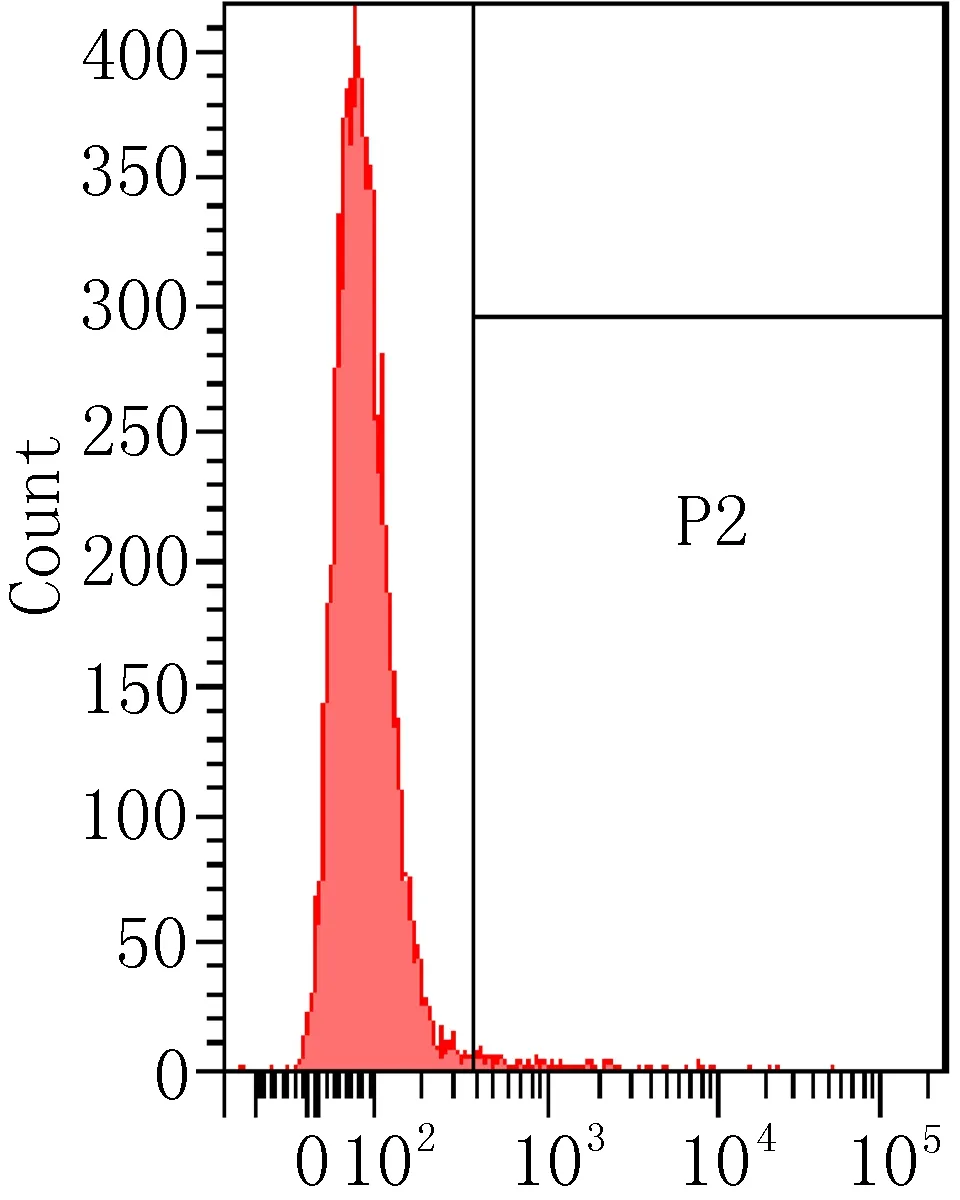
HLA-DR
图3 ADSCs流式细胞仪鉴定结果
2.4 ADSCs成脂诱导P3代ADSCs贴壁率达100%后,加入成脂诱导液,诱导72 h后长梭形细胞开始发生形变,胞浆饱满变稍呈扁圆状,随着诱导时间的延长,细胞胞浆逐渐透亮,油红0分别染色诱导后的ADSCs,结果显示诱导第7天时可细胞胞浆内见较大的脂滴形成(图4a),除较大脂滴外,胞浆内可见均匀的分布的细小脂滴(图4b)。
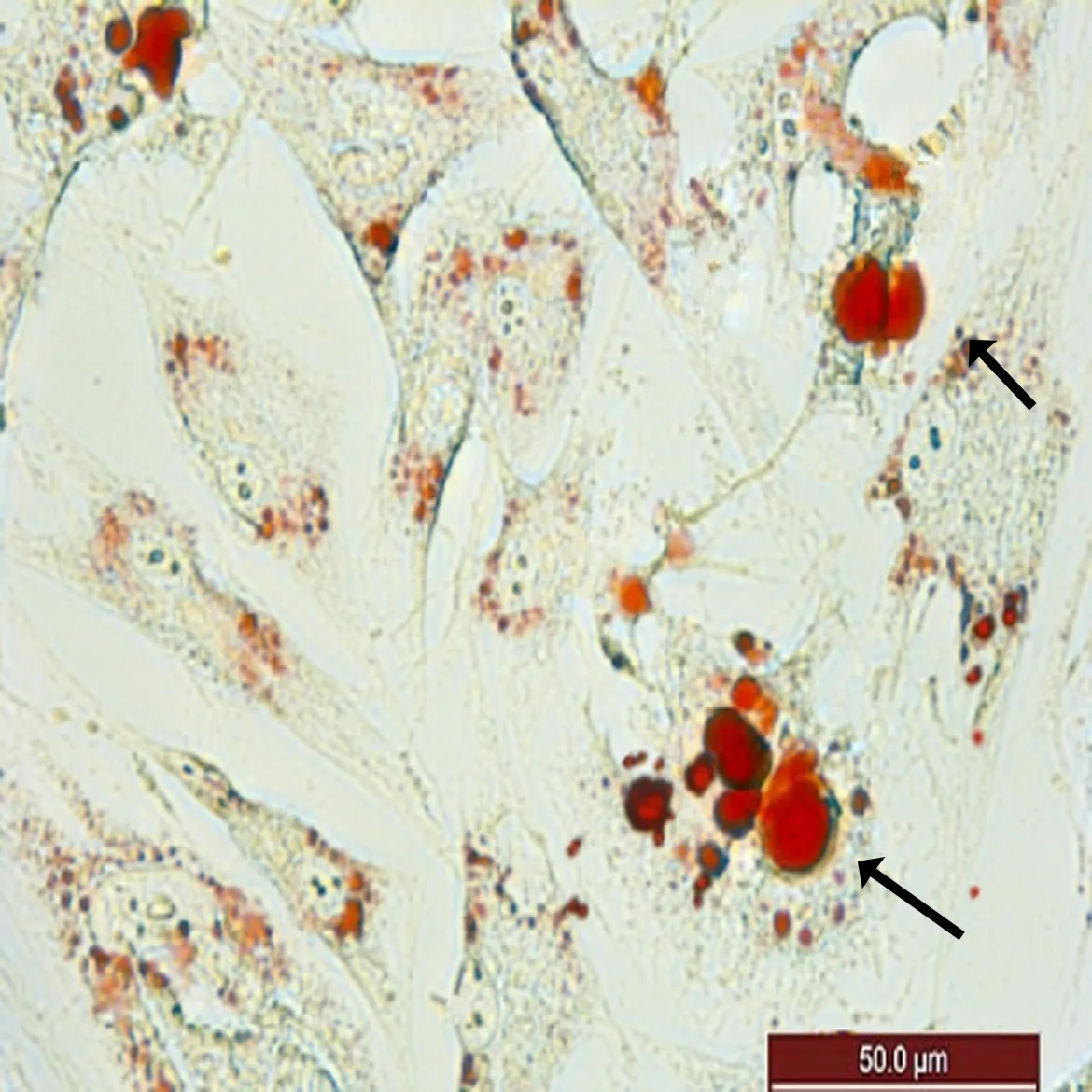
a: 胞浆内见大脂滴形成,如箭头所示
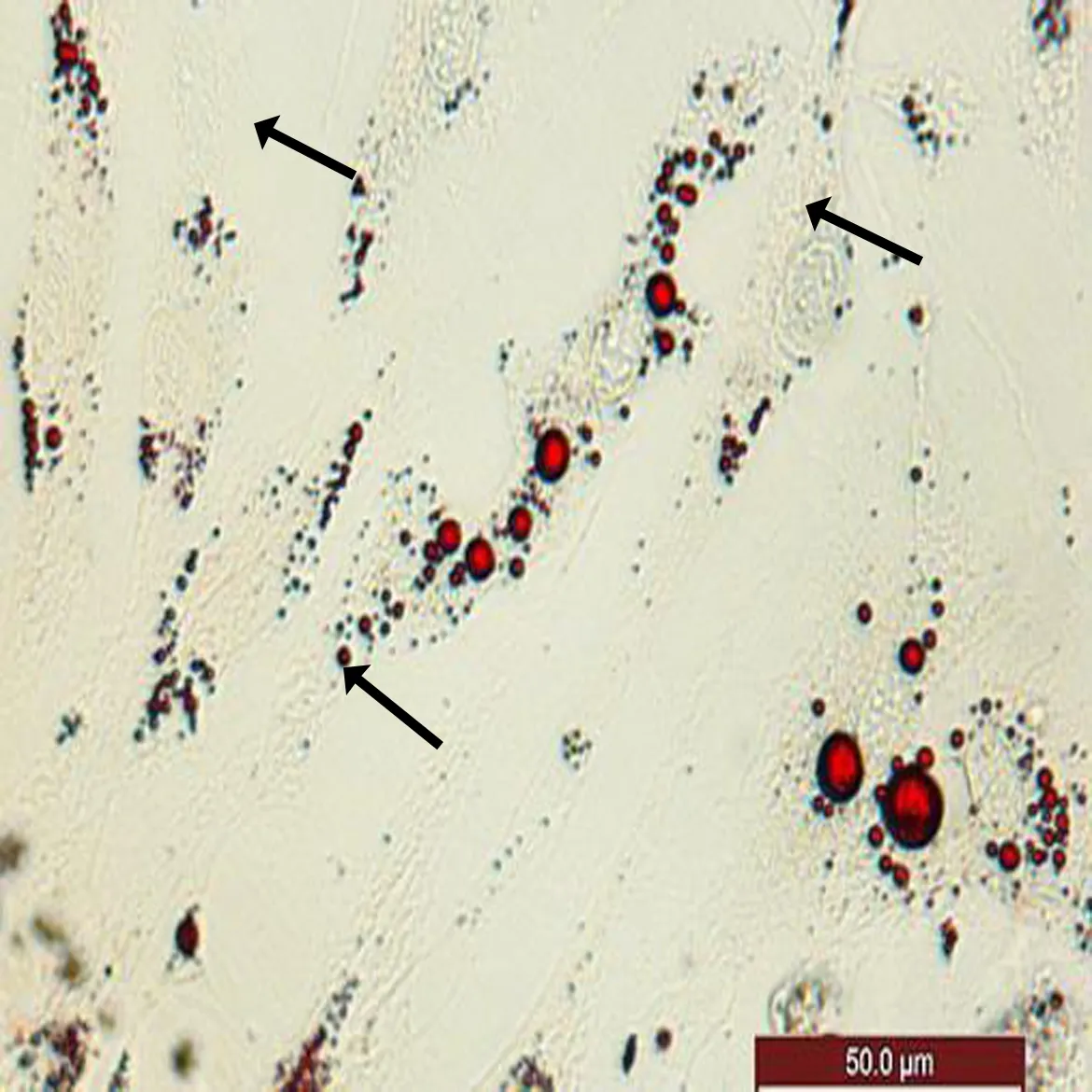
b: 胞浆内见细胞脂滴形成,如箭头所示
图4 ADSCs成脂诱导后油红O染色(BF光束下拍照, ×200)
2.5 ADSCs成骨诱导细胞贴壁达70%时,加入成骨诱导液,诱导过程中细胞形态未见明显变化,倒置显微镜下见ADSCs漩涡状生长中心及边缘可见小结节,成骨诱导的ADSCs使用1%茜素红分别染色镜下观察,结果示诱导第7天时可见数个骨结节形成,见图5。
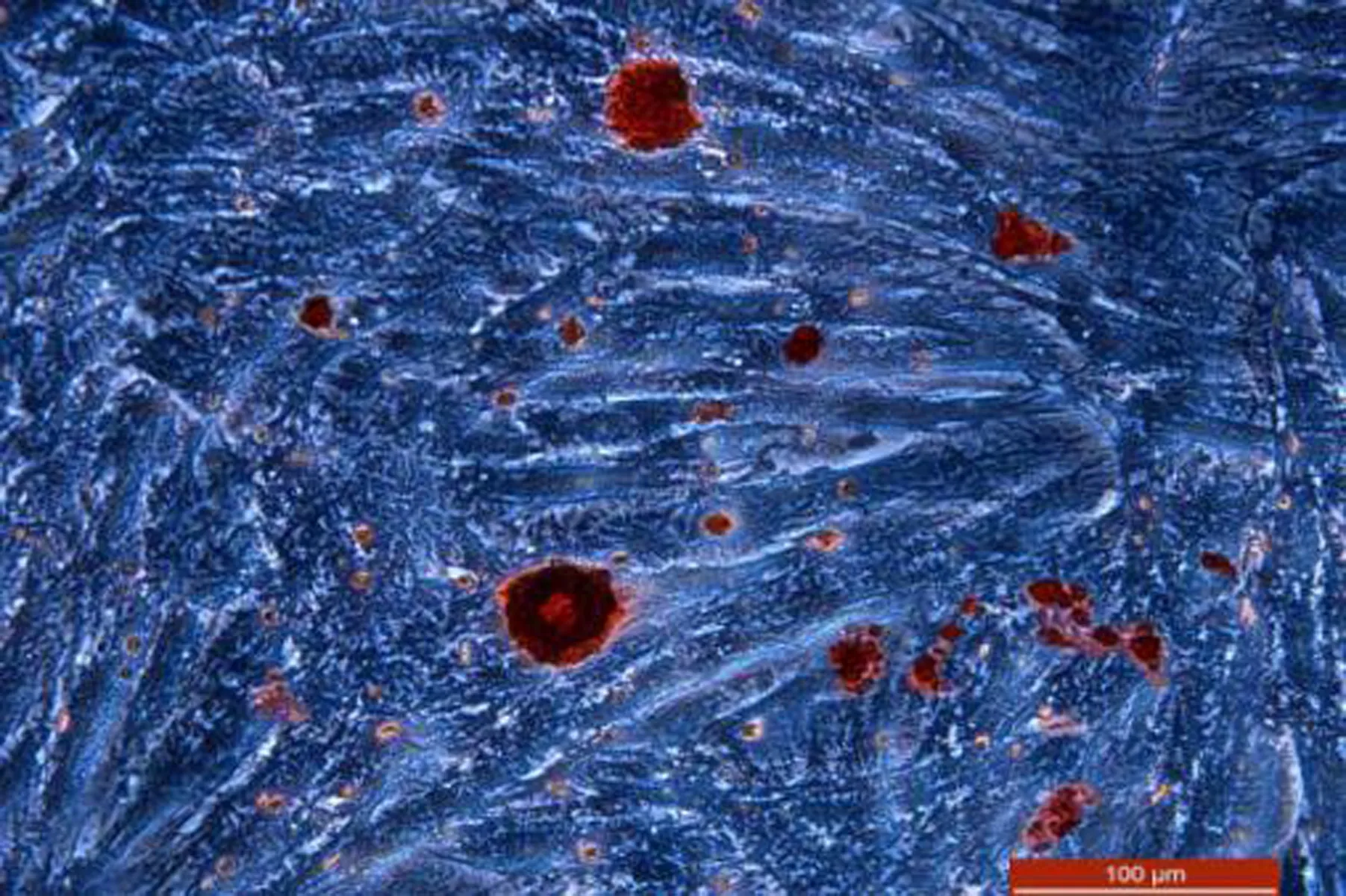
图5 ADSCs成骨诱导后茜素红染色,钙结节红染 (PH光束下拍照, ×100)
2.6 ADSCs成软骨诱导成软骨诱导21 d后Pellet成橄榄球型,表面光滑,有韧性。成软骨细胞诱导后,苏木精-伊红染色胞浆呈紫红色。核呈深紫色,软骨凹陷形成。Ⅱ型胶原免疫组织化学中显示胞浆被染成棕褐色,表达软骨Ⅱ型胶原特异性蛋白,且形成成熟的软骨凹陷,见图6。
3 讨论
由于颞下颌关节软骨缺乏血管神经分布,任何形式的软骨损伤后其自身几乎无本体修复能力。单纯外科手术难以达到理想的治疗效果,累计术后感染坏死、继发畸形等并发症,使得单一开放性手术治疗举步维艰。目前,基于种子细胞的软骨组织工程是解决软骨损伤后修复的研究焦点。组织工程的研究方向也从早期软骨膜及骨膜移植到自体软骨软骨细胞回植,如今干细胞已广泛应用于其中。
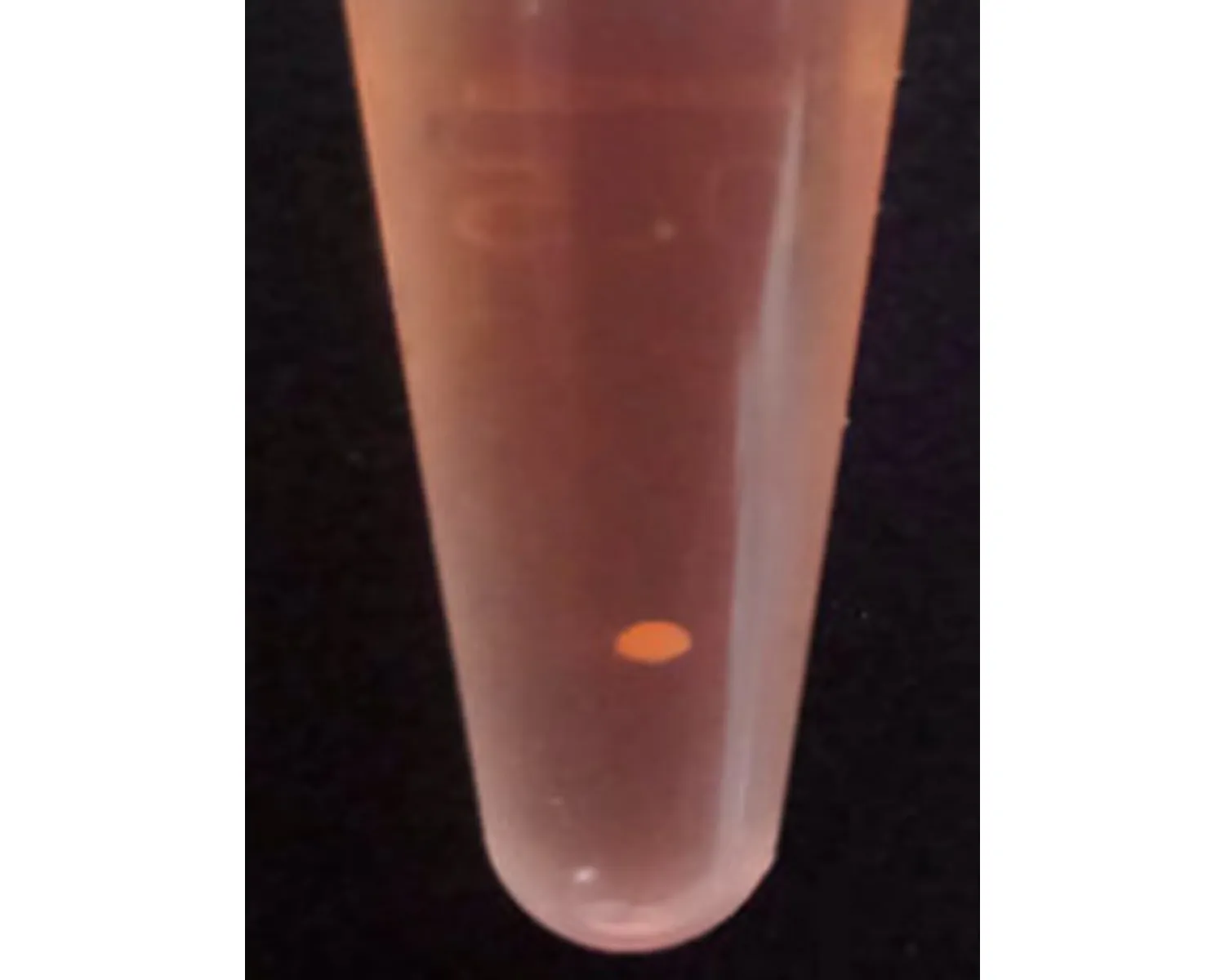
诱导后形成Pellet结构
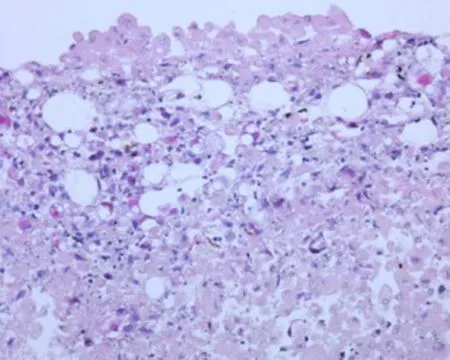
HE染色(×40)
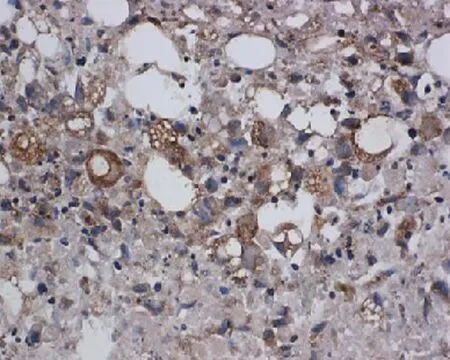
Ⅱ型胶原免疫组织化学染色(×40)
图6 ADSCs成软骨诱导
种子细胞的选择是组织工程化软骨的前提。成熟的软骨细胞虽是经典的种子细胞来源,但因其组织有限,以及易老化易去分化等缺点,软骨细胞作为种子细胞的发展受到限制。干细胞作为一类可多向分化、具有无限增殖潜能的细胞,成为软骨组织工程种子细胞的首选。既往研究表明由于骨髓间充质干细胞(bone marrow derived mesenchymal stem cells, BMSCs)是软骨组织工程理想的种子细胞[5]。但BMSCs的数量很少,在体外培养经多次传代易老化,致使增殖能力和成软骨分化潜能均下降。相较前者,ADSCs常常由吸脂获取,具有获取量大,取材简易,创伤较小等特点,使得ADSCs在来源上成为组织工程种子细胞的绝对优势,其可以在体外可以分化成软骨、骨、肌腱、骨骼肌和脂肪[6-8]。有学者发现ADSCs在体外特定条件下可分化为多种细胞类型及表达BMSCs相关抗原。本实验依照相关文献分离出兔腹股沟部脂肪组织,剔除筋膜血管,使用I型胶原酶消化后对分离的细胞进行培养,ADSCs以贴壁方式生长,呈类成纤维样细胞形态,细胞增殖迅速,细胞传代培养生长稳定。
流式细胞术可通过检测细胞表型来明确细胞来源,但标记脂肪间充质干细胞的特异性分子目前尚未找到,相关研究表明,脂肪间充质干细胞具有间充质干细胞这一类细胞的特异性表面标记:CD44、CD54、CD90、CD105等阳性表达;不表达CD45、HLA-DR等免疫原性细胞的表面标记;对CD34的表达目前还存在争议[9-10]。本实验通过流式细胞术检测ADSCs表型结果显示CD90呈阳性表达,CD11b、CD34、HLA-DR呈阴性表达,结合成脂、成骨、成软骨诱导分化结果进一步证明了所分离培养的细胞就是来源于脂肪的间充质干细胞。
在软骨组织工程中细胞因子起到调控促进作用,TGF-β1在诱导间充质干细胞向软骨细胞分化过程中至为关键,在胚胎软骨形成过程时,TGF-β1可以诱导原始的间充质干细胞分化形成软骨组织,并具有促进软骨细胞增殖的作用。TGF-β1通过促进干细胞分化成软骨,促进其增殖,同时也能促使软骨糖胺多糖和II型胶原合成以增加软骨细胞外基质[11-13]。本实验外源性添加10 ng/mL的TGF-β1可成功诱导ADSCs向软骨方向分化,促进软骨相关蛋白Ⅱ型胶原的形成。相关研究表明TGF-β1在此浓度时可显著促进MSCs的成软骨分化,增加浓度(>10 ng/mL)并不能提高MSCs的成软骨效率。
本研究结果表明,从兔脂肪组织中分离培养到的ADSCs具有多向分化潜能。增殖能力优好是组织工程种子细胞选择的必备因素,本研究中ADSCs增殖速度较快,第3天即可进入对数生长期,对比BMSCs,ADSCs生长速度快,这与Zhu等[14]研究结果一致。
综上,脂肪组织中细胞丰富,取材方便,ADSCs分离培养方法简易,可获得大量细胞且干细胞特性显著,贴壁ADSCs用选择性培养基后具有向脂肪、骨分化能力,细胞团块pellet结构在三维环境培养经由TGF-β1外源性刺激诱导后,具有软骨分化潜能,成为髁突软骨损伤组织工程修复中种子细胞的佳选。
