甲苯使酸性高锰酸钾溶液褪色实验的改进
2019-06-21沈坤华
沈坤华


摘要: 针对教材中“甲苯使酸性高锰酸钾溶液褪色”实验现象不明显的问题,通过分析其原因,进行了实验改进。以18冠醚6作相转移催化剂,使原本是两相界面的氧化反应转移到有机相中进行。采用控制单一变量的科学探究法,从改变反应温度、氧化剂浓度及催化剂用量等方面,开展实验探索,获得适合课堂教学演示实验的反应条件。此实验改进成果应用于课堂教学,有利于培养学生的思维能力,发展学生的化学核心素养。
关键词: 甲苯; 酸性高锰酸钾溶液; 相转移催化剂; 18冠醚6; 实验改进
文章编号: 10056629(2019)1005603 中图分类号: G633.8 文献标识码: B
1 问题的提出
现行苏教版《有机化学基础》(选修)“芳香烃”的教学中,为了研讨苯同系物的化学性质,在“观察与思考”栏目增加了甲苯、二甲苯被酸性高锰酸钾溶液氧化的实验[1]。顺利完成这两个实验是苯环对其侧链化学性质影响使侧链变得更活泼的最有力的证据,从而进一步讨论有机物基团间的相互影响,也是学习苯同系物的化学性质及其应用的基础。然而,在常温或水浴加热(80℃)条件下,分别取3滴0.05moL·L-1、 0.02moL·L-1、 0.01moL·L-1、 0.005moL·L-1 4種不同浓度的酸性高锰酸钾溶液,滴入各盛有2mL甲苯的4支试管中进行实验,至少在5分钟内看不到甲苯使高锰酸钾溶液褪色的迹象。这说明,无论在常温下还是加热条件下,甲苯被酸性高锰酸钾氧化的反应速率实在太慢,以致于在有限的时间内观察不到酸性高锰酸钾溶液褪色现象,因此有必要对教材上这一实验进行改进。
甲苯与酸性高锰酸钾溶液反应的化学方程式为:
我们知道,发生化学反应的先决条件是反应物的分子(或离子)直接碰撞,碰撞机会越多,反应可能会越快。酸性高锰酸钾溶液与甲苯互不相溶,分属于水相、有机相,具有强氧化性的MnO-4离子与有机分子(甲苯分子)碰撞机会少,况且MnO-4离子在水溶液中是水合离子,周围被水分子包围,与有机分子直接接触更困难,导致两者反应缓慢。增加氧化剂浓度或加热可加快反应,但短时间也看不到实验现象——紫色变浅或褪去,占用了较多课堂教学时间。
解决问题的关键是通过怎样的方法增加MnO-4离子与有机分子直接接触的机会?或通过怎样的手段使KMnO4或MnO-4离子能“溶于”甲苯?从而使氧化反应在有机相(均相)中进行。
2 实验原理
一种固体无机化合物或它的水溶液与另一溶于非极性溶剂的物质混在一起,因两者分别处于互不相溶的两相(固液两相或液液两相),难以发生化学反应。要使它们发生反应的新的办法是应用相转移催化作用,即在两相体系中加入少量在有机相和水相中都能溶的试剂(称相转移催化剂),它可穿过两相之间的界面把反应实体(如MnO-4)从水相转移到有机相中,使它与底物(有机溶剂中的溶质或纯有机溶剂)反应,并把反应中生成的另一种阴离子带回水相中,而相转移催化剂没有损耗,只是重复地起“运送”阴离子的作用[2]。
本实验所用的相转移催化剂是18冠醚6,其分子结构如图1所示。
18冠醚6分子结构的最大特点是分子内有大的空穴,空穴大小260~320pm,空穴的一边均匀分布着负电荷密度大的6个氧原子,这种特殊的结构决定了它具有特殊的化学性质——很强的配合能力,如与钾离子(直径266pm)形成配合物的稳定常数lgK=6.1[3]。
在溶有18冠醚6的甲苯溶液中,滴入高锰酸钾溶液,冠醚环上氧原子的孤对电子与K+离子配位,形成稳定配合物,形象地表示为“钾离子落到分子中心的洞穴里”,并利用冠醚配离子对有机溶剂的亲和性,使得钾离子从水溶液转移到有机溶剂,带负电荷的MnO-4离子也随之进入有机溶剂中,形成如图2所示结构。
18冠醚6使高锰酸钾间接地“溶于”甲苯,这时的MnO-4离子是完全裸露的自由的阴离子,没有溶剂化的影响,因而氧化能力更强。MnO-4离子被甲苯还原后,由于正负电荷的抗衡作用,配合了K+离子的18冠醚6有机配离子往返“运送”水相中的MnO-4离子到有机相(甲苯)中,氧化反应继续进行,而18冠醚6没有损耗,最终高锰酸钾溶液褪色。
3 实验药品与仪器
高锰酸钾、18冠醚6、甲苯、二甲苯(以上4种药品均为分析纯试剂)、蒸馏水;温度计、试管、烧杯、量筒、电子天平、药匙、玻璃棒、胶头滴管、热水
4 实验改进
4.1 实验准备
先配制浓度为0.05moL·L-1的高锰酸钾溶液50mL,再取部分配制好的该溶液用蒸馏水稀释成0.02moL·L-1、 0.01moL·L-1、 0.005moL·L-1 3种不同浓度的高锰酸钾溶液。
用量筒取30mL甲苯于50mL小烧杯中,加入0.9g 18冠醚6晶体,搅拌,使其充分溶解,得冠醚的甲苯溶液(A溶液)。再分别取30mL甲苯,用同样方法配制含有1.8g和3.6g 18冠醚6的两种甲苯溶液——B溶液和C溶液。
4.2 实验过程与现象
4.2.1 实验1
取4支试管,向其中分别加入2mL上述冠醚的甲苯溶液(A溶液),再分别滴加3滴上述4种浓度的高锰酸钾溶液,振荡,观察现象。分别用B溶液、C溶液重复上述实验操作,观察现象(见表1)。
上述实验溶液紫色褪去的同时,下层(水层)还出现棕色浑浊。
4.2.2 实验2
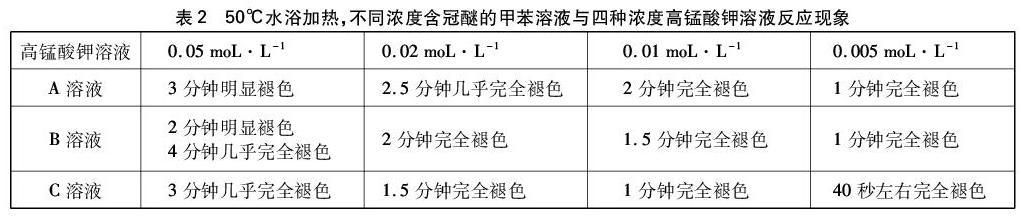
50℃水浴加热下,每次实验取冠醚的甲苯溶液2mL,高锰酸钾溶液3滴,现象记录如表2所示。
上述实验溶液紫色褪去的同时,下层(水层)还出现棕色浑浊。
4.2.3 实验3
80℃水浴加热,不同浓度冠醚的甲苯溶液与不同浓度高锰酸钾溶液反应。实验结果,0.005moL·L-1、 0.01moL·L-1、 0.02moL·L-1高锰酸钾溶液半分钟左右完全褪色,0.05moL·L-1高锰酸钾溶液1分钟左右完全褪色,溶液褪色的同时下层(水层)均出现棕色浑浊。
实验说明:
(1) 在常温或水浴加热条件下,将适量18冠醚6晶体放入不同浓度的高锰酸钾溶液中振摇,实验发现溶液不褪色,说明18冠醚6与高锰酸钾不发生反应。
(2) 高锰酸钾溶液紫色褪去时,由于各人对略微褪色、较明显褪色、明显褪色、完全褪色的判斷标准可能不一致,在褪色时间判断上可能有一定的偏差,但在相对比较上现象明显不影响实验结果。
(3) 醚官能团在强酸性且加热环境下结构不稳定,为避免影响实验效果,本实验所用的高锰酸钾溶液没有加硫酸酸化。本实验中棕色沉淀是高锰酸钾的还原产物二氧化锰。
4.3 实验结果
基于上述实验探索,化学教材上的实验可改为: 取一支试管,向其中加入1~2粒绿豆大小的18冠醚6晶体,再向试管中加入2mL甲苯,振荡,使其全部溶解,得冠醚的甲苯溶液(冠醚浓度相当于上述实验B溶液或C溶液浓度)。在所得溶液中滴加3滴高锰酸钾溶液(中性),振荡试管,观察实验现象。必要时把试管放入50℃以上的水浴中加热,观察实验现象。高锰酸钾溶液浓度应控制在0.02moL·L-1及以下的浓度为宜,实验时间短,现象明显。教师也可以根据教学实际需要,将实验改成学生研究性学习项目: 控制实验变量,研究单一条件(温度、氧化剂浓度、催化剂用量)改变对反应速率的影响,从而探究影响化学反应速率的外部因素,寻找甲苯使高锰酸钾溶液褪色的合适条件,培养学生科学探究能力。
5 课堂应用与反思
课堂教学中,可先按照教材上的实验方案进行演示,并与二甲苯进行对比,甲苯反应不理想的实验效果激发学生进一步探究的欲望。根据影响化学反应速率的因素,引导学生进行分析讨论,认识影响化学反应的条件是复杂的,同时是可以控制的。在控制单一变量的科学探究中,获得理想的化学实验效果,不仅体现化学理论对化学实践的指导作用,更可培养学生敢于质疑、勇于创新的思维品质和严谨求实的科学态度。
新版《普通高中化学课程标准》中“物质结构与性质”模块增加了“超分子、聚集态”等教学内容[4],丰富了中学教育所应认识的微粒种类,这是化学科学发展对中学教育提出的新要求,化学教师应积极探索化学新知识、新技术在日常教学中的应用。本实验涉及超分子化学领域,18冠醚6是主体,钾离子是客体,主客体通过配位键形成了超分子,18冠醚6在反应中起相转移催化作用。由此可见,化学教师必须紧跟时代步伐,加强化学学科新知识的学习,积极改进并开发能体现化学学科特色、融入前沿学科知识的创新实验,发展学生化学学科核心素养。
参考文献:
[1]王祖浩主编. 普通高中课程标准实验教科书·有机化学基础(第四版)[M]. 南京: 江苏教育出版社, 2014: 52.
[2]邢其毅, 徐瑞秋等. 基础有机化学(第二版上册)[M]. 北京: 高等教育出版社, 1993: 423~426.
[3][英]J. W. 斯蒂德, J. L. 阿特伍德著. 赵耀鹏, 孙震译. 超分子化学[M]. 北京: 化学工业出版社, 2006: 81~82, 87.
[4]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[S]. 北京: 人民教育出版社, 2018: 43~44.
