茶树体胚APX基因克隆及其在体胚发生过程中的表达与酶活性分析
2019-06-20郭玉琼黄道斌李小桢朱晨张舒婷傅海峰周承哲欧阳明秋陈兰赖钟雄
郭玉琼 黄道斌 李小桢 朱晨 张舒婷 傅海峰 周承哲 欧阳明秋 陈兰 赖钟雄
摘 要 以铁观音茶树体胚为材料,克隆了茶树抗坏血酸过氧化物酶基因CsAPX(Genbank登录号为MG799534.1)。CsAPX基因包含一个长度为753 bp的开放阅读框(ORF),共编码250个氨基酸,并对其进行相关生物信息学分析。APX酶活性测定结果表明在球形胚至子叶胚阶段APX酶活性呈现下降趋势,并在子叶胚阶段到达最低值,随着体胚进一步的分化,在子叶胚、成熟胚和萌发胚阶段,茶树APX酶活性不断上升,总体呈“先降后升”的趋势。在体胚发生过程中CsAPX基因的表达分析显示,CsAPX基因在茶树体胚发生的5个阶段均存在显著差异表达,总体呈“升—降—升”的趋势,其中在萌发胚阶段的CsAPX基因的表达水平显著高于其他4个阶段,推测CsAPX基因在体胚发生过程中的萌发胚阶段发挥着重要的作用。
关键词 茶树体胚;抗坏血酸过氧化物酶;基因克隆;表达分析;酶活性分析
中图分类号 S571.1 文献标识码 A
Abstract The ascorbate peroxidase gene CsAPX (GenBank accession number: MG799534.1) was cloned from the somatic embryo of Camellia sinensis cultivar ‘Tieguanyin. The CsAPX gene contained an open reading frame (ORF) of 753 bp in length, which would encode a total of 250 amino acids, and bioinformatics analysis about CsAPX gene was also employed. The total APX activity was measured during the whole somatic embryogenesis and the results showed that the total APX enzyme activity presented a downward trend in the globular embryo to cotyledonary embryo stage, and reached the lowest value in the cotyledon embryo stage. With the further differentiation of the embryo cells, the total APX enzyme activity increased continuously during the cotyledonary embryo stage, the embryo maturation stage and the germinating stage, and showed an overall trend of “decreasing first and then rising”. The expression of CsAPX was significantly different between the 5 stages of the somatic embryogenesis, showing an overall trend of “up-down- up” with a significantly higher expression level in the germinating stage than in the other 4 embryo stages. It was speculated that CsAPX played an important role in the germinating stage.
Keywords somatic embryo of tea plant; ascorbate peroxidase; gene cloning; expression analysis; enzyme activity analysis
DOI 10.3969/j.issn.1000-2561.2019.05.013
抗壞血酸过氧化物酶(ascorbate peroxidase,APX)是植物参与活性氧代谢的重要抗氧化酶之一,在清除活性氧和降低细胞氧化损伤等方面发挥着重要作用[1]。APX催化超氧化物阴离子还原的化学反应为2AsA(抗坏血酸)+H2O2(过氧化氢)→2MDHA(单脱氢抗坏血酸)+H2O,其中APX以抗坏血酸(AsA)为电子供体,催化H2O2转变为H2O,降低植物细胞中活性氧的水平,减轻其对植物体的氧化损伤[2-3]。近年来,随着基因克隆技术的蓬勃发展,APX基因在拟南芥[4-5]、大麦[6]、甜菜[7]和橡胶树[8]等植物中已有相关研究。Davletova等[4]的研究发现,当APX基因的表达水平较低时,会导致拟南芥中叶绿体和过氧化物酶体的活性氧清除系统工作缓慢,不能及时分解光合作用和光呼吸中产生的H2O2,导致H2O2含量升高,引起植物细胞发生脂质过氧化损伤。罗丹等[5]研究发现,草酸胁迫能够有效诱导拟南芥APX基因转录水平的提高,而APX基因过表达后的拟南芥植株较野生型相比,对草酸胁迫的抵抗力大幅提高。Shi等[6]将大麦APX基因转入拟南芥后发现,在高温胁迫处理后,非转基因植株的叶片出现大量枯黄,而转基因植株的叶片仍然保持正常。Dunajska-Ordak[7]和Chao[8]也分别在甜菜和橡胶树中发现,APX基因的高效表达可以显著提高甜菜和橡胶树的抗逆性。最近,Tian等[9]研究发现盐胁迫和干旱胁迫能够诱导茶树APX基因的表达量显著上升。因此,APX基因在植物抗逆胁迫中发挥重要作用。
植物体细胞胚胎发生是植物体细胞在离体培养条件下,没有经过受精作用,通过与合子胚类似的发育途径形成新植株个体的过程。研究表明植物细胞的分化常常伴随着氧化胁迫,植物体胚胎发生作为植物细胞分化的重要系统,必然会存在抗氧化酶的表达,而正常情况下,细胞的代谢过程也会产生一定的氧化胁迫[10]。H2O2是植物体细胞胚胎发生过程中重要的信号传递物质,H2O2的过量积累会对细胞产生毒害作用,而低浓度的H2O2又是维持细胞稳定所必需的[11]。鉴于APX对H2O2的清除作用,植物体胚发生过程中必然存在一定程度的APX酶活性变化及APX基因的表达变化。目前,关于APX在植物体细胞胚胎发生过程中的作用已有一定研究[12-14]。邵巍[15]发现在龙眼体胚发生过程中,APX基因的表达量会随胚性细胞的不断分化而发生变化,且在体胚的不同发育阶段存在明显差异。王凤华等[16]利用mRNA差异显示技术发现APX基因是不同发育阶段龙眼胚性培养物中的主要差异表达基因,推测APX可能是影响体胚发生的关键因素之一。Stasolla等[17]研究表明在白云杉体胚发生的不同阶段发现了APX基因的表达模式与H2O2浓度变化存在一定的相关关系。因此了解体胚发生过程中APX基因的表达模式,对人工调控H2O2浓度,控制体胚发生和发育具有重要意义。
目前,有关茶树APX基因在体胚发生过程中的表达分析、酶活性分析和具体作用机制等相关研究还尚未见到报道。因此为研究茶树APX基因在茶树体胚发生过程中的具体功能,本研究以乌龙茶的代表品种‘铁观音茶树体胚为材料,进行了茶树胞质型APX基因克隆,利用生物信息学技术手段对基因及其蛋白质的理化特性进行分析,并进一步研究了茶树体胚发生过程中的APX酶活性变化和CsAPX基因的表达模式,以期明确APX基因在茶树体胚发生过程中的具体作用机制,为今后进一步利用生物技术手段建立茶树体胚发生系统奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料 乌龙茶品种‘铁观音未成熟胚,采自福建农林大学南区实践茶园。使用改良的MS培养基为基本培养基,参照课题组前期建立的茶树体胚发生再生体系[18],诱导铁观音茶树球形胚、心形胚、子叶形胚、成熟胚和萌发胚五个不同发育阶段的体胚,除萌发胚培养基中添加2 mg/L BA和0.1 mg/L IBA激素,其余培养基中均未添加激素。
1.1.2 主要试剂 RNA提取试剂盒购于上海申能博彩生物科技有限公司;TAE Buffer、ExTaq酶、pMD18-T载体、DNA Ligation Kit和Marker DL2000购自大连宝生物有限公司(TaKaRa);X-gal、IPTG、琼脂糖、氨苄青霉素、胰蛋白胨、酵母提取物和琼脂等购自厦门泰京生物技术有限公司;dNTP购自Promega公司。
1.2 方法
1.2.1 茶树体胚总RNA的提取和cDNA合成 茶树体胚总RNA的提取方法参考赵姗姗等[19]的方法,用1%琼脂糖凝胶电泳检测RNA质量,并通过Nanodrop 2000检测RNA的浓度和纯度。采用Clontech公司的SMART RACE逆转录试剂盒和Primpscript RT Reagent Kit试剂盒分别合成用于CsAPX基因克隆和茶树体胚发生过程中qPCR分析的cDNA,逆转录后的cDNA置于?20 ℃冰箱中备用。
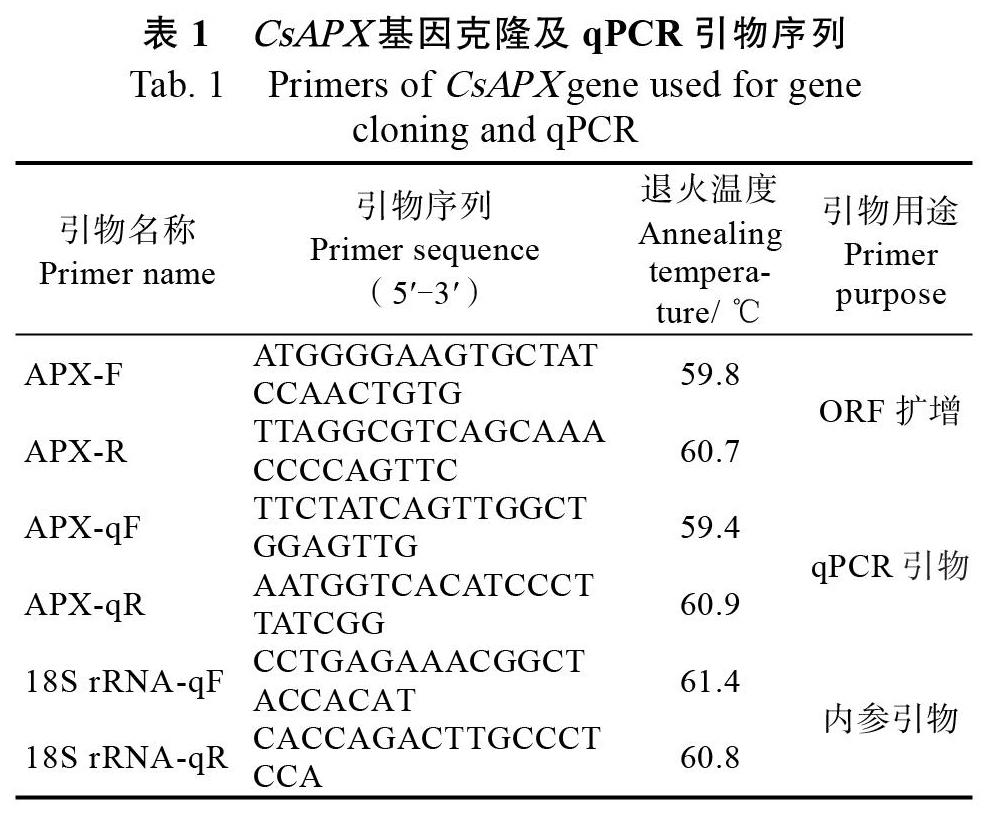
1.2.2 CsAPX基因的ORF扩增 根据Genbank中已登录的植物APX基因序列,在开放阅读框(ORF)的起始密码子ATG和终止密码子TAA处设计一对用于扩增CsAPX基因ORF的引物。以铁观音茶树体胚cDNA为模板,进行PCR扩增。PCR反应条件为:94 ℃预变性2 min,94 ℃变性1 min,52 ℃退火35 s,72 ℃延伸45 s,35个循环,72 ℃延伸10 min。参照朱晨等[20]的方法,进行PCR产物回收,连接及转化,挑选阳性克隆子进行测序。引物合成由福州尚亚生物技术有限公司完成(表1),相关测序由铂尚生物技术(上海)有限公司完成。
1.2.3 生物信息学分析 利用在线分析工具ExPASy ProtParam、ProtScale、EMBnet TMpred、SignalP 4.1 Server和TargetP 1.1 Server对CsAPX基因編码的蛋白质分别进行理化性质、蛋白亲水性、蛋白跨膜区段、信号肽及其断裂位点和亚细胞定位情况进行分析;CsAPX蛋白的二级结构和三级结构分别利用SOPMA和SWISS-MODEL进行预测;NetPhos 2.0、EMBnet COILS和STRING分别用于蛋白磷酸化位点;卷曲螺旋结构和蛋白互作关系分析;NCBI蛋白比对工具用于预测CsAPX蛋白的保守结构域;采用MEGA 6.0软件,依照邻位归并法(NJ)构建系统进化树。
1.2.4 茶树体胚发生过程中的APX酶活性变化分析 将0.5 g铁观音茶树体胚,加入5 mL酶提取液(50 mmol/L磷酸氢二钾-磷酸二氢钾缓冲溶液,pH 7.8;2 mmol/L抗坏血酸溶液;5 mmol/L乙二胺四乙酸溶液),冰浴研磨,在4 ℃条件下离心20 min,转速为10 000 r/min,吸取上清粗酶液后分装于离心管中置于4 ℃待测,每个样品进行3次生物学重复测定,茶树体胚APX酶活性的计算方法参考孙云等[21]的方法。
1.2.5 CsAPX基因在茶树体胚发生过程中的表达模式分析 设计特异性引物CsAPX-qF和CsAPX-qR进行qPCR扩增(表1),使用Roche LightCycler 480 qPCR仪检测CsAPX基因在茶树体胚发生过程中的表达模式,设置3次生物学重复。基因表达量采用相对定量法2?△△Ct法进行测定,选用18S rRNA作为qPCR内参基因[22],计算茶树体胚发生过程中CsAPX基因的相对表达量,并利用SPSS进行显著性差异分析。
2 结果与分析
2.1 CsAPX基因克隆与序列分析
以铁观音茶树体胚cDNA为模板,进行PCR扩增,电泳后得到一条约750 bp的单一条带,与预期长度一致。测序结果显示,CsAPX基因包含一个长度为753 bp的开放阅读框,编码250个氨基酸,在NCBI上进行blastn比对后发现,该基因序列与其他植物的APX基因序列的相似性较高。通过氨基酸序列多重比对分析
后进一步发现,茶树APX基因所编码蛋白的氨基酸序列与烟草(NP_001311803.1)、辣椒(NP_ 001311967.1)、番茄(NP_001318094.1)、葡萄(NP_001267988.1)、胡萝卜(XP_017228269.1)和草莓(XP_004294686.1)共6种植物胞质型APX蛋白的氨基酸序列具有90.44%的相似度,序列同源性高。因此确定其为茶树胞质型APX基因,并将其命名为CsAPX,并在GenBank上进行登录,登录号为:MG799534.1。将CsAPX氨基酸序列比对到茶树基因组中与茶树基因组进行序列多重比对分析[23-24],发现CsAPX氨基酸序列与茶树基因组中两条转录本的氨基酸序列(CSA017238,CSA018282)相似度高达96.60%。对这2条氨基酸序列进行Pfam注释后,发现注释结果为APX(PF00141),进一步证明克隆所得的CsAPX基因的正确性。
2.2 CsAPX基因编码蛋白的特征分析
运用ExPASy ProtParam分析CsAPX基因编码的蛋白基本理化性质,结果表明CsAPX蛋白的相对分子质量为27.634 ku,理论等电点(pI)为5.62,原子组成为C1240H1917N333O366S9,总原子数为3865;由20种氨基酸组成,其中含量最丰富的3种氨基酸依次为亮氨酸Leu(10.0%)、甘氨酸Gly(9.6%)和丙氨酸Ala(9.2%),而色氨酸Trp(0.8%)、谷氨酰胺Gln(1.6%)和半胱氨酸Cys(1.6%)的含量较低;CsAPX蛋白的不稳定系数为37.31,脂肪指数为77.72,总平均疏水性为?0.394,且不含有跨膜螺旋,表明CsAPX蛋白可能为稳定、亲水的中性蛋白;TargetP 1.1和SignalP 4.1预测CsAPX蛋白的亚细胞定位及信号肽情况,结果表明CsAPX蛋白可能定位于细胞质且为非信号肽蛋白。
蛋白质的结构与其功能密切相关,CsAPX蛋白二级结构预测结果显示CsAPX主要由40.0%的α-螺旋、12.4%的延伸链、6.8%的β-转角和40.8%的无规则卷曲结构构成;CsAPX蛋白与大豆APX蛋白的三级结构相似度为56%,三级结构类主要由螺旋和卷曲结构组成;利用NCBI网站进一步对CsAPX蛋白进行保守结构域分析后发现,CsAPX蛋白具有典型的APX蛋白保守结构域,隶属于过氧化物酶超家族,含有24个血红素结合位点,8个底物结合位点和6个K+离子结合位点。
蛋白水平上的磷酸化和去磷酸化修饰在植物的生长发育和代谢调控中起重要的作用,利用NetPhos对CsAPX蛋白进行磷酸化位点分析,结果表明CsAPX蛋白的氨基酸序列上存在16个潜在的磷酸化位点,包括3个丝氨酸(Ser)位点,6个苏氨酸(Thr)位点和7个酪氨酸(Tyr)位点。
利用STRING对CsAPX蛋白潜在的互作关系进行预测分析,结果表明CsAPX蛋白与谷胱甘肽还原酶(GR)蛋白的互作系数为0.944,抗坏血酸-谷胱甘肽循环中的MDHAR蛋白与CsAPX蛋白的互作系数为0.987,此外,CsAPX蛋白与过氧化物酶(CAT)蛋白的互作系数为0.970。
2.3 CsAPX基因编码蛋白进化树分析
为进一步了解CsAPX基因的生物学功能,采用MEGA6.0软件构建了植物APX蛋白氨基酸序列的系统进化树。结果显示,APX蛋白可分为胞质型APX蛋白(Group 1)、叶绿体型APX蛋白和过氧化物酶型APX蛋白三大分支。其中,胞质型茶树APX蛋白(Camellia sinensis,AUZ41890.1)与野草莓(Fragaria vesca,XP_004294686.1)、烟草(Nicotiana attenuata,NP_001311967.1)的胞質型APX基因处于同一分支(Group 1),序列相似度最高,推测可能具有类似的结构。而胞质型茶树APX蛋白与葡萄(Vitis vinifera,NP_001267988.1)和番茄(Solanum lycopersicum,NP_001318094.1)进化距离较远,可能在结构上存在一定差别;在Group 2中,叶绿体型茶树APX蛋白(Camellia sinensis,AFI98764.1)与枣(Ziziphus jujuba,XP_ 015885724.1)的进化距离最近;Group 3中的过氧化物酶型茶树APX基因(Camellia sinensis,AFI98389.1)和橡胶树(Hevea brasiliensis,XP_021659122.1)、猕猴桃(Actinidia chinensis,PSS25985.1)的序列相似度最高。进一步分析发现,3种类型茶树APX蛋白的进化距离较远,而同一类型的APX蛋白聚在一起,呈现出簇状分布,该聚类结果可能与同一类型APX蛋白功能相似有关。
2.4 茶树体胚发生过程中的APX酶活性变化和CsAPX基因的表达模式分析
测定了茶树球形胚、心形胚、子叶胚、成熟胚和萌发胚5个体胚发生阶段的APX酶活性,结果表明在茶树体胚发生过程中,APX酶活性呈先下降后上升的趋势;球形胚阶段APX酶活性最高,达到1482.4 U/mg;子叶胚阶段APX酶活性最低,为406.25 U/mg。
对CsAPX基因在体胚发育的不同阶段(球形胚、心形胚、子叶胚、成熟胚、萌发胚)的表达量进行分析,结果显示CsAPX基因在茶树体胚发生过程的表达模式总体呈现“升—降—升”的趋势。其中,在球形胚阶段的表达量最低;随着体胚发育的成熟,在心型胚和子叶胚阶段CsAPX基因的表达量呈上升趋势,并在子叶胚阶段达到第1个峰值,为球形胚阶段相对表达量的5.56倍;随后,成熟胚阶段APX基因的表达量相比于子叶胚阶段有所下降;而在萌发胚阶段CsAPX基因的表达量迅速上升且显著高于之前4个体胚阶段,为球形胚阶段相对表达量的的44.41倍。
3 讨论
3.1 CsAPX基因编码蛋白质的理化性质特点
本研究以乌龙茶的代表品种‘铁观音茶树体胚为材料,克隆得到胞质型CsAPX基因,并对其进行生物信息学分析,结果表明该基因编码的蛋白不具有信号肽,无跨膜螺旋区,亚细胞预测结果也表明CsAPX蛋白位于细胞质中。CsAPX蛋白具有典型的APX蛋白保守结构域,隶属于过氧化物酶超家族,含有24个血红素结合位点,8个底物结合位点和6个K+离子结合位点,丰富的结合位点可增强植物体中无机离子运输和调节代谢生长的能力。蛋白磷酸化位点预测表明APX蛋白有多个磷酸化位点,推测其在蛋白翻译过程中发生多次磷酸化修饰,可能与CsAPX基因参与调控植物生长发育并在多种胁迫的抗逆反应中起着重要作用。
3.2 CsAPX基因可能间接参与体胚发生调控
植物体胚发生是一个细胞分化的过程,该过程中可能有氧化胁迫的影响。而活性氧中一种相对稳定的小分子物质H2O2,通过调控细胞壁加厚和细胞信号传递分子Ca2+离子的浓度,从而影响调控胚胎发生的相关基因的表达促进胚性细胞分化[11]。程文瀚等[25]在棉花胚性愈伤诱导培养基中添加1 mmol/L的H2O2能够显著提高胚状体的产生效率,进一步证明H2O2可能参与体胚发生的调控。在本研究中,CsAPX基因在茶树体胚发生的5个阶段(球形胚、心形胚、子叶胚、成熟胚、萌发胚)均存在显著差异表达,总体呈“升—降—升”的趋势。其中,CsAPX基因在球形胚阶段的表达量最低。随着茶树体胚的不断发育,CsAPX基因在心形胚和子叶胚阶段的转录水平不断提高,并在子叶胚时期達到第一个峰值,与Zhang等[26]发现在落叶松体胚发生前期LIAPX、LISOD和LICAT基因的表达量均呈现上升趋势的研究结果一致。随着茶树体胚进一步发育,在成熟胚阶段CsAPX基因的转录水平有所下降,而在萌发胚阶段CsAPX基因的表达量迅速上升且显著高于之前4个体胚阶段。Luo等[27]研究表明高含量的H2O2会阻碍豆科植物沙打旺体胚的进一步发育。本研究发现在茶树体胚发育的萌发胚阶段CsAPX基因显著上调,可能促进清除过量的H2O2,从而有利于茶树体胚的发育,也表明高表达的CsAPX基因可能是诱导萌发胚继续进行体胚发生的重要因素之一。
3.3 茶树体胚发生过程中APX基因的表达模式与其酶活性变化趋势的不一致性
在体胚发生初期,一定浓度的H2O2有利于体胚发生的顺利进行,而APX酶对H2O2有很强的专一性,是植物体调节体内H2O2水平的关键因素[28]。分析茶树体胚发生5个阶段的APX酶活性,表明APX酶活性总体上呈现先下降后回升的变化趋势。其中,在球形胚至子叶胚阶段呈现下降趋势,并在子叶胚阶段到达最低值;随着体胚进一步的分化,在子叶胚、成熟胚和萌发胚阶段,APX酶活性不断增强,但仍然低于球形胚和心型胚阶段的APX酶活性。同时有研究表明CsAPX基因属于抗坏血酸氧化酶基因家族[9],进一步对APX基因进行分类发现,其可分为3种类型:胞质型APX基因、线粒体型APX基因以及叶绿体型APX基因[29]。本研究测定的APX酶活性是总CsAPX酶的活性,APX同工酶成员众多,且是由不同的APX基因家族成员编码蛋白组成,因而其活性可能受不同类型的APX基因表达量的共同影响。茶树体胚发生过程中的APX酶活性变化趋势与CsAPX基因的表达模式有所差异,与王凤华[30]、邵巍[15]研究龙眼体胚发生过程中的APX基因表达模式与其酶活性变化趋势不一致的结果相似。Mittler等[31]发现APX基因在胁迫条件下出现转录水平稳定上升,但APX蛋白质合成受阻的现象;Yoshimura等[32]发现在强光处理下,植物APX酶活性受到叶绿体型APX基因和胞质型APX基因共同影响,造成APX酶活性变化幅度远远小于其基因转录水平的变化幅度,因此APX酶活性的变化可能受到转录水平、转录后水平、翻译水平、酶原激活和mRNA-蛋白质复合体(mRNP)积累水平[33]等多重调控因素的影响。此外,本研究的供试茶树材料品种为铁观音体胚,杂合度较高,克隆所得的CsAPX基因的等位基因及对应蛋白的序列和活性可能存在差异,从而也可能导致APX基因的表达模式与其酶活性变化趋势的不一致性。为进一步明确CsAPX基因各成员表达水平与APX酶活性之间的关系,今后将对CsAPX基因家族在茶树全基因组水平上进行鉴定与分析。
本研究在CsAPX互作蛋白预测中还发现,APX蛋白与植物抗氧化酶系统中的CAT蛋白和抗坏血酸-谷胱甘肽循环中的MDHAR蛋白以及GR蛋白可能通过协同调控作用共同调节不同体胚阶段植物体内的H2O2浓度,以促进不同体胚发生和后续茶树形态发生,这对今后进一步研究茶树体胚发生过程中CsAPX蛋白的互作调控机制提供了新的思路。因此,后续可利用酵母杂交系统和免疫共沉淀等新型技术手段进一步探究CsAPX蛋白在茶树体胚发生过程中的互作机制。
参考文献
Shen G X, Kuppu S, Venkataramani S, et al. ANKYRIN REPEAT-CONTAINING PROTEIN 2A is an essential molecular chaperone for peroxisomal membrane-bound ASCOR BATE PEROXIDASE3 in Arabidopsis[J]. The Plant Cell, 2010, 22(3): 811-831.
Mittler R, Lam E, Shulaev V, et al. Signals controlling the expression of cytosolic ascorbate peroxidase during pathogen-induced programmed cell death in tobacco[J]. Plant Molecular Biology, 1999, 39(5): 1025-1035.
Pandey S, Fartyal D, Agarwal A, et al. Abiotic stress tolerance in plants: myriad roles of ascorbate peroxidase[J]. Frontiers in Plant Science, 2017, 8: 581.
Davletova S, Rizhsky L, Liang H J, et al. Cytosolic ascorbate peroxidase 1 is a central component of the reactive oxygen gene network of Arabidopsis[J]. The Plant Cell, 2005, 17(1): 268-281.
羅 丹. 拟南芥中响应草酸胁迫的APX1基因及TMS1基因的功能分析[D]. 福州: 福建农林大学, 2012.
Shi W M, Muramoto Y, Ueda A, et al. Cloning of peroxisomal ascorbate peroxidase gene from barley and enhanced thermotolerance by overexpressing in Arabidopsis thaliana[J]. Gene, 2001, 273(1): 23-27.
Dunajska-Ordak K, Skorupa-K?aput M, Kurnik K, et al. Cloning and expression analysis of a gene encoding for ascorbate peroxidase and responsive to salt stress in beet (Beta vulgaris)[J]. Plant Molecular Biology Reporter, 2014, 32(1): 162-175.
Chao J Q, Zhang S X, Chen Y Y, et al. Cloning, heterologous expression and characterization of ascorbate peroxidase (APX) gene in laticifer cells of rubber tree (Hevea brasiliensis Muell. Arg.)[J]. Plant Physiology and Biochemistry, 2015, 97: 331-338.
Tian K H, Pan C, Yang Y F, et al. Differential expression of the ascorbate oxidase multigene family of Camellia sinensis in response to stress[J]. The Journal of Horticultural Science and Biotechnology, 2019, 94(2): 160-170.
方智振, 赖钟雄, 赖呈纯, 等. 龙眼体细胞胚发生中期的蛋白质组学研究[J]. 中国农业科学, 2011, 44(14): 2966-2979.
李惠华, 赖钟雄. 植物抗坏血酸过氧化物酶研究进展(综述)[J]. 亚热带植物科学, 2006, 35(2): 66-69.
Belmonte M F, Macey J, Yeung E C, et al. The effect of osmoticum on ascorbate and glutathione metabolism during white spruce (Picea glauca) somatic embryo development[J]. Plant Physiology and Biochemistry, 2005, 43(4): 337-346.
Jariteh M, Ebrahimzadeh H, Niknam V, et al. Developmental changes of protein, proline and some antioxidant enzymes activities in somatic and zygotic embryos of persian walnut (Juglans regia L.)[J]. Plant Cell, Tissue and Organ Culture, 2015, 122(1): 101-115.
Khan M A, Abbasi B H, Ali H, et al. Temporal variations in metabolite profiles at different growth phases during somatic embryogenesis of Silybum marianum L.[J]. Plant Cell, Tissue and Organ Culture, 2015, 120(1): 127-139.
邵 巍. 龙眼胚性培养物胞质型apx基因克隆及其表达研究[D]. 福州: 福建农林大学, 2008.
王凤华, 赖钟雄, 郑金贵, 等. 龙眼体细胞胚胎发生过程的基因差异表达[J]. 农业生物技术学报, 2005, 13(6): 703-708.
Stasolla C, Van Z L, Egertsdotter U, et al. The effects of polyethylene glycol on gene expression of developing white spruce somatic embryos[J]. Plant Physiology, 2003, 131(1): 49-60.
郭玉琼, 黄道斌, 常笑君, 等. 铁观音茶树体胚发生及其内源激素变化研究[J]. 应用与环境生物学报, 2018, 24(5): 1-15.
赵姗姗, 郭玉琼, 潘一斌, 等. 铁观音茶树叶片总RNA提取方法研究[J]. 龙岩学院学报, 2015, 33(2): 78-81.
朱 晨, 张舒婷, 常笑君, 等. 茶树几丁质酶基因的克隆及其在干旱胁迫下的表达分析[J]. 熱带作物学报, 2017, 38(5): 894-902.
孙 云, 江春柳, 赖钟雄, 等. 茶树鲜叶抗坏血酸过氧化物酶活性的变化规律及测定方法[J]. 热带作物学报, 2008, 29(5): 562-566.
Hao X Y, Horvath D, Chao W, et al. Identification and Evaluation of Reliable Reference Genes for Quantitative Real-Time PCR Analysis in Tea Plant (Camellia sinensis (L.) O. Kuntze)[J]. International Journal of Molecular Sciences, 2014, 15(12): 22155-22172.
Xia E H, Zhang H B, Sheng J, et al. The tea tree genome provides insights into tea flavor and independent evolution of caffeine biosynthesis[J]. Molecular Plant, 2017, 10(6): 866-877.
Wei C L, Yang H, Wang S B, et al. Draft genome sequence of Camellia sinensis var. sinensis provides insights into the evolution of the tea genome and tea quality[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(18): E4151-E4158.
程文翰. 棉花(Gossypium hirsutum L.)体细胞胚胎发生的生理及分子机制研究[D]. 石河子: 石河子大学, 2016.
Zhang S G, Han S Y, Yang W H, et al. Changes in H2O2 content and antioxidant enzyme gene expression during the somatic embryogenesis of Larix leptolepis[J]. Plant Cell, Tissue and Organ Culture, 2009, 100(1): 21-29.
Luo J P, Jiang S T, Pan L J. Enhanced somatic embryogenesis by salicylic acid of Astragalus adsurgens Pall.: relationship with H2O2 production and H2O2-metabolizing enzyme activities[J]. Plant Science, 2001, 161(1): 125-132.
盛德策, 李凤兰, 刘忠华. 植物体细胞胚发生的细胞生物学研究进展[J]. 西北植物学报, 2008, 28(1): 204-215.
李 娜, 陆 海. 植物抗坏血酸过氧化物酶基因家族研究进展[J]. 成都大学学报(自然科学版), 2011, 30(2): 97-101.
王凤华. 龙眼体细胞胚胎发生过程中的基因差别表达[D]. 福州: 福建农林大学, 2003.
Mittler R, Feng X, Cohen M. Post-transcriptional suppression of cytosolic ascorbate peroxidase expression during pathogen-induced programmed cell death in tobacco[J]. The Plant Cell, 1998, 10(3): 461-473.
Yoshimura K, Yabuta Y, Ishikawa T, et al. Identification of a cis element for tissue-specific alternative splicing of chloroplast ascorbate peroxidase pre-mRNA in higher plants[J]. The Journal of Biological Chemistry, 2002, 277(43): 40623-40632.
Erickson S L, Lykke-Andersen J. Cytoplasmic mRNP granules at a glance[J]. Journal of Cell Science, 2011, 124(Pt 3): 293-297.
