大孔树脂纯化苜蓿叶蛋白肽的工艺优化
2019-06-20许英一吴红艳
许英一 - 吴红艳 - 王 宇 王 彪
(1. 齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006;2. 黑龙江省农科院畜牧兽医分院,黑龙江 齐齐哈尔 161005)
紫花苜蓿(medicagosativa)是一种多年生的优良豆科牧草,有“牧草之王”的美称,是国内外主要栽培的牧草之一[1-3]。苜蓿叶蛋白的营养价值高,粗蛋白含量高达50%~60%,并且氨基酸组成配比合理[4],据文献[5]报道许多氨基酸及其衍生物具有抗氧化能力,如半胱氨酸、组氨酸、色氨酸、赖氨酸、精氨酸等,可作为优良的蛋白原添加于饮料、焙烤等食品中。但由于苜蓿叶蛋白溶解性等功能性质较差,限制了其在食品中的应用。研究[6-8]表明,蛋白肽具有抗氧化、降血压、调节血清中血脂水平、抗癌、提高免疫等功能。谢正军等[9]通过提取、酶解和超滤从苜蓿叶蛋白中分离得到了相对分子质量不同的可溶性苜蓿叶蛋白及其酶解粗肽和精制肽,比较了其抗氧化活性,发现苜蓿叶蛋白几乎没有抗氧化活性,而酶解后的粗肽以及超滤后的精制肽均表现出较强的抗氧化活性,而且精制肽的抗氧化活性强于粗肽。因此,将酶解后的粗肽纯化后更适合应用于食品工业。
近年来,大孔树脂被广泛应用于多酚、生物碱、二氢槲皮素、皂苷等活性成分的分离纯化[10-11]。马寒冰等[12]进行了不同型号的大孔吸附树脂的静态吸附和解吸试验,确定DA201-C型大孔吸附树脂对大豆多肽的吸附性能及脱盐效果最佳,多肽含量提高了70.35%、糖和盐含量分别降低了70.80%和93.93%。李华等[13]采用超滤与大孔树脂吸附、乙醇分级洗脱分离纯化抗氧化黑豆肽,确定DA201-C型树脂对抗氧化肽的分离效果优于其他3 种树脂,体积分数为75% 乙醇洗脱组分具有相对最强的ORAC 值。综上,前人对豆科肽类的纯化研究较多,纯化效果也较好。但对苜蓿叶蛋白肽的制备及纯化研究较少。谢正军[14]研究了苜蓿叶蛋白酶解物超滤和脱盐工艺,采用先超滤再经大孔吸附树脂脱盐后,苜蓿叶蛋白酶解物的蛋白质含量仅提高了1.73%。为简化纯化步骤,本研究拟采用不经超滤仅用大孔吸附树脂脱盐工艺纯化苜蓿叶蛋白肽,并对苜蓿叶蛋白肽的纯化工艺进行优化,为植物叶蛋白肽类化合物进一步分离纯化提供试验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
紫花苜蓿:黑龙江省农科院畜牧兽医分院;
大孔树脂:DA201-C型,郑州华溢科技新材料股份有限公司;
大孔树脂:D101、HPD 500、HPD 600型,河北沧州宝恩化工有限公司;
大孔树脂:AB-8、X-5型,南开大学化工厂;
其他化学试剂:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
高速药物粉碎机:WK-600A型,青州市精诚机械有限公司;
分光光度计:722N型,上海精密科学仪器有限公司;
高速冷冻离心机:日立CR21G型,天美(中国)科学仪器有限公司;
电热恒温水浴锅:HHS21-4型,上海跃进医疗器械厂;
恒流泵:HL-2S型,上海青浦沪西仪器厂;
电脑全自动部份收集器:DBS-100型,上海沪西分析仪器厂有限公司。
1.2 试验方法
1.2.1 苜蓿叶蛋白肽的酶法水解制备工艺
苜蓿叶蛋白粉→配制一定底物浓度(g/mL)的水溶液→预热(50 ℃,30 min)→调节pH 8.5→加入一定量的碱性蛋白酶Alcalase 2.4 L→置于恒温水浴振荡器(120 r/min,50 ℃)酶解2 h→灭酶(沸水浴10 min)→离心(4 000 r/min,20 min)→上清液即为苜蓿叶蛋白肽
1.2.2 大孔吸附树脂预处理 用2倍树脂床体积(2 BV)5%的HCl,以2 BV/h的流速过柱浸泡2 h,用水洗至中性,再用2 BV 2%的NaOH溶液以同样流速过柱浸泡2 h,再用水洗至中性抽滤,备用。不同大孔吸附树脂的物理结构参数见表1。
1.2.3 大孔吸附树脂筛选 准确称取已处理好的6种不同类型大孔吸附树脂各10.000 0 g,分别置于100 mL具塞锥形瓶中,各加入质量浓度5 mg/mL的苜蓿叶蛋白肽溶液30 mL,将锥形瓶塞好塞子后置于恒温水浴振荡器中振荡10 h(25 ℃,150 r/min),待吸附完全后抽滤,测定被吸附后的苜蓿叶蛋白肽液质量浓度。吸附完全的6种树脂用100 mL蒸馏水冲洗至流出液呈中性,加入30 mL体积分数为75%的乙醇,在25 ℃,150 r/min振荡10 h进行解吸,过滤,测定滤液中苜蓿肽的质量浓度,按式(1)、(2)计算不同型号的大孔吸附树脂对苜蓿叶蛋白肽溶液的吸附率及解吸率。

表1 不同大孔树脂的物理结构参数
(1)
(2)
式中:
C0——吸附前溶液中肽的浓度,mg/mL;
C1——吸附后溶液中肽的浓度,mg/mL;
W2——解吸率,%;
C2——解吸液中肽的浓度,mg/mL;
V1——解吸液的体积,mL;
V——吸附液的体积,mL。
1.2.4 大孔吸附树脂(DA201-C)静态吸附—解吸试验
对于下一代图书馆服务平台(LSP),国内的湖北三新、超星、CALIS(Folio)、西安文渊等也在涉足。
(1) 静态吸附与解吸试验:于100 mL具塞锥形瓶中加入已处理好的大孔吸附树脂10.000 0 g,再加入30 mL质量浓度为5 mg/mL的苜蓿叶蛋白肽液,置于恒温水浴振荡器中振荡10 h(25 ℃,150 r/min),分别测定1,2,3,4,5,6,7,8,9,10 h被吸附后的酶解液浓度,按式(1)计算吸附率。绘制静态吸附曲线。
将充分吸附苜蓿叶蛋白肽的大孔树脂置于100 mL锥形瓶中,加入体积分数为75%的乙醇30 mL,同样在25 ℃,150 r/min振荡10 h进行解吸,分别测定1,2,3,4,5,6,7,8,9,10 h解吸液中的肽浓度。按式(2)计算解吸率。绘制静态解吸曲线。
(2) 酶解液浓度对吸附效果的影响:准确称取预处理过的大孔吸附树脂10.000 0 g于100 mL锥形瓶中,分别加入2.5,5.0,7.5,10.0 mg/mL的苜蓿叶蛋白肽液30 mL,在25 ℃,150 r/min的恒温水浴振荡器中振荡10 h,待充分吸附后过滤,测定滤液中肽液的质量浓度。计算吸附率。
(3) 乙醇体积分数对解吸效果的影响:对充分吸附了苜蓿叶蛋白肽溶液的大孔吸附树脂抽滤,分别用体积分数为25%,50%,75%,100%的乙醇解吸,收集10 h后的解吸液,过滤,测定滤液中肽液的质量浓度。计算解吸率。
1.2.5 大孔吸附树脂(DA201-C)动态吸附—解吸试验
(1) 上样流速对DA201-C型大孔吸附树脂吸附性能的影响:配制质量浓度为10 mg/mL的苜蓿叶蛋白肽溶液,分别以0.5,1.0,2.5 mL/min的流速流经层析柱,每10 mL 收集1管,测每次流出液中苜蓿叶蛋白肽的浓度,计算树脂的吸附率。
(2) 上样浓度对DA201-C型大孔吸附树脂吸附性能的影响:分别配制质量浓度为5,10,15 mg/mL的苜蓿叶蛋白肽溶液,以0.5 mL/min的流速流经层析柱,每10 mL 收集1管,测每次流出液中苜蓿叶蛋白肽的浓度,计算树脂的吸附率。
(3) 洗脱流速对DA201-C型大孔吸附树脂解吸性能的影响:将浓度为10 mg/mL的苜蓿叶蛋白肽溶液,以0.5 mL/min 的流速进行动态吸附。结束后抽滤,然后用体积分数为75%的乙醇溶液分别以0.5,1.0,2.5 mL/min的流速过柱解吸,每10 mL收集1管解吸液,测每次流出液中苜蓿叶蛋白肽的浓度,计算树脂的解吸率。
(4) 洗脱体积对DA201-C型大孔吸附树脂解吸性能的影响:将浓度10 mg/mL的苜蓿肽,以0.5 mL/min的流速进行动态吸附。结束后抽滤,用体积分数为75%的乙醇溶液以0.5 mL/min的洗脱流速过柱解吸,每10 mL收集1管解吸液,测每次流出液中苜蓿叶蛋白肽的浓度,计算树脂的解吸率。
1.2.6 DA201-C型大孔吸附树脂对苜蓿叶蛋白肽的纯化效果 测定经DA201-C型大孔吸附树脂纯化前后的苜蓿叶蛋白肽的含量、糖含量、盐含量。
1.2.7 总糖含量测定 蒽酮比色法[15]。
1.2.8 蛋白含量测定 Folin酚法[16]。
1.3 数据处理
采用SPSS 19.0软件进行统计分析,所有试验均重复3次,各试验数据均以平均值和标准误差表示,采用Duncan 法比较因素水平间的差异性(P<0.05)。
2 结果与分析
2.1 大孔吸附树脂筛选
由图1可知,非极性树脂对苜蓿肽的吸附和解吸能力较强,与陈飞平[17]40研究的结果相符,也说明苜蓿肽的疏水性较高。6种大孔树脂的吸附率和解吸率有显著性差异(P<0.05),DA201-C型的吸附率达到87.00%。采用体积分数75%乙醇溶液对吸附后的DA201-C型大孔树脂进行洗脱,解吸率亦最高为89.37%,DA201-C型大孔吸附树脂的吸附率和解吸率明显高于其他类型,因此本试验筛选DA201-C型大孔吸附树脂为纯化苜蓿叶蛋白肽的最适大孔树脂。在6种大孔树脂中,由于DA201-C型大孔树脂为非极性树脂,比表面积最大,且平均孔径相对较小,因此对疏水性多肽有较强的吸附性,而对分子量较大的蛋白吸附力差,可以达到分离纯化小分子苜蓿叶蛋白肽的目的[17]40。
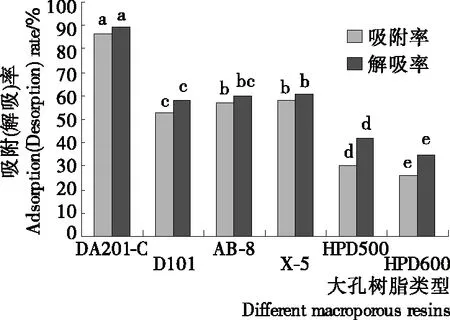
字母不同表示差异显著(P<0.05)
2.2 大孔吸附树脂(DA201-C)静态吸附—解吸试验
2.2.1 静态吸附—解吸动力学曲线 由图2可知,苜蓿叶蛋白肽吸附率和解吸率分别在前1 h和前3 h迅速增加,之后增加缓慢,基本达到平衡,属于快速平衡型。因此,DA201-C型大孔树脂对苜蓿叶蛋白肽具有良好的吸附和解吸性能。
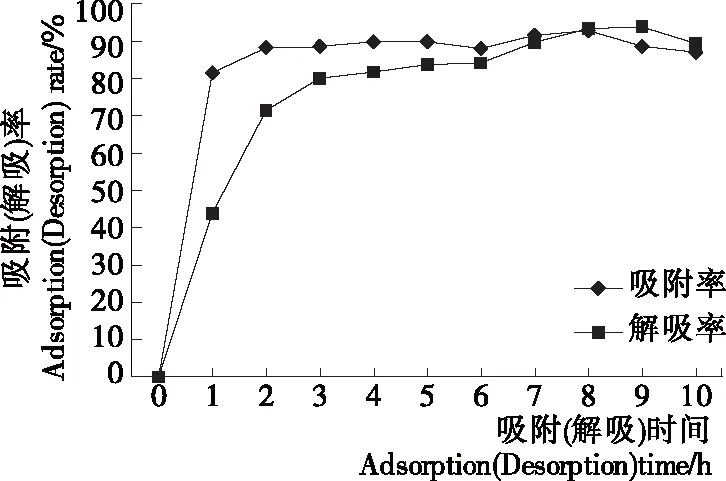
图2 DA201-C 型大孔树脂静态吸附—解吸动力学曲线
Figure 2 The kinetic curve of static adsorption and desorption of DA201-C macroporous resins
2.2.2 酶解液质量浓度对树脂静态吸附效果的影响 由图3可知,随苜蓿肽溶液浓度的增加,大孔树脂的吸附率先上升后下降,在苜蓿肽溶液浓度为7.5 mg/mL时最大,为88.95%。这与邓慧玲[18]的研究结果相符,可能是酶解液浓度达到一定时,肽分子数量增多,在扩散过程中相互碰撞,反而阻碍了向大孔树脂扩散的速度,导致吸附率下降。因此,酶解液的质量浓度控制在7.5 mg/mL。
2.2.3 乙醇体积分数对树脂静态解吸效果的影响 由图4 可知,随着乙醇体积分数的增加,大孔树脂的解吸率先上升后下降。解吸效果在乙醇体积分数75%最好。可能是高浓度乙醇会使蛋白质和一些肽类物质沉淀而解吸困难。
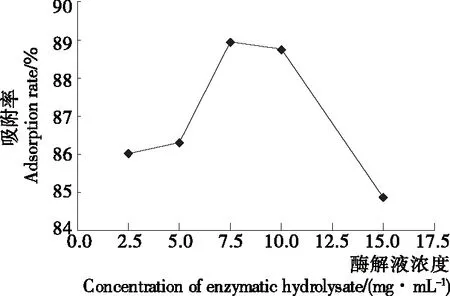
图3 酶解液质量浓度对吸附性能的影响
Figure 3 Influence of mass concentration of enzymatic hydrolysate on the adsorption efficiency

图4 乙醇体积分数对解吸效果的影响
2.3 大孔吸附树脂(DA201-C)动态吸附—解吸试验
2.3.1 上样流速对DA201-C型大孔吸附树脂吸附性能的影响 由图5可知,随着上样流速的增大,吸附率降低;上样流速为0.5 mL/min时,吸附率最大。可能是大孔树脂的吸附需要一个接触和扩散的过程,如果流速过快,酶解液来不及扩散到树脂的内表面就提早泄露而造成样品流失[17]44,吸附率就会下降。
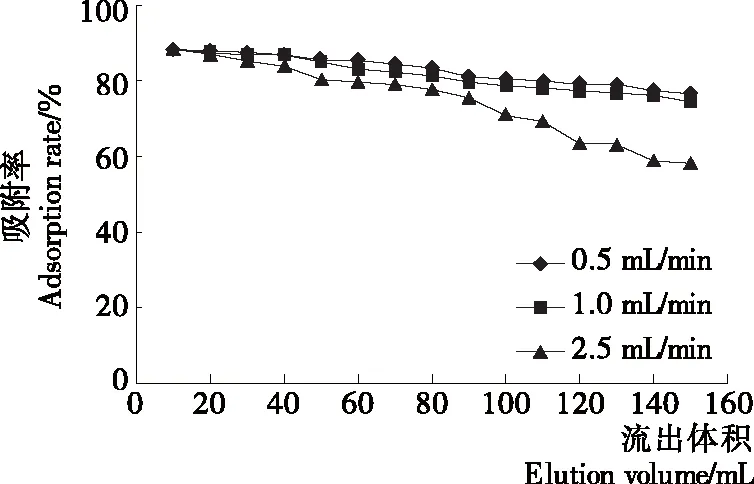
图5 上样流速对吸附性能的影响
2.3.2 上样浓度对DA201-C型大孔吸附树脂吸附性能的影响 由图6所示,在动态时各酶解液浓度均随着流出液体积的增加使吸附率降低,但相比较浓度为10 mg/mL吸附率降低的慢。由于某一型号的大孔吸附树脂吸附量一定,若酶解液浓度过高超出了吸附量,会造成水解物的损失,而较低的样品浓度会造成吸附率下降。因此确定10 mg/mL 为最佳上样浓度。
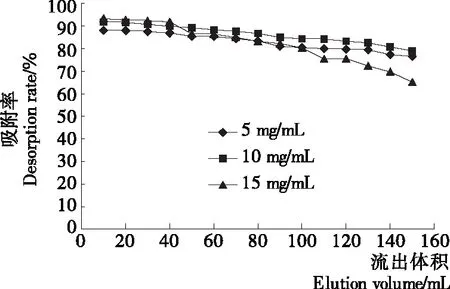
图6 上样浓度对吸附性能的影响
2.3.3 洗脱流速对DA201-C型大孔吸附树脂解吸性能的影响 由图7可知,随着洗脱体积增大,3种洗脱流速的大孔树脂解吸率均先迅速增加到最高点而后降低直至平稳,且均在洗脱体积10 mL达最高点。而当洗脱流速为0.5 mL/min时,解吸率最高,且解吸率从最高点下降至平稳趋势看,当洗脱流速为0.5 mL/min时,下降速度快,即最先达到洗脱平衡。因此本试验选择0.5 mL/min时作为最佳的苜蓿叶蛋白肽的洗脱流速。
2.3.4 洗脱体积对DA201-C型大孔吸附树脂解吸性能的影响 由图8可知,随着洗脱体积增加,解吸率先升到最高点后降低,当洗脱体积>50 mL后,解吸率较低,表明大部分苜蓿叶蛋白肽已被洗脱下来了。而在200 mL时,解吸率趋于平缓,解吸率达到6.4%,表明流出液中水解物含量已经很少,因此将75%乙醇洗脱剂体积定为200 mL。
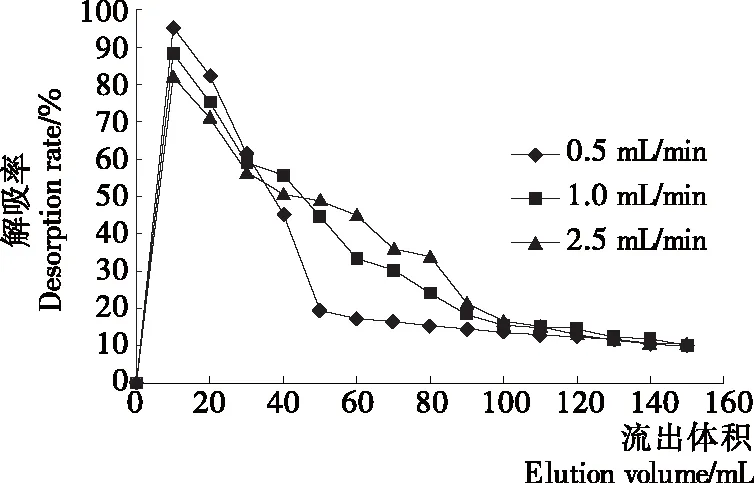
图7 洗脱流速对解吸性能的影响

图8 洗脱体积对解吸性能的影响
2.3.5 DA201-C型大孔吸附树脂对苜蓿叶蛋白肽的纯化效果 根据优化过程的结果分析,采用动态吸附。确定在上样浓度为10 mg/mL,上样流速为0.5 mL/min,采用DA201-C型大孔吸附树脂对苜蓿叶蛋白水解物进行动态吸附,再以200 mL的75%乙醇溶液作为洗脱剂,0.5 mL/min的洗脱流速对吸附后的大孔树脂进行解吸,收集洗脱液经旋转蒸发和冷冻干燥,得到纯化后的苜蓿叶蛋白肽,测定吸附前后的酶解物成分含量,其成分分析见表2。
表2苜蓿叶蛋白酶解液纯化前后成分分析†
Table2Compositionanalysisofalfalfaleafproteasehydrolysatebeforeandafterpurification%
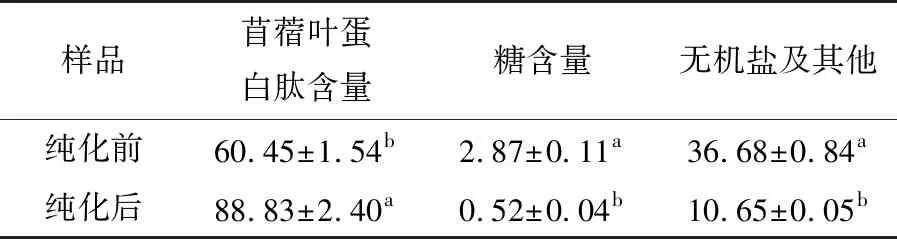
† 同列字母不同表示差异显著(P<0.05)。
由表2可看出,纯化后的苜蓿叶蛋白酶解液中苜蓿叶蛋白肽含量由60.45%提高到了88.83%,纯度较之前提高了46.95%。而糖含量由2.87%降低至0.52%,纯度降低了81.88%。无机盐等杂质的含量由36.68%降低至10.65%,纯度降低了70.97%,苜蓿叶蛋白酶解液营养成分在纯化前后有显著性差异(P<0.05),说明DA201-C型大孔吸附树脂能去除苜蓿叶蛋白酶解液中大部分无机盐及糖类。
3 结论
本试验首先对6种大孔吸附树脂进行筛选,确定DA201-C型大孔吸附树脂为苜蓿叶蛋白肽纯化的最适材料。通过静态吸附—解吸和动态吸附—解吸试验得到该工艺的最佳纯化条件为上样流速0.5 mL/min,上样浓度10 mg/mL,采用75%乙醇溶液解吸,洗脱流速0.5 mL/min,洗脱体积200 mL,在该条件下苜蓿叶蛋白肽含量较纯化前明显提高,说明优化的工艺参数可行。本试验探讨了采用大孔吸附树脂纯化苜蓿叶蛋白肽的优化工艺,若将其应用于食品或者保健品,还需要进一步动物试验和临床试验,研究苜蓿叶蛋白肽体内、体外抗氧化活性及抗氧化作用机理,为工业化生产高活性成分的苜蓿叶蛋白肽提供新方法。
