EGFR在肿瘤靶向治疗中的研究进展
2019-06-18张梦然盛唯瑾弓建华刘秀均
张梦然,盛唯瑾,弓建华,刘秀均
细胞信号传导是复杂生物信号传递系统的一部分,控制并协调细胞的基本活动。细胞接受信号并作出反应的能力是组织发育、修复、免疫应答及维持正常稳态的基础。其中,细胞因子受体参与信号转导是信号传导途径的重要组成部分。受体酪氨酸激酶(receptor tyrosine cytokines,RTKs)是一类重要的细胞表面受体。RTK 在控制大多数基本细胞过程中发挥重要作用,如细胞周期、细胞迁移、细胞代谢、细胞增殖和分化及细胞存活[1]。
1 表皮生长因子及配体
因子(HB-EGF)和表皮调节素(EPR),它们与 EGFR 和 ErbB4 结合;③含有神经调节蛋白(NRG)的配体可以进一步分为与 ErbB3 和 ErbB4 结合的NRG-1 和 NRG-2 以及与 ErbB4 结合的 NRG-3 和 NRG-4。
EGFR 位于上皮细胞的基底外侧膜,与配体相互作用后介导上皮细胞和细胞外基质之间的信号传导[5]。EGFR 有一个细胞外结构域,一个疏水跨膜结构域和含有细胞质酪氨酸激酶的结构域[1,3,6]。细胞外结构域由 4 个亚结构域组成(图1),即 L1、CR1、L2 和 CR2,CR 表示富含半胱氨酸的结构域。L1 和 L2 负责与配体结合[5,7]。JM 和 CT 表示近膜域和羧基末端。跨膜结构域(残基 622-644)位于 CR2 和近膜结构域之间,行使许多调节功能[7]。
特异性配体与 EGFR 胞外结构域结合后,促进同源二聚化和异源二聚化,激活细胞内蛋白酪氨酸激酶活性,导致 C 末端结构域中的酪氨酸残基自磷酸化[8],为具有 SH2 (Src homology domain)结构域和磷酸酪氨酸结合结构域(PTB)的蛋白质信号分子提供对接位点,从而激活信号传导途径的网络[5,7],启动的重要信号通路包括促分裂原活化蛋白激酶(MAPK)通路和磷脂酰肌醇 3 激酶(PI3K/Akt)通路。
有关 EGF 配体和受体家族在胚胎发育、生理学和病理学中的作用已经有大量的报道。EGFR 是一种多功能信号转导因子,在调节细胞生长、增殖、分化和迁移过程中发挥着重要作用[9]。EGFR 信号转导对胚胎发育过程中的细胞运动至关重要,EGFR 敲除将导致部分小鼠在围产期或中期妊娠时死亡,然而在一些品系中即便老鼠在出生后能存活 3 周,这些动物也会出现皮肤、肺、胃肠道、大脑和肝脏严重缺陷,证实了 EGF/EGFR 系统在上皮细胞调控中的重要性[6-7]。
表皮生长因子受体(epidermal growth factor receptor,EGFR)是一种受体型酪氨酸激酶,是成红细胞增多症癌基因 B(ErbB)家族的主要成员,分子量为 170 kD,在许多组织中表达,并参与多种细胞过程,对细胞的生长发育至关重要[2]。EGFR 家族包含 4 个结构相似的受体:EGFR(ErbB1,HER1)、ErbB2(neu,HER2)、ErbB3(HER3)和 ErbB4(HER4)[3]。
EGFR 是 ErbB 家族最早被发现的成员。ErbB2 也被称为 neu,因为它来自啮齿动物的胶质母细胞瘤细胞系[4],分子量为 185 kD,最初是在人乳腺癌和胃癌细胞中被鉴定和克隆的。它的基因在许多人类分泌性上皮组织中低水平表达[2]。ErbB3 是从人乳腺癌和表皮样癌 cDNA 文库中克隆的。该基因位于染色体 12q13 上,转录物 mRNA 在许多成体组织中表达,但在基质细胞中不表达。ErbB4 是 EGFR 家族最后一个被发现的成员[2]。
与 ErbB 受体家族结合的配体可以分成三类[2]:① EGF、转化生长因子-α(TGF-α)和双调蛋白(AR),它们与 EGFR 结合;② β-细胞素(BTC)、肝素结合性表皮生长
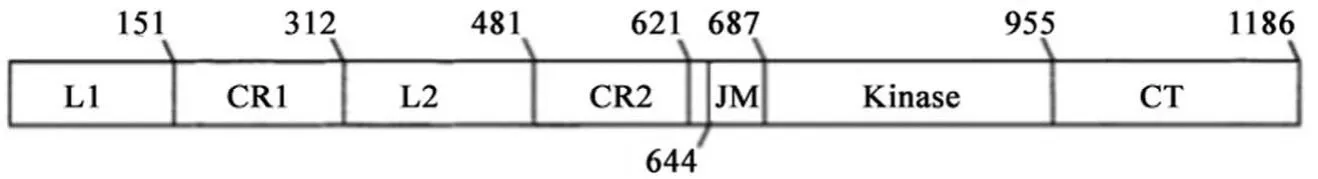
图1 表皮生长因子受体结构示意图
2 表皮生长因子受体与癌症
EGFR 在正常细胞和肿瘤细胞中均表达,在细胞的生长和分化过程中起重要作用。研究表明,在许多实体肿瘤中存在 EGFR 的高表达或异常表达。EGFR 与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关[10-11]。
EGFR 过表达在恶性肿瘤的演进中起重要作用,如成胶质细胞瘤、非小细胞肺癌、头颈癌、乳腺癌、结肠直肠癌、卵巢癌、前列腺癌、胰腺癌等[10-11]。许多物理刺激可以在没有配体结合时激活 EGFR,如渗透压、紫外线辐射和剪切应力[12]。TGF-α 是唯一能在不同组织中诱导正常细胞恶性转化的 EGF 样生长因子。EGFR 的过表达与头颈部、膀胱、宫颈、食管和卵巢等部位恶性肿瘤的存活率低有关[13]。
EGF 和 EGFR 可以通过多种方式调节肿瘤细胞增 殖与转移,其中最主要是 EGFR-Ras/Raf/MEK/ERK 和 EGFR-PI3K/Akt 途径。EGFR 激活促进了细胞增殖,参与了自噬活性的调节,同时促进癌细胞表达与侵袭和转移相关 的几种基质金属蛋白酶,从而下调抑癌基因 mRNA 表 达[10]。
EGFR 在癌细胞中通常突变或过表达,约 30% 的实体瘤的 EGFR 功能发生获得性遗传改变。2002年,有学者提出“致癌基因成瘾”概念,即一部分肿瘤细胞生长依赖于 EGFR 信号传导[14-15]。EGFR 介导的 PI3K/Akt 通路的激活促进了细胞的生长、转移以及凋亡抵抗。EGFR 突变对肿瘤类型有特异性,即 EGFR 的某些突变在一些特定肿瘤中常见,但在其他肿瘤中很少见[14]。
3 表皮生长因子受体靶向治疗
鉴于 EGFR 在多种恶性肿瘤中过表达或突变。靶向 EGFR 可能是一种高效的临床治疗方式。针对 EGFR 的分子靶向药物主要分为三类:① EGFR 单克隆抗体(mAbs),如西妥昔单抗和帕尼单抗等;②小分子受体酪氨酸激酶抑制剂(receptor tyrosine kinase inhibitor,TKIs),如吉非替尼、厄洛替尼和拉帕替尼等[16];③诱发对表达 EGFR 的肿瘤细胞产生免疫应答的 EGFR 疫苗[10]。西妥昔单抗和帕尼单抗都是 FDA 批准用于治疗结直肠癌的药物,可以阻断配体与 EGFR 的细胞外结构域结合,并可以诱导抗体和补体介导的细胞毒作用。与帕尼单抗相比,西妥昔单抗介导的细胞毒作用更强[15]。
EGFR 疫苗是一种非常具有前景的治疗方法,该方法使用 EGFR 变异体的特有序列作为抗原,激活体内的免疫反应,从而达到预防或治疗肿瘤的效果[17-18]。目前,已经研制出针对 EGFR 的疫苗,并通过 III 期临床试验在古巴和秘鲁上市。
从全球范围来看,EGFR 目前依旧是一个热门靶点,共有 48 个 EGFR 抑制剂临床在研,辉瑞、艾伯维、阿斯利康、诺华等巨头都在该靶点上有重点布局,包括抗体偶联药物(ADC)这样高端的研发管线。和国外不同,我国 EGFR 新药主要集中在化学药,这是由于靶向 EGFR 的小分子受 体酪氨酸激酶抑制剂主要的适应证为非小细胞肺癌,我国是一个肺癌大国,黄种人的 EGFR 突变率又高于欧美人种,故国内注重小分子受体酪氨酸激酶抑制剂的研发是由我国的癌症疾病谱决定的。
4 靶向 EGFR 的小分子受体酪氨酸激酶抑制剂
小分子受体酪氨酸激酶抑制剂是目前临床最常用的 EGFR 靶向药物。第一代为可逆抑制剂,包括吉非替尼、厄洛替尼和埃克替尼[14]等,是 I 型 ATP 竞争性 TKIs,可与过表达或过度活化的 EGFR 上 ATP 结合位点进行可逆性地结合,抑制 EGFR 磷酸化酪氨酸残基的形成,临床上成绩斐然。吉非替尼于 2003年在美国上市,由于与安慰剂组相比无法显著延长患者生存期,2005年退出美国市场。因其在许多非欧美人群中有良好的效果目前仍被用于一线治疗[14]。厄洛替尼是 FDA 批准的治疗患有 EGFR 突变的局部晚期或转移性非小细胞肺癌患者的治疗药物。但随着临床的广泛应用,耐药问题日益突出,其中,EGFR-T790M 突变约占临床耐药病人的 60% 以上[15]。
第二代为不可逆抑制剂,包括阿法替尼、来那替尼和达克替尼等,除竞争性占据 EGFR 上 ATP 结合位点外,还能与 EGFR 附近氨基酸残基发生烷基化作用或共价键结合,进而实现对 EGFR 的不可逆抑制。与第一代 EGFR-TKI 相比,第二代 TKIs 能与靶分子以稳定的共价键形式结合,形成的复合物更稳定,抑制效果更持久。阿法替尼是 EGFR 和 HER2 的双重抑制剂,临床用于治疗具有 EGFR 敏感性的局部晚期或转移性 NSCLC。达克替尼是泛 ErbB 抑制剂,治疗范围与阿法替尼相似。EGFR 可通过共价结合克服 T790M 突变引起的治疗耐药性,缓解第一代产生的皮肤毒性症状。
EGFR-TKI 在治疗后出现的耐药限制了其临床应用。目前 EGFR-TKI 耐药最主要的原因就是在 20 号外显子出现 T790 点突变[15]。针对该耐药机制,出现了第三代 EGFR-TKI,包括甲磺酸奥希替尼(AZD9291)、rociletinib(CLO-1686)、olmutinib(BI1482694/HM61713)、艾维替尼(AC0010)等[19]。
奥希替尼对 EGFR 敏感突变和 T790M 耐药突变均有更好的作用,旨在克服一二代 EGFR-TKI 引起的耐药,是首个获批上市用于经 EGFR-TKI 治疗时或治疗后病情进展的 T790M 突变阳性 NSCLC 的靶向药。Rociletinib 是另一个第三代 EGFR-TKI 药物,比奥希替尼早开始临床试验,两者的研发一直处于竞争状态。由于种种原因,rociletinib 没有被批准上市。HM61713 也是靶向 T790M 突变的第三代 EGFR 抑制剂,2016年在韩国上市。艾维替尼是在中国进行研发的第三代 TKI,目前正在进行临床试验[20]。
第四代 EGFR 抑制剂目前无上市品种,其中具有代表性的为诺华的 EGF-816(nazartinib),处于 II 期临床研究中,与 nivolumab 联合治疗非小细胞肺癌,对于实体瘤的研究已进入 I 期和 II 期临床。
5 小结
肿瘤分子靶向治疗抗肿瘤作用具有明显的特异性,相对于传统的化疗,毒性小,效果好,开启了肿瘤治疗的新领域、新思路。其中,EGFR 信号转导通路是恶性肿瘤信号传导网络中的重要组成部分,其中的蛋白,特别是 EGFR,在多种人类恶性肿瘤中过度表达或突变。临床数据显示靶向 EGFR 是一种有效的抗癌疗法,具有选择性高,副作用少等特点,但在实际使用时,仍存在如耐药、临床应答率不高等诸多挑战。随着靶向抗肿瘤药物在肿瘤治疗中应用范围的不断扩大,患者对新型抑制剂研发不断提出新诉求,这就需要科研人员进一步研究探索分子耐药以及毒性机制,采取有针对性的措施,研发多靶点药物以及合理的联合药物治疗方案,促进更加高效、安全的靶向药物的研发和应用。
