利用转录组二代测序探索直肠癌术前放化疗的敏感性分子特征
2019-06-18叶颖江任仙文申占龙
张 威,叶颖江,任仙文,黄 晶,申占龙△
(1. 北京大学人民医院外科肿瘤研究室, 北京 100044; 2. 北京大学人民医院胃肠外科, 北京 100044; 3. 北京大学生命科学学院生物动态光学成像中心, 北京 100871; 4. 北京大学基础医学院免疫学系, 北京 100191)
直肠癌术前新辅助放化疗后病理缓解是预后良好的指标。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)发布的相关指南中推荐,对局部进展期中、低位直肠癌患者(临床分期≥T3N+)行术前放化疗。该推荐主要基于术前放化疗可以有效控制直肠癌局部复发,其中18%~26%的患者放化疗后标本无肿瘤细胞,即肿瘤病理完全缓解(pathologic complete response, pCR)[1]。肿瘤放化疗反应的评估对于预测肿瘤治疗的疗效和制定进一步的治疗计划具有重要的意义。
目前临床应用较多的病理评价标准是Dworak肿瘤消退分级(tumor regression grading,TRG)[2],该分级主要通过组织病理标本中肿瘤细胞数量和组织纤维变性程度来判定,分为5级(TRG 4、3、2、1、0)。临床研究中通常将TRG分级进行归类,Rödel等[3]把Dworak TRG的五个分级分为三个等级,即病理完全缓解(TRG4)、病理部分缓解(TRG2+TRG3)和病理缓解差(TRG0+TRG1),发现在直肠癌接受术前放化疗和根治性手术切除后,病理完全缓解组的5年无病生存率(disease free survival,DFS)为86%,病理部分缓解组为75%,病理缓解差组为63%(P=0.006)。Fokas等[4]的研究也得到类似结果,386例接受直肠癌放化疗的患者中病理完全缓解组(TRG4)、病理部分缓解组(TRG2+TRG3)和病理缓解差组(TRG0+TRG1)的10年累计DFS分别为89.5%、73.6%和63.0%,组间差异有统计学意义(P=0.008)。
已有临床试验表明,术前放化疗后临床完全缓解(clinical complete remission,cCR)且未进一步行手术的患者,其结局与进一步接受手术的患者接近[5]。然而,在开始放化疗前,国内外尚无一种令人满意的方法能预测直肠癌患者放化疗后的病理缓解情况,因此目前迫切需要一种手段,能够将术前放化疗后可能病理完全缓解、部分缓解和缓解差的直肠癌人群区分开,从而实现直肠癌精准分层的个体化治疗。患者对治疗的反应可能由遗传基因决定,同一类疾病同一种治疗方案可能因不同的基因特点产生不同的疗效[6],因此分子生物学有可能揭示直肠癌放化疗敏感性的基因学基础。
1 资料与方法
1.1 研究对象
前瞻性纳入30例局部进展期中、低位直肠癌患者,术前放化疗方案为常规长程同步放化疗:45.0~50.4 Gy (1.8~2.0 Gy/次,5次/周,共25次),同步5-氟尿嘧啶(5-fluorouracil,5-FU)或卡培他滨化疗,放化疗后6~8周手术。30例患者均为2018年1—12月期间就诊于北京大学人民医院胃肠外科并经过术前新辅助治疗和手术治疗的直肠癌患者。本研究通过北京大学人民医院医学伦理委员会审核并获得所有患者的知情同意。
1.2 研究方法
前瞻性收集临床病理资料完整的30例局部进展期中、低位直肠癌患者并整理其相关资料,包括:一般情况(性别、年龄、体重指数)、放化疗前影像学检查资料[术前MRI T分期、N分期,壁外血管侵犯(extramural vascular invasion, EMVI),肿瘤大小]、病理活组织检查资料[肿瘤组织类型(腺癌、黏液腺癌、印戒细胞癌)、肿瘤分化程度(低分化、中分化、高分化)]等9项指标纳入研究分析。
前瞻性留取30例患者新辅助治疗前的肠镜活检病理样本,-80 ℃保存备用。依据治疗方案,30例患者均在放化疗后6~8周接受手术治疗,术后对患者进行病理TRG评估,根据放化疗后的病理反应特点分为三组:病理完全缓解组(TRG4)、病理部分缓解组(TRG2+TRG3)和病理缓解差(TRG0+TRG1)组。对患者肿瘤组织进行转录组测序,整合测序数据进行系统生物信息学分析,注释各组配对标本产生的突变数据,并分析转录组数据所提示的表达特征,从RNA水平定义与放化疗反应相关的分子特征。
1.3 统计学分析
应用SPSS 20.0统计软件进行分析,计数资料均采用Fisher’s确切概率检验,P<0.05为差异有统计学意义。
2 结果
2.1 局部进展期中、低位直肠癌术后病理TRG分级及与临床病理指标分析
前瞻性收集30例临床病理资料完善的患者信息,由两名病理科医生对术后病理进行TRG分级评估,其中完全缓解9例、部分缓解12例、缓解差9例。TRG分级与患者临床病理指标分析显示,直肠癌放化疗后病理TRG缓解程度与肿瘤术前MRI的T分期呈统计学负相关(P=0.046),与术前MRI直肠癌EMVI呈统计学正相关(P=0.003,表1)。
2.2 转录组测序数据进行生物信息学分析
转录组测序获得RNA-seq数据,平均每个样本的测序深度达到3 000万150 bp长的双端测序读段,分析获得平均TPM (transcripts per million)≥100的转录本达863条,平均TPM≥10的转录本达8 898条,平均TPM≥1的转录本达47 040条。其中,与病理缓解程度相关的转录本P≤0.05的共有217条,P≤0.001的共有22条。对与术前放化疗病理缓解相关的转录本表达情况进行分析,其中HSPA1A、HSPA1B和EXOSC2的高表达和术后病理缓解差呈显著正相关(P<0.05),而DNMBP、WASH8P、FAM57A和SGSM2的高表达和术后病理缓解良好呈显著正相关(P<0.05,图1)。
3 讨论
3.1 直肠癌的临床病理特点与治疗结局密切相关
Williamson等[7]研究发现,直肠癌术前MRI中发现EMVI阳性的患者放化疗后病理完全缓解率和预后明显优于EMVI阴性的患者,而且CpG岛高甲基化的患者EMVI的阳性率明显较高。EMVI阳性即肠壁外的脉管受侵,肿瘤侵犯超过脉管系统固有层,是直肠癌的一种预后不良因素。EMVI通过引起血管纤维化对新辅助放化疗起作用。Chand等[8]采用MRI检测发现,新辅助放化疗后EMVI纤维化显著的患者无病生存期较好、肿瘤复发率较低,这可能是EMVI阳性患者放化疗后病理完全缓解率和预后明显优于EMVI阴性者的原因之一。Birlik等[9]发现,直肠癌放化疗前MRI检查,放化疗病理缓解组的表观扩散系数(apparent diffusion coeffecient,ADC)明显低于未缓解组,术前MRI检查的ADC值可能是预测直肠癌放化疗效果的一项指标。McCawley等[10]的荟萃分析发现,1 724例接受术前放化疗的直肠癌患者中,组织病理为黏液腺癌的患者放化疗后病理完全缓解率(OR=0.078,P=0.002)和肿瘤降期率(OR=0.318,P<0.001)均明显低于非黏液腺癌组。Agarwal等[11]的研究发现,直肠癌患者放化疗前有淋巴管、血管侵犯与对放化疗的反应显著相关。Maas等[12]和Gérard等[13]则发现直肠癌患者放化疗前的临床T分期明显影响放化疗后肿瘤病理缓解度,T分期越早,放化疗后病理缓解越好,同时Gérard等[13]的研究还发现,患者的性别、肿瘤大小也与放化疗后肿瘤病理缓解相关。
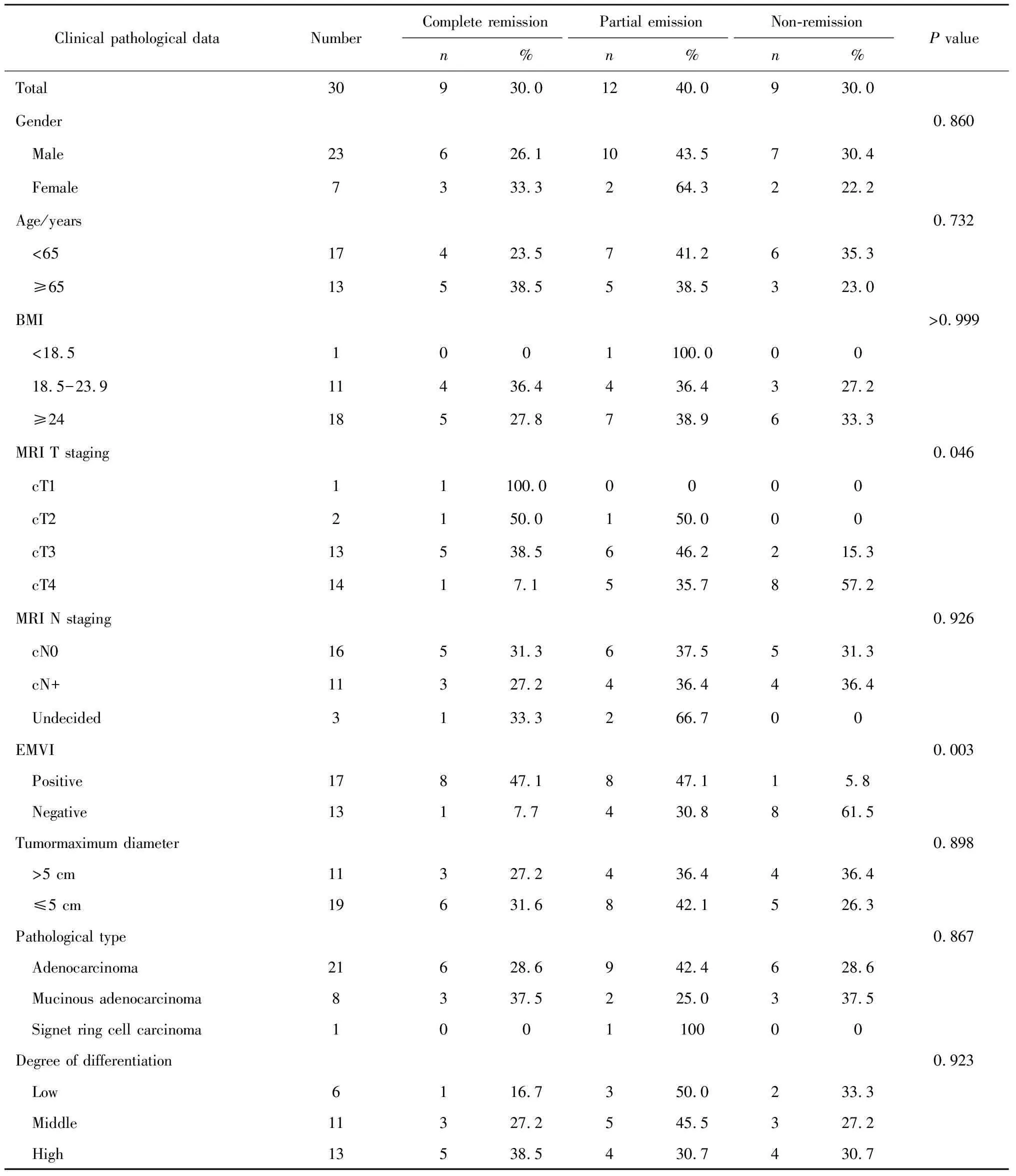
表1 直肠癌术前放化疗患者临床病理资料与TRG分级的关系Table 1 Relationship between clinicopathological data and TRG classification in patients with colorectal cancer
BMI,body mass index; MRI, magnetic resonance imaging; EMVI, extramural vascular invasion.

CR, complete remission group; PR, partial remission group; NR, non-remission group; TPM, transcripts per million.图1 与术前放化疗病理缓解相关的转录本表达情况Figure 1 Transcript expression associated with pathologic remission of preoperative chemoradiotherapy
本研究通过对患者的临床病理资料进行整理分析发现,直肠癌患者放化疗前的临床T分期越早,放化疗后病理缓解越好,同时也发现直肠癌术前MRI显示EMVI阳性的患者放化疗后病理完全缓解率明显优于EMVI阴性的患者。由此可见,我们不仅需要检测与直肠癌放化疗敏感性相关的分子,还要将患者的临床病理特点整合在一起进行分析,这样才能建立更有意义和更为完善的术前分子分型系统。
3.2 建立术前放化疗敏感性分子特征分型系统具有指导意义
恶性肿瘤是一类分子水平上高度异质性的疾病,基于分子差异的个体化治疗是肿瘤治疗的方向。如果术前能通过检测直肠癌患者组织标本的分子特点,即可获知直肠癌患者对放化疗是否敏感及敏感程度,从而个体化地为直肠癌患者选择术前放化疗及可能的放化疗方案,最大程度地让患者从术前放化疗中获益。目前已有学者发现一些基因突变或分子表达异常可能与直肠癌放化疗敏感性相关,例如一项来自30个研究1 830例直肠癌的meta分析发现,p53基因野生型与直肠癌放化疗后病理反应好明显相关[14];D’Angelo等[15]用microRNA基因芯片检测发现,血浆中miR-125b在放化疗抵抗的直肠癌患者中表达明显升高,而miR-194在放化疗敏感的患者中明显升高;Agostini等[16]用含有45 868个探针的基因组芯片检测19例术前放化疗有效和23例无效的直肠癌患者,发现AGRN、HFM1、CSTF3、ZNF160等19个基因在两组患者间的表达存在明显差异;Scott等[17]则通过对13 638个样本10个放疗敏感性基因的表达检测分析建立数学公式,发现基于基因组的放疗剂量(genomic-based radiation dose,CARD)的值越大所需放疗剂量越小、放疗效果越好,认为基于基因检测的CARD值可能个体化指导肿瘤的放疗剂量,匹配个体化的肿瘤放射敏感性。既往这些研究多为基于芯片的基因表达研究或小样本研究,因此尚不能全面反映肿瘤的分子特点(如基因突变拷贝数、融合基因等)。
本研究通过对直肠癌患者的转录组进行高通量测序、生物信息学分析,结合患者放化疗后个体化的病理特点,发现HSPA1A、HSPA1B和EXOSC2高表达的患者术后病理缓解差,而DNMBP、WASH8P、FAM57A和SGSM2高表达的患者术后病理缓解良好,可见通过高通量测序、生物信息学分析可以更全面地探索直肠放化疗敏感性分子的特征。
3.3 直肠癌放化疗敏感性分子分型的建立为直肠癌放化疗提供新靶点
5-FU化疗药联合同步放疗是目前直肠癌术前放化疗的常规标准治疗模式,有效率为70%左右。5-FU主要发挥放疗增敏作用,放射增敏的生物学基础主要是抑制了DNA复制和修复所必需的胸苷酸合成酶,5-FU与放疗协同作用可导致细胞无法修复受损的DNA[18]。也有学者通过增加奥沙利铂、伊立替康或分子靶向药物等尝试改善术前放化疗效果,但存在一定争议[19]。Aschele等[20]将700例患者随机分入术前放疗同时联合5-FU及奥沙利铂组或仅联合5-FU组,发现两组患者肿瘤的病理完全缓解率均为16%,差异无统计学意义(P=0.904)。
本研究对所获取的P≤0.05的217条转录本进行信号通路富集初步分析后发现多条与抗原呈递相关的细胞信号转导通路,包括抗原处理与呈递、对未折叠蛋白的响应、凋亡相关的核改变以及核酸相关的代谢过程,这些富集的细胞信号通路提示免疫细胞浸润、细胞凋亡、蛋白质未折叠或不正确折叠等过程可能都与术前放化疗和术后病理缓解存在联系。本研究后续将基于研究获得的直肠癌放化疗敏感性分子特征,尝试阻断或增强与直肠癌放化疗敏感性相关的分子通路,从而进一步探索能增加直肠癌放化疗敏感性的候选新靶点。
