牛蒡皮固体培养灵芝多糖对慢性炎性痛小鼠的影响
2019-06-17董玉玮蒋如梦苗敬芝李文高甜慧胡传银
董玉玮,蒋如梦,苗敬芝,*,李文,高甜慧,胡传银
(1.徐州工程学院食品(生物)工程学院,江苏 徐州 221018;2.徐州医科大学麻醉学重点实验室,江苏 徐州 221004;3.徐州天马敬安食品有限公司,江苏 徐州 221636)
牛蒡(Arctium lappa L.)是肉质根类蔬菜,牛蒡根含有菊糖、多糖、皂苷、黄酮苷、膳食纤维、多酚类(如咖啡酸、绿原酸、异绿原酸等)等成分[1],已在新型、功能型深加工产品、制药、保健品等方面形成了较多研究成果[2]。在大力研究牛蒡根利用的同时,每年大量的牛蒡皮仍被作为废弃物处理,利用率很低,造成极大的浪费。导致这个现象的主要原因是牛蒡皮中含有较多木质素和纤维素,难以再利用。如能变废为宝,除可增加农民收入,也可减少废弃物的环境污染。
微生物尤其是一些药食真菌,比如营养、保健价值较高的灵芝、茯苓、金针菇等,具有分解、利用木质素和纤维素的能力[3],同时牛蒡皮中含有的蛋白质、维生素、矿物质等营养成分也可作为药食真菌生长的原料。如果以牛蒡皮作为营养基质固体培养药食真菌,可提高牛蒡、药食真菌的利用价值。药食真菌中的灵芝[Ganoderma lucidum(Leyss.ex.Fr.)Karst]是担子菌纲灵芝属的大型真菌,是目前研究最为深入的药用真菌之一。灵芝多糖是灵芝中的重要活性成分,具有抗疲劳、延缓衰老、改善睡眠等功效[4],已被广泛应用于动脉硬化[5]、神经衰弱[6]、肿瘤[7]等疾病的辅助治疗。
慢性炎性痛作为一种病理性疼痛,是由于组织损伤、炎症或者神经系统损伤所导致的疼痛,持续时间在1 个月以上,通常伴有不同程度的神经系统病理改变。因此通过治疗神经系统的病变可在一定程度上有效缓解慢性炎性痛的疼痛[8]。完全弗氏佐剂(complete freund adjuvant,CFA)是一种强大而有效的致炎剂,注射后可引起局部明显且持续时间较长的炎症痛。在进行疼痛机理和相关治疗手段的研究中,常被用于制作疼痛模型[9]。已有报道表明,多糖具有镇静、抗炎镇痛、保护和修复神经元的作用[10],提示可能对慢性炎性痛也具有一定治疗作用。
本课题以牛蒡皮为基质,固体培养灵芝并优化工艺条件,经提取、纯化后获得牛蒡-灵芝菌质多糖。通过构建慢性炎性痛小鼠模型,腹腔注射牛蒡-灵芝菌质多糖,探讨菌质多糖对慢性炎性痛小鼠的影响,为进一步研究牛蒡-灵芝菌质药性成分,更好地全面利用牛蒡-灵芝菌质提供了技术支撑。
1 材料与方法
1.1 材料与试剂
菌种灵芝购自徐州市铜山县食用菌科技开发服务中心,经江苏省高校食品资源开发与质量安全重点建设实验室鉴定为多孔菌科灵芝Ganoderma lucidum(Leyss.ex Fr.)Karst。经诱变选育后,具有高产多糖的性能,保存于江苏省高校食品资源开发与质量安全重点建设实验室;牛蒡:徐州天马敬安食品有限公司。
试验动物昆明白小鼠,购自山东鲁康动物饲料经销中心。
完全弗氏佐剂:sigma 公司;葡萄糖、乙醇、硫酸、苯酚、琼脂:国药集团化学试剂有限公司。以上试剂均为分析纯。
马铃薯葡萄糖琼脂斜面培养基:按照GB 4789.15-2010《食品卫生微生物学检验霉菌和酵母计数》配制,用于菌种的活化及保存。培养基配方:马铃薯200 g、葡萄糖 20 g、琼脂 20 g、KH2PO43 g、MgSO41.5 g、维生素B110 mg,水 1 000 mL。
固体培养基:新鲜的牛蒡洗净取皮,按比例加水配制。
1.2 仪器与设备
HGB11.690-S-II 电热恒温培养箱:广东跃进医疗器材厂;XBHY-205 数显式电热恒温水浴锅:上海香梅器材有限公司;FA22140 电子天平:上海精密科学仪器有限公司;HJ-3 数显恒温磁力搅拌仪:国华电器有限公司;DL-5 低速大容量离心机:上海安亭仪器厂;390G1 热辐射刺激仪:上海玉研科技仪器有限公司。
1.3 方法
动物学试验在徐州医科大学麻醉重点实验室完成,其余试验在徐州工程学院食品(生物)工程学院江苏省食品资源开发与质量安全重点实验室完成。
1.3.1 灵芝菌种的活化
菌种活化:取灵芝菌株接种于马铃薯葡萄糖琼脂斜面培养基上活化1 次~2 次。
1.3.2 单因素试验
采用牛蒡皮固体培养基培养灵芝,考查液固比、装瓶量、切片大小对固体培养灵芝多糖含量的影响,每组试验重复3 次取平均值。
1.3.2.1 液固比
牛蒡皮的切片大小(按长cm×宽cm 换算为面积)控制在 0.5 cm2。以 0.15 g/mL 装瓶量(牛蒡皮 g/培养瓶 mL)将牛蒡装入100 mL 培养瓶中,按照液固比(蒸馏水mL/牛蒡皮 g)为 0 ∶1、0.33 ∶1、0.67 ∶1、1 ∶1、1.33 ∶1(mL/g)配制固体培养基,无菌接种,封口膜封口,黑暗条件下28 ℃固体培养14 d~21 d 至菌丝长满培养基,将菌质于50 ℃烘干后粉碎,过60 目筛。
1.3.2.2 装瓶量
牛蒡皮的切片大小控制在0.5 cm2,长、宽误差均为±0.2 cm。按照 0.1、0.15、0.2、0.25、0.3 g/mL 的装瓶量(牛蒡皮g/培养瓶mL),在100 mL 培养瓶中装入牛蒡,以液固比0.33 ∶1(mL/g)配制固体培养基,无菌接种,封口膜封口,黑暗条件下28 ℃固体培养14 d~21 d 至菌丝长满培养基,将菌质于50 ℃烘干后粉碎,过60 目筛。
1.3.2.3 切片大小
牛蒡皮切片分别控制在 0.25、0.5、0.75、1、1.25 cm2。均以0.2 g/mL 装瓶量将牛蒡皮装入100 mL 培养瓶中,以液固比 0.33 ∶1(mL/g)配制固体培养基,无菌接种,封口膜封口,黑暗条件下28 ℃固体培养14 d~21 d至菌丝长满培养基,将菌质于50 ℃烘干后粉碎,过60目筛。
1.3.3 牛蒡皮固体培养灵芝工艺优化
根据Box-Behnken 试验设计原理,采用Design-Expert 8.06 试验设计软件对牛蒡固体培养灵芝工艺进行优化,设计三因素三水平的试验方法,试验因素和水平见表1。
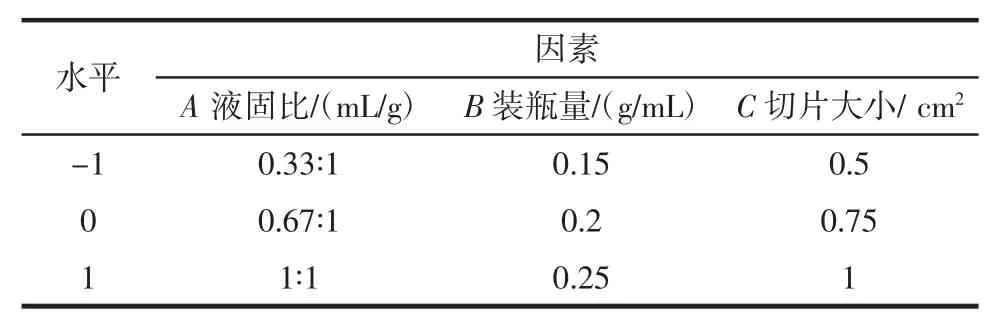
表1 因素水平表Table 1 Factors and levels of the experiment
1.3.4 多糖的提取与检测
提取多糖使用水提醇沉法:将灵芝菌丝粉碎,称5 g 于烧杯中,加入 50 mL 水混匀,60 ℃水浴 1.5 h,4 000 r/min 离心5 min,过滤,取沉淀重复提取3 次,合并提取液,置于60 ℃烘箱中浓缩至原体积1/5,浓缩液加入5 倍体积95%乙醇,溶解过夜。4 000 r/min 离心10 min,过滤取沉淀为粗多糖,60 ℃烘箱烘干,加入10 mL~50 mL 水充分溶解。测定多糖含量采用苯酚-硫酸法,根据标准曲线计算粗多糖含量(mg/g 菌丝)。
1.3.5 粗多糖的纯化
1.3.5.1 脱蛋白、透析
采用Sevag 法对粗多糖进行脱蛋白处理。按氯仿∶正丁醇体积比4 ∶1 配制Sevag 试剂,粗多糖溶液置于分液漏斗中,加入1/5 溶液体积的Sevag 试剂,振荡20 min,4 000 r/min 离心 10 min 得上清液,继续重复上次操作,直至氯仿层与正丁醇层之间没有乳白色变性蛋白质析出为止,合并上清液,倒入截留分子量为6 000 Da~8 000 Da 的半透膜袋中,蒸馏水透析48 h,期间每2 h 更换1 次水。
1.3.5.2 脱色
取透析后的粗多糖溶液配制成5 mg/mL 的溶液50 mL,加入 30%H2O21 mL,50 ℃保温脱色 3 h,直至色值不再降低,浓缩后冻干得菌质多糖。
1.3.6 多糖对慢性炎性痛小鼠的影响
1.3.6.1 小鼠喂养与体质量测定
小鼠由徐州医科大学麻醉学重点实验室动物房专人饲养并提供标准啮齿类动物饲料,饲料配方为:20%蛋白质、60%碳水化合物、9%脂肪、11%纤维素,小鼠自由摄食与饮水。动物饲养条件:室温(22±2)℃,相对湿度40%~60%,自然昼夜交替,适应性饲养7 d后,选取体质量(22±2)g 雄性昆明小鼠 135 只进行试验,随机分成 9 组,每组 15 只。在注射 CFA 前 2 d 测定小鼠体质量作为初始值,注射后第1、3、5 天分别测定1 次。
1.3.6.2 CFA 小鼠模型制作[11]
用微量进样器吸取50 μL CFA,围绕小鼠左后足足跖关节部,皮下注射CFA,注射完成后旋转针头,皮下停留3 s~5 s 后拔出,造模完成。
1.3.6.3 小鼠腹腔注射生理盐水和菌质多糖[12]
9 组小鼠中1 组足底注射50 μL 生理盐水作为对照,另外 8 组分别腹腔注射浓度为 5、10、30、50、70、90、110、130 mg/mL 的菌质多糖溶液,注射量为小鼠体重的1%。共注射3 次,分别为小鼠造模后当天(第1天)注射第1 次,以后每2 d 注射1 次。
1.3.6.4 热缩足潜伏期(thermal withdrawal latency,TWL)的测定
根据Hargreaves 等报道的方法[13],将透明有机玻璃箱中用玻璃板分隔成若干独立空间,底层玻璃板厚3 cm,将每只小鼠放入玻璃板独立空间,稳定2 h 后,用热辐射刺激仪照射小鼠左后足足心,照射开始至小鼠首次抬腿躲避时间即为热缩足潜伏期。热刺激强度调节至基础值为10 s~12 s,自动切断时间为20 s,以免造成热辐射损伤。共测定4 d,分别为造模前2 d、造模后第2 天、第4 天和第6 天,测定当天每只小鼠测定3 次,每次间隔5 min,取3 次平均值作为小鼠TWL值。
1.3.7 数据分析
2 结果与分析
2.1 单因素试验
2.1.1 液固比
不同液固比条件下,牛蒡皮培养灵芝菌质后多糖含量见图1。
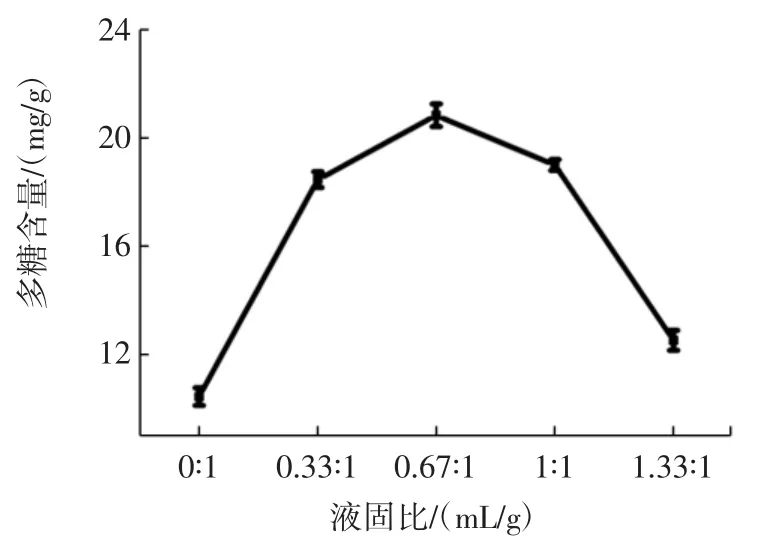
图1 液固比对牛蒡皮培养灵芝工艺的影响Fig.1 Effect of liquid-solid ratio on the process of Ganoderma lucidum cultured by Arctium lappa L.peel
由图1 可知,菌质多糖含量在液固比 0 ∶1(mL/g)~1.33 ∶1(mL/g)范围内先增加后减少,在液固比为 0.67 ∶1(mL/g)时多糖含量达到最高,为20.82 mg/g。
2.1.2 装瓶量
不同装瓶量条件下,牛蒡皮培养灵芝菌质后多糖含量见图2。
由图2 可知,菌质多糖含量在装瓶量0.1 g/mL~0.3 g/mL 范围内先增加后减少,在装瓶量为0.20 g/mL时多糖含量达到最高,为21.26 mg/g。
2.1.3 切片大小
不同切片大小条件下,牛蒡皮培养灵芝菌质后多糖含量见图3。

图2 装瓶量对牛蒡皮培养灵芝工艺的影响Fig.2 Effect of bottling amount on the process of Ganoderma lucidum cultured by Arctium lappa L.peel

图3 切片大小对牛蒡皮培养灵芝工艺的影响Fig.3 Effects of slice size on the process of Ganoderma lucidum cultured by Arctium lappa L.peel
由图3 可知,菌质多糖含量在切片大小0.75 cm2时,多糖含量达到最高,为20.43 mg/g。
2.2 响应面试验设计
根据响应面试验制定详细的分析方案,多糖含量预测值与实际值见表2。

表2 响应面分析方案与结果Table 2 Analysis and results of response surface

续表2 响应面分析方案与结果Continue table 2 Analysis and results of response surface
2.3 回归模型的建立和检验
对液固比(A)、装瓶量(B)和切片大小(C)3 个单因素进行回归拟合,得出多糖含量(Y)回归方程:
Y=21.62-0.33A-0.38B-0.34C+0.090AB-0.63AC-0.11BC-1.88A2-1.5B2-0.96C2
分析统计结果如表3、表4所示。

表3 回归模型方差分析Table 3 Regression model analysis of variance

表4 预测模型的可靠性分析Table 4 Reliability analysis of prediction model
由表3 可知,此模型的拟合程度较好,决定系数R2为 0.988 6,P 值<0.01,说明该方程与实际情况相符,具有统计学意义。失拟项P>0.05,不显著。液固比、装瓶量、切片大小的P 值都小于0.01,对多糖含量影响都有统计学意义。液固比和装瓶量、装瓶量和切片大小两两交互作用对多糖含量的影响没有统计学意义,液固比和切片大小两两交互作用对多糖含量的影响有统计学意义(P<0.01)。
2.4 两因素间的交互效应分析
液固比(A)、装瓶量(B)、切片大小(C)3 个因素两两交互作用对灵芝多糖含量的影响等高线图和响应面图,见图4。
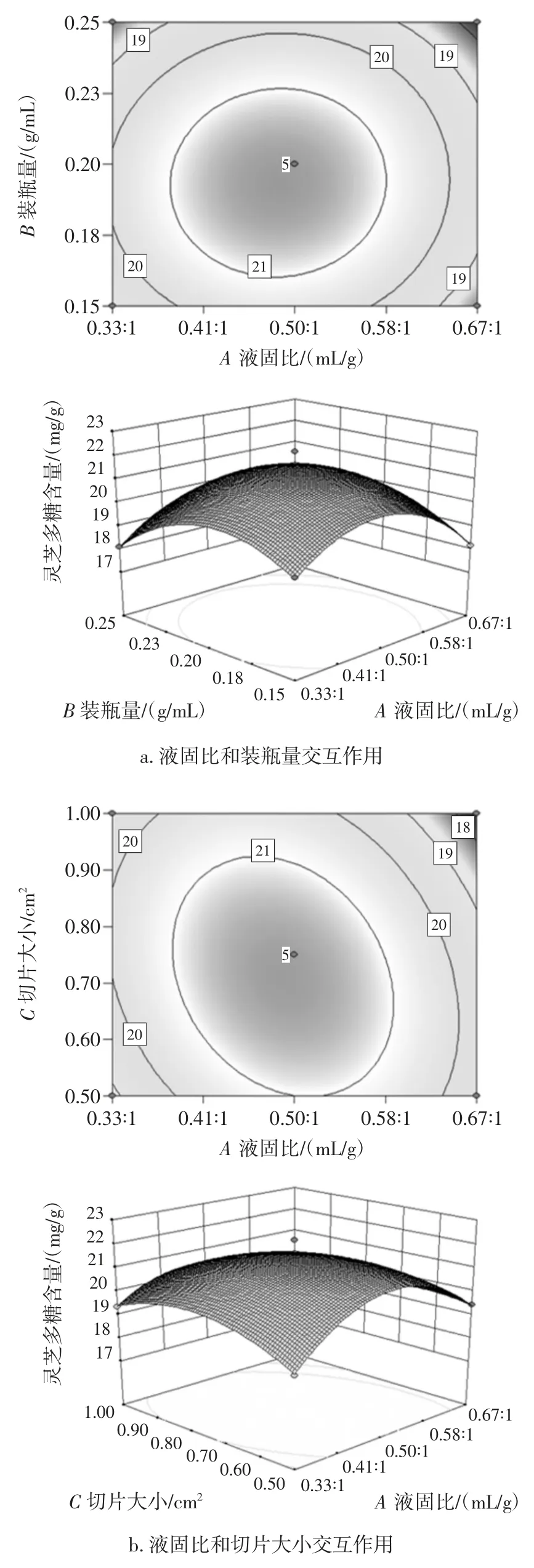

图4 响应面分析图和等高线图Fig.4 Response surface analysis and contour map
由图4 可知,交互影响作用大小排序为:液固比与切片大小>装瓶量与切片大小>液固比与装瓶量。3 个因素对多糖含量的影响大小依次为:装瓶量>切片大小>液固比。
2.5 最佳条件优化及验证结果
回归模型确定的最佳培养工艺为液固比0.49∶1(mL/g),装瓶量0.19 g/mL,切片大小为0.71 cm2,预测得到的多糖含量最高为21.68 mg/g。对此优化条件进行验证,考虑实际操作,选择液固比 0.5 ∶1(mL/g),装瓶量 0.2 g/mL,切片大小为0.7 cm2条件下进行3 次验证试验,提取的多糖平均含量值为21.87 mg/g,相对误差0.898%,和预期结果基本相符,回归模型的预测性能较好,可用于优化牛蒡固体培养灵芝工艺。
2.6 CFA模型建立结果
注射CFA 前后小鼠左后足形态对比见图5。

图5 注射弗氏佐剂前后小鼠左后足对比Fig.5 Contrast of left hind foot in mice before and after injection of Freund's adjuvant
从图5 可以看出,在注射弗氏佐剂前,小鼠左后足无肿胀现象,注射CFA 后,小鼠左后足出现明显肿胀,说明CFA 模型建立成功。
2.7 菌质多糖对小鼠体质量的影响
分别在造模前2 d、造模后第1、3、5 天测定小鼠体质量,结果见表5。
对同一天同一组数据做方差齐性检验,结果表明:在造模前后,生理盐水组和多糖组小鼠体质量组内F 值均大于0.05,因此不显著,说明每组数据系统误差较小,可用于后续试验。

表5 小鼠体质量的测定结果Table 5 Determination of body mass in mice
从表5 可以看出,经Duncan 检验,①同一天内,在造模前和造模第1 天,生理盐水组和多糖组之间,小鼠体质量差异没有统计学意义;②造模第3 天,注射130 mg/mL 多糖组与其它组之间差异有统计学意义(P<0.05);③造模第 5 天,注射 90、110、130 mg/mL 多糖组与其它组之间差异有统计学意义(P<0.05),说明90 mg/mL~130 mg/mL 多糖浓度有促进小鼠体质量增加的作用。
2.8 菌质多糖对小鼠慢性炎性痛的影响
分别在造模前2 d、造模后第1、3、5 天测定小鼠TWL,结果见表 6。

表6 小鼠热缩足潜伏期的测定结果Table 6 Determination of thermal withdrawal latency in mice
对同一天同一组数据做方差齐性检验,结果表明:在造模前后,生理盐水组和多糖组小鼠TWL 组内F 值均大于0.05,因此不显著,说明每组数据系统误差较小,可用于后续试验。
从表6 可以看出,经Duncan 检验,①生理盐水组小鼠第2、4 天TWL 与造模前和第6 天TWL 之间差异具有统计学意义(P<0.05),第 6 天 TWL 与前 3 次 TWL之间差异有统计学意义,说明CFA 对生理盐水组小鼠足部损伤的影响有统计学意义(P<0.05),在造模后第6 天 TWL 尚未恢复到造模前的正常水平;②5、10、30、50、70 mg/mL 多糖组各组每次TWL 之间差异没有统计学意义,说明小鼠在造模第2 天TWL 就已恢复到正常水平,因此4 组浓度多糖有助于减轻小鼠足部炎性痛反应;③90、110、130 mg/mL 多糖组在造模后第 2 天TWL 与造模前相比有差异具有统计学意义,说明第2 天小鼠足部炎性痛尚未恢复;90、110 mg/mL 多糖组在造模后第4、6 天TWL 与造模前相比差异无统计学意义,说明小鼠足部炎性痛已恢复正常;130 mg/mL 多糖组在造模后第4、6 天TWL 与造模前相比差异具有统计学意义,说明小鼠足部炎性痛尚未恢复到造模前的正常水平。综上所述,低、中剂量多糖浓度(5、10、30、50、70 mg/mL)对减轻小鼠足部炎性痛反应的影响有统计学意义,其影响效果优于注射90、110 mg/mL 多糖,当注射130 mg/mL 高浓度多糖时,对减轻小鼠足部炎性痛反应影响没有统计学意义。
3 结论与讨论
传统牛蒡加工过程中,牛蒡皮都作为废弃物,无法再利用。由于牛蒡皮木质素、纤维素含量较高,并含有多糖、维生素、氨基酸等成分,为灵芝等药食真菌固体培养提供了适宜的营养基质。采用牛蒡皮固体培养灵芝,菌丝生长速度、菌质多糖含量与传统固体培养无明显差异,工艺简单,可操作性强,不需额外添加化学试剂,既节省了原料和成本,又合理利用了作为废弃物的牛蒡皮。目前本实验室已经利用牛蒡皮,成功固体培养了茶薪菇、金针菇、杏鲍菇,液体培养了毛木耳、茶新菇、平菇等多个品种食用菌,显示出牛蒡皮在固体、液体培养药食真菌中具有普遍的规律性和适用性,相关工艺技术已在药食真菌培养、牛蒡综合利用、植物-药食真菌复合型饮料制备方面开展了系列应用,符合现代绿色、高效农业的理念,具有很好的推广前景。
李晓川等经研究发现灵芝多糖在一定剂量下能延长小鼠的热缩足潜伏期[14];谷冲春等[15]、田香等[16]认为灵芝多糖是通过清除小鼠脑内自由基、抑制蛋白表达、降低神经细胞内Ca2+浓度来达到对小鼠神经元的保护作用;贾薇等则对灵芝多糖改善小鼠睡眠效果作了分析[17]。本研究结果表明,在一定剂量浓度范围内(5 mg/mL~70 mg/mL),经腹腔注射菌质多糖后,对小鼠体重影响无统计学意义,并且对减轻小鼠足部炎性痛有较好的恢复作用,可能原因是多糖具有镇痛、消炎、修复神经、改善睡眠质量的作用,有助于修复已有炎症。李建军等在研究灵芝多糖抗肿瘤作用时,多糖注射浓度为 100 mg/kg 体重~400 mg/kg 体重[18];秦丽红等在研究灵芝多糖对肺癌细胞的作用时,多糖注射浓度为2 000 mg/kg[19];程俊文等进行灵芝多糖提取物对小鼠免疫功能的研究时注射最高浓度为700 mg/kg,相当于人推荐剂量的近30 倍[20]。本研究所注射的菌质多糖高浓度分别为90、110、130 mg/mL,按小鼠体重换算分别为900、1 100、1 300 mg/kg,约相当于人推荐剂量的30 倍~50 倍,高于一般注射剂量,也高于程俊文等的注射剂量。结果表明,除130 mg/mL 以外,其余高浓度剂量菌质多糖对小鼠足部炎性痛也有减轻作用,说明高浓度剂量菌质多糖注射安全,但是效果低于低、中剂量组,因此5 mg/mL~70 mg/mL 菌质多糖是减轻小鼠慢性炎性痛的最佳剂量浓度。
通过单因素试验和响应面软件优化,确定牛蒡皮固体培养灵芝最佳工艺为:液固比 0.5 ∶1(mL/g),装瓶量0.2 g/mL,切片大小0.7 cm2,此时多糖含量为21.87 mg/g。腹腔注射 5、10、30、50、70 mg/mL 多糖对小鼠体重影响无统计学意义;注射130 mg/mL 多糖第3天,注射 90、110、130 mg/mL 多糖第 5 天,小鼠体质量与其它组之间差异具有统计学意义(P<0.05),说明注射90 mg/mL~130 mg/mL 多糖浓度有促进小鼠体质量增加的作用。腹腔注射 5、10、30、50、70 mg/mL 多糖对减轻小鼠足部炎性痛反应的影响有统计学意义(P<0.05),其影响效果优于注射 90、110 mg/mL 多糖,注射130 mg/mL 高浓度多糖时,对减轻小鼠足部炎性痛反应的影响没有统计学意义。
