不同芽孢杆菌属重组生物药物的制备及前景展望
2019-06-16朱瑜编译赵晨审校
朱瑜 编译,赵晨 审校
(成都大学四川抗菌素工业研究所,成都 610052)
1 前言
现在,约20%上市药是生物制药,这是因为生物制药生产效率比传统小分子药物高得多,预计2020年,全球生物医药市场预计将达到3060亿美元。北美是生物制药的最大市场,2012年销售额为636亿美元,其中单克隆抗体占大多数(246亿美元),其次是激素(161亿美元)和生长因子(81亿美元)。20世纪70年代重组DNA技术的发展,利用相对廉价的微生物宿主系统,实现了生物药物生产的可控性和可扩展性。目前,用于生物制药的宿主有哺乳动物细胞(39%),杂交瘤细胞(11.2%),酵母菌(18.5%)和革兰阴性菌,如大肠埃希菌(29.8%)等。
此外,工业化生产和分泌药物相关蛋白的最佳候选菌株是芽孢杆菌菌株。芽孢杆菌呈棒状,为好氧或兼性厌氧菌,属于革兰阳性菌,已经被开发和构建为工业生产菌株,主要用于天然药物的生产:一些蛋白酶如碱性蛋白酶(枯草芽孢杆菌)、α-淀粉酶(地衣芽孢杆菌)、β-葡聚糖酶(枯草芽孢杆菌)、抗生素、杆菌肽(地衣芽孢杆菌),内毒素类杀虫剂(苏云金芽孢杆菌),维生素B2(枯草芽孢杆菌)、维生素B12(巨大芽孢杆菌),多聚γ-谷氨酸补剂或泛醌生物聚合物纳米载体(地衣芽孢杆菌)。芽孢杆菌在重组生产药物相关蛋白方面的巨大优势,使之在制药行业中应用广泛。
与真核表达系统相比,芽孢杆菌易培养,生长速度快,培养时间短;大多数属非致病性菌株,不含外毒素、内毒素,具有良好的医药应用价值。在生物制药领域内甚至普遍认为枯草芽孢杆菌和地衣芽孢杆菌是安全菌株。此外,革兰阳性菌芽孢杆菌能直接将重组蛋白分泌到细胞外培养基中,下游纯化成本更低。相比之下,革兰阴性菌如研究最多的大肠埃希菌,常常在细胞内积累不溶性蛋白形成包涵体导致细胞毒性,错误折叠或二硫键缺失的蛋白质,都将导致下游加工成本的增高(图1)。
然而,由芽孢杆菌产生的真核外源蛋白水平比相应原核蛋白的水平要低得多,例如分泌的α-淀粉酶浓度为3g/L。产量低的限制因素可能有:与细胞膜、细胞壁结合相关的蛋白酶由于折叠效率低而被降解;没有合适的分子伴侣导致前体蛋白质折叠成无效构象;分泌过量并堆积引起产物抑制导致终产量下降,其过量水平取决于目的蛋白和其他蛋白的分泌水平,如合成与分泌之间复杂的反馈机制,其中主要因素为翻译水平的调控。为了促进重组蛋白高效生产分泌,必须认识、消除这些限制因素。为此,对基因、mRNA转录、蛋白质、代谢物、各通量和调控水平进行系统分析至关重要。如今,高通量技术(又称通量组学方法)可设计构建不同的芽孢杆菌菌株,转化为高水平表达菌株,以此作为大规模生产药物相关蛋白产品的重要载体。
本文调查了关于芽孢杆菌生产的药用重组蛋白的研究现状,例如高价值药物如抗体片段和胰岛素前体等。为了进一步改进芽孢杆菌的重组生产工艺,需要对其进行整体观察,可利用基因组学、转录组学、蛋白质组学、代谢组学或通量组学技术来研究问题。因此,本综述的第二部分揭示了系统生物学和通量组学技术的最新发展,这些技术是系统地提高重组蛋白产量的有效工具,能将其应用于芽孢杆菌菌株生产重组药物。
2 不同芽孢杆菌菌株重组生产和分泌的药物相关蛋白
表1~7总结了由芽孢杆菌产生的相关重组蛋白如抗体片段(表1)、人表皮生长因子与人生长激素(表2)、人干扰素和白细胞介素(表3)、胰岛素前体(表4)、青霉素G酰化酶(表5)、葡萄球菌激酶和链激酶(表6),及链霉亲和素(表7)。
2.1 抗体片段
抗体是医学研究中的重要工具,可与特异性抗原结合被用于分析、蛋白质组研究、疾病的诊断和治疗。与抗原具有高亲和力的最小常规抗体片段包括抗原结合片段(Fab)、单链抗原结合片段(ScFab)和单链抗体片段(ScFv)。它们是分别由抗体重链和轻链组成的抗原结合区域和可变结构域组成的异二聚体,通过连接肽连接稳定其分子结构。通过重组短芽孢杆菌,可分泌约100mg/L抗人尿激酶型纤溶酶原激活剂Fab,还有研究表明,重组枯草芽孢杆菌也可以产生抗溶菌酶和荧光素的ScFv融合蛋白。通过摇瓶培养重组巨大芽孢杆菌 MS941,能产生390µg/L抗CRP ScFv、410µg/L抗溶菌酶D1.3 ScFv、3.5µg/L结构更为复杂的D1.3 ScFab。通过重组木糖代谢缺陷的巨大芽孢杆菌YYBm1菌株,D1.3 ScFv在摇瓶中的分泌量可提高至700µg/L,在3L反应器中可达1.5~4mg/L;通过振荡分批补料培养,D1.3 ScFv的分泌量可达11.9mg/L;应用优化的木糖诱导启动子构建质粒时,在摇瓶或反应器中其分泌量可以达到7~11mg/L、在微孔板中甚至达到14±1mg/L。该质粒原本设计用于在巨大芽孢杆菌中D1.3ScFv的重组生产,后研究表明在地衣芽孢杆菌和枯草芽孢杆菌中也能有效应用。在微孔板、摇瓶和生物反应器中培养重组地衣芽孢杆菌MW3,分泌量可达12~17mg/L。重组枯草芽孢杆菌菌株大部分为菌株168的突变体,其蛋白酶基因缺失且胞外蛋白酶活性较低,与野生型相比,产率大大提高。据报道3种蛋白酶缺陷型重组枯草芽孢杆菌WB30中抗地高辛的单链抗体分泌量为3.5mg/L,6种蛋白酶缺陷的重组枯草芽孢杆菌WB 600中可达5mg/L。加入合适的分子伴侣,ScFv 产量可以达到12mg/L。在枯草芽孢杆菌WB800HM [pEPP]菌株中,如果加入分子伴侣,并失活细胞壁相关蛋白酶WprA基因,Scfv产量可达15mg/L。比较重组枯草芽孢杆菌168、WB30和WB600,无论是在微孔板、摇瓶或生物反应器中培养,都可发现蛋白酶分泌较少时将会增加ScFv的稳定性。由8种蛋白酶基因缺陷型WB800N分泌量可达132±9mg/L,这是迄今为止已知的革兰阳性细菌生产重组抗体片段的最高水平(表1)。
2.2 人生长因子
人表皮生长因子(hEGF)是一种6kDa的多肽,具有3个二硫键,能促进表皮和上皮组织的增殖。糖尿病患者通常生长因子浓度偏低,患者可通过注射hEGF治疗糖尿病足溃疡,促进伤口愈合。在重组芽孢杆菌HPD31中,hEGF的产量一般可达到0.24~1.8g/L。在20L搅拌生物反应器分批培养,hEGF产量能达到1.5g/L。在2种蛋白酶缺陷的重组枯草杆菌DB104中,hEGF分泌量可达15mg/L(表2)。
人生长激素(hGH)是一种阴离子、非糖基化的四螺旋束蛋白,分子量为22kDa。目前,产自重组大肠埃希菌的hGH可用作治疗侏儒症、损伤、骨折、溃疡出血和烧伤。芽孢杆菌菌株作为hGH表达宿主的应用:在复合培养基中培养时,重组短芽孢杆菌31-OK分泌量可达240mg/L;缺失中性蛋白酶基因的重组枯草杆菌N325在摇瓶培养可分泌48mg/L的hGH;用重组枯草芽孢杆菌BGSC在分批培养中hGH的产量能达到70±3mg/L。在1.1~2.4L规模的生物反应器中,采用连续指数补料方式,按照特定生长速率,hGH产量甚至能达到127和497mg/L。
2.3 人干扰素和白细胞介素
人干扰素是天然防御的信号蛋白,与特定的受体结合,可激活抗病毒、免疫调节和抗增殖的信号转导通路,用于抗病毒、细菌、有丝分裂原和肿瘤细胞。干扰素可用于治疗多发性硬化症,乙型肝炎,丙型肝炎和癌症。已有研究阐述了在复合培养基中培养的不同重组枯草杆菌菌株分泌α、β和γ-干扰素的情况:在摇瓶中,使用具有低外源蛋白酶活性的菌株IH6140能分泌1~2U/mL的α-干扰素;SAN 780菌株和Dpr8的α-干扰素的分泌量分别为4.4和14.8± 0.4mg/L;用蛋白酶基因缺陷株GB 500和DB 104分泌15mg/L的α-干扰素;在1.1~1.3L的生物反应器中,枯草芽孢杆菌P.amy α-2,6可在分批、连续培养方法分泌7×104-4×105U/mL;利用重组枯草杆菌N325,能分泌8×10-4U/mL的β -干扰素;还有研究表明,用Drp 3和D8PA菌株,能分泌0.8~1U/mL的β-干扰素、3.9~10.1U/mL的β-干扰素前体。在6种蛋白酶缺陷菌株WB600中,培养上清液中能分泌共表达20.3±0.8mg/L,200±39µg/L的γ-干扰素(表3)。
人类白细胞介素是一大类免疫调节信号蛋白,与细胞表面的高亲和力受体结合,激活细胞增殖等复杂的免疫反应如免疫细胞的成熟、迁移和黏附等。大肠埃希菌中产生的重组白细胞介素通常与其他药物联合使用进行免疫治疗,用于治疗癌症或感染。利用复合培养基中培养的重组芽孢杆菌产生白细胞介素:短芽孢杆菌 HPD 31和31-OK,可分泌高达120mg/L白介素-2(15.4kDa)、200mg/L白细胞介素-6(26KDa)。应用8种蛋白酶缺陷枯草芽孢杆菌菌株WB 800,能表达约100mg/L白介素-3(15KDa)(表3)。
2.4 胰岛素前体
芽孢杆菌属的菌株也用于生产前胰岛素原和胰岛素原(胰岛素前体)。前胰岛素原是分子量为12kDa,具有3个二硫键的单链非糖基化多肽,由C肽与N端信号肽连接的A链和B链组成。去除9kDa的信号肽,可得到胰岛素原。可以通过酶切去除C肽,胰岛素原进而转化为胰岛素,用于治疗糖尿病。在20L生物反应器中,重组短杆菌HPD 31通过分批培养方法,能生产约50mg/L胰岛素原(B链(1-29)-A链与EGF融合)。使用重组枯草芽孢杆菌AJ 73,LB培养基中胰岛素原的分泌量达165U/mL;在重组枯草杆菌168的孢子表面也能表达胰岛素原;重组枯草杆菌菌株BS273,用固定化细胞在摇瓶和连续生物反应器中培养也可得到12.5mg/L大鼠胰岛素原;即使是在1.1L最小培养基间歇培养重组枯草芽孢杆菌BB81.3,可分泌870mg/L的胰岛素原(表4)。

表1 乔南芽孢杆菌、短芽孢杆菌、地衣芽孢杆菌,巨大芽孢杆菌和枯草芽孢杆菌生产的抗体片段(不完全)

表2 短芽孢杆菌和枯草芽孢杆菌生产的人类生长因子(不完全)
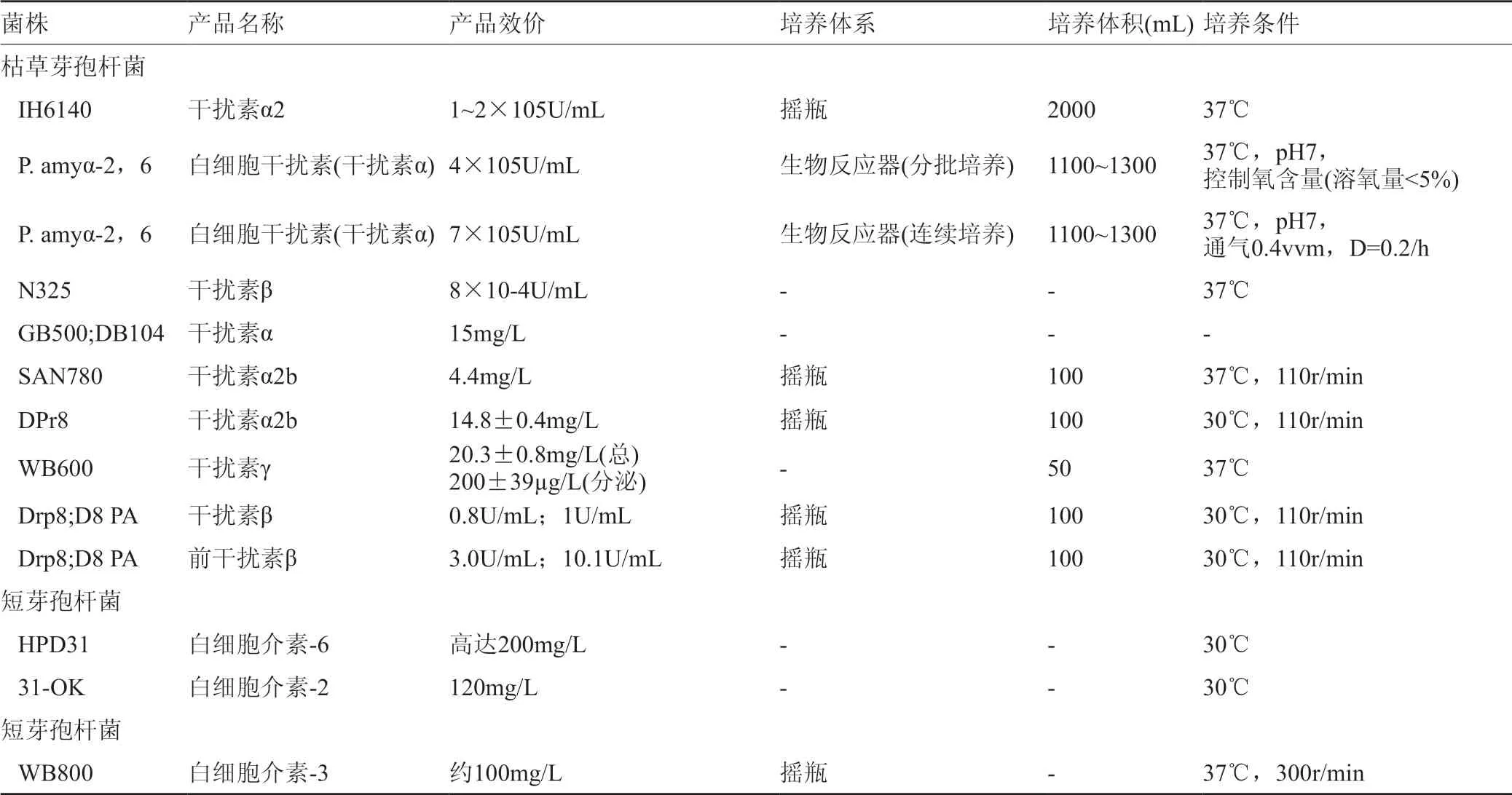
表3 短芽孢杆菌和枯草芽孢杆菌生产的人干扰素和白细胞介素-2(不完全)
2.5 青霉素G酰化酶
青霉素G酰化酶(Pac,EC 3.5.1.11)可催化青霉素G和头孢菌素G裂解为生产半合成β-内酰胺类抗生素的重要中间体。Pac由一个小的α亚基(27KDa)和一个大的β亚基(59KDa)组成,由含有信号肽和间隔肽的单链多肽的前体自身催化生成。在芽孢杆菌属中,巨大芽孢杆菌、枯草芽孢杆菌可用于各种表达系统以及主要是复合培养基重组生产Pac。突变体中,巨大芽孢杆菌青霉素G酰化酶(BmPac)的生产可高达20.4U/mL、枯草芽孢杆菌MI 113中达5.8U/mL;主要胞外蛋白酶、木糖代谢缺陷型菌株巨大芽孢杆菌YYBm1,使用木糖诱导型质粒系统,BmPac产量最多可分别达到47U/mL(微孔板)、1.5U/mL(摇瓶)、1.25U/mL(实验室搅拌生物反应器)。枯草芽孢杆菌噬菌体Phi105在温度敏感表达系统中,摇瓶中分泌2.55U/mL,在连续生物反应器中2.7U/mL,在三相流化床鼓泡塔中可达4U/mL。采用生物反应器中的间歇培养方法,重组的6种蛋白酶缺陷株枯草芽孢杆菌WB 600,粪产碱菌可分泌378U/mL的Pac(AfPac);具有位点定向突变(BmPacb24F)的菌株可分泌0.92U/mL的BmPac(BmPacb24F)。使用相同的菌株,在补料分批培养中分泌可高达1960U/mL的粪产碱菌青霉素G酰化酶(AfPac)。用其它重组枯草杆菌菌株或质粒系统,可分泌2.2U/mL的粘节杆菌青霉素G酰化酶(AvPac)和0.26U/mL或42U/mL的巨大芽孢杆菌青霉素G酰化酶(BmPac),见表5。

表4 短芽孢杆菌和枯草芽孢杆菌生产的胰岛素前体(不完全)

表5 巨大芽孢杆菌和枯草芽孢杆菌生产的青霉素G酰化酶(不完全)
2.6 葡萄球菌激酶和链激酶
葡萄球菌激酶(SAK)是由金黄色葡萄球菌分泌的一种不含二硫键的15.5kDa多肽。SAK与纤溶酶原的复合结合产生活性纤溶酶,降解血浆蛋白如纤维蛋白。因此,采用重组SAK作为溶栓药物治疗急性心肌梗死和预防血栓形成。已有研究表明重组蛋白酶缺陷型枯草芽孢杆菌在复合培养基中培养的SAK分泌情况;2种酶基因缺陷菌株DB 104,表达约25mg/L的SAK;7种蛋白酶基因缺陷菌株WB700和LB700,分泌可增加至120和181mg/L;WB700菌株在生物反应器中采用分批补料法,产率进一步提高到255和337mg/L(表6)。
SAK仅在纤维蛋白诱导时活化纤溶酶原,SEK则能在纤维蛋白及液相中均可活化纤溶酶原(非纤维蛋白特异性)。分子量为47kDa的链激酶最初由几种链球菌产生,同样用于治疗急性心肌梗死和血栓形成。来自于链球菌的链球菌属枯草杆菌GSB26可分泌150U/mL的SEK;枯草芽孢杆菌168和蛋白酶基因缺陷菌株DB194、WB428、WB500和BB600也可用于SEK生产(表6)。
2.7 链霉亲和素
链霉亲和素(SAV)是一类由阿维丁链霉菌产生的胞外四聚体蛋白,分子量约60kDa。SAV每个亚基都具有生物素结合位点,其结合具有高度特异性,因此,SAV被广泛应用于多种诊断性检测,具有靶向治疗的潜力。使用2种蛋白酶缺陷型枯草芽孢杆菌BE1510,在复合培养基中SAV的分泌量可达30~50mg/L,使用8种蛋白酶缺陷型芽孢杆菌WB800分泌量达35~50mg/L。使用7种蛋白酶缺陷型芽孢杆菌WB700SpoⅡG,采用半组合培养基与复合培养基培养方法分泌量分别达到24mg/L和90mg/L。同时使用8种蛋白酶缺陷型WB800菌株还能够产生其他不同类型的SAV(表7)。
3 系统生物学及其最新发展
为探究生物机体整个系统、重组蛋白在细胞中的生产过程并优化,需要采用精确的定量分析方法对整体进行研究,因此需要同时记录机体的不同组分(基因、转录产物、蛋白质、代谢物、代谢途径等)的情况。然而,生命不是静态的,了解机体的整体调控网路、协调它们在体内的相互作用以及探究不同生物成分是如何在一个整体发挥作用是很重要的。为此,系统生物学作为一门整合性科学产生了,它将经典生物学研究方法结合多门学科、利用信息学方法,评估机体各组分的相互作用和动态调控。
生物系统与其功能的研究需要高通量组学技术和先进计算方法的支持,实现大量实验数据的获得和处理。为了探究生物体的整体调节,系统生物学以多种方式系统地干扰生物体,记录不同水平下的变化:包括基因表达(转录组),蛋白质生产(蛋白质组学),代谢物的修饰(代谢组学),通路间的相互作用(通量组学)。将收集的数据整合起来,代入已知或假设的计算模型中,有助于其迭代精炼。将生成的数据和潜在的生物相互作用建立数据库,对未发现的代谢途径、遗传信息和相互作用模式进行索引,用于研究潜在瓶颈以期达成目标。
系统生物学的另一个转折点是自动化和标准化遗传工具的迅速发展,实现了快速测序、基因敲除、插入或诱变。此后,通过改变非生物条件或针对性地改变生物体的内在作用,实现系统干扰用于研究特定的调节途径。尽管在计算精密度和覆盖度等方面仍存在一些挑战,系统生物学已经在许多方面扩展了细胞学和生理学知识,可以有效收集并处理这些组学数据。能否克服这些挑战很大程度上取决于其他研究领域如计算机科学、生化工程、物理学和化学等学科的突破。
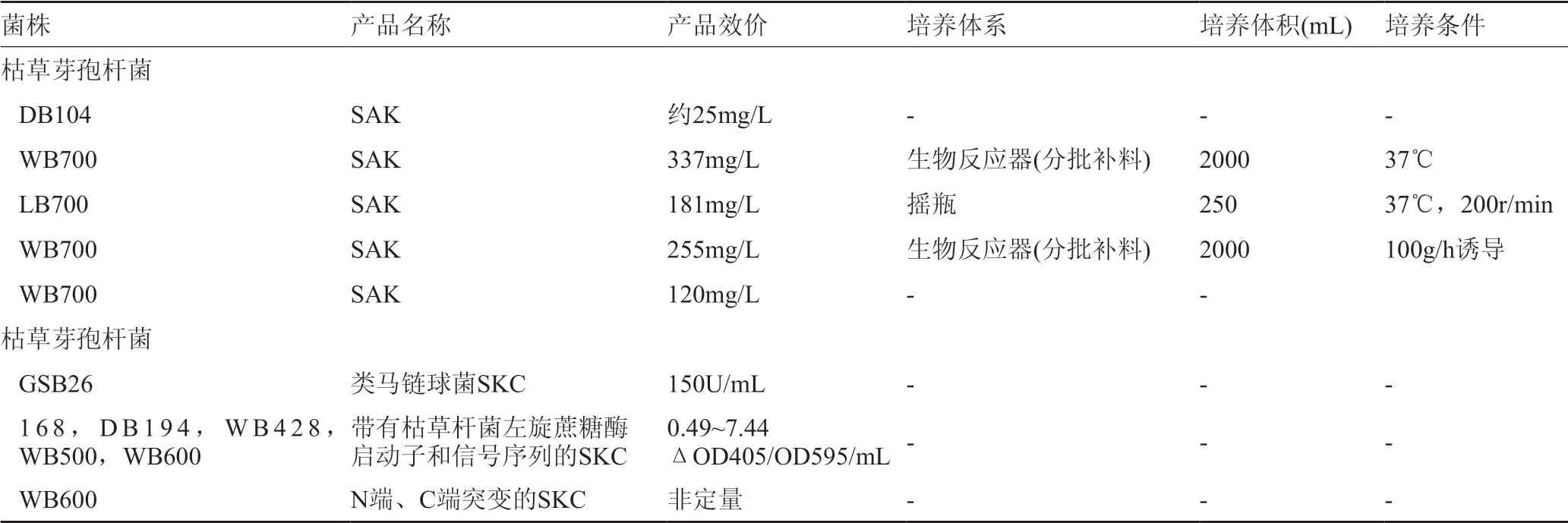
表6 枯草芽孢杆菌生产的葡萄球菌激酶和链激酶(不完全)

表7 枯草芽孢杆菌生产的链霉亲和素(不完全)
总之,系统生物学是一门很有前景的学科,在学术研究和工业应用方面都能得到广泛应用,例如可应用于芽孢杆菌研究。受试菌能够帮助预测遗传操纵和诱导的代谢干扰等如何影响表型,例如重组蛋白的生产分泌和副产物的形成。因此,它还将在改进芽孢杆菌工业生产抗体片段、生长因子或激酶等重组生物药物方面发挥重要作用。通过系统生物学方法,不用随机诱变,通过合理设计新型工业微生物就能生产高产量的相关蛋白质,简化培养条件,避免产生不必要的副产物。最后,重组芽孢杆菌菌株可以成为经遗传改造以适应生产过程的先验菌株。
3.1 基因组学和转录组学
根据过去30年来测序技术的快速发展,基因组测序变得更便利。对用于生产的芽孢杆菌菌株进行测序,尤其是用于生产重组蛋白的菌株,如枯草芽孢杆菌、地衣芽孢杆菌和巨大芽孢杆菌。随着每个月就能完成一个新的细菌基因组的完全测序,生物研究已进入后基因组时代,将收集到的遗传信息转化为遗传功能用于描述微生物的动态过程。对细胞在特定生理条件下存在的整套转录子进行定性及定量被称为转录组学,它是获得新的基因的功能和调节的有效方法。从发展历程看,基因表达首先是用Northern杂交方法进行分析,包括电泳和标记互补探针杂交;随后,逆转录酶的发现将mRNA转化为其互补DNA(cDNA)实现了定量实时逆转录聚合酶链式反应(qRT-PCR)的发展。qRT-PCR是目前最灵敏的RNA定量技术,然而,qRT-PCR是一种基因特异性方法,在基因组规模上监测基因表达水平需要花费大量的时间和精力。
约30年前发展起来的DNA微阵列技术提供了简单可靠的方法,能识别、量化多达数千个基因的表达水平。这是在一项针对枯草芽孢杆菌的全面研究中实现的,该研究涉及到生物体在自然界和蛋白质生产过程中可能受到的各种不同条件的影响。然而,微阵列存在一些缺点,它仅限于给定的探针而不能捕捉整个转录组的复杂性。这些DNA探针可能存在交叉杂交,如出现类似于目标序列的转录本会影响信号可靠性。此外,实验设置也会影响结果,计算是相对的,动态范围受信号饱和的内在限制和背景噪声的限制。最重要的是,这项技术依赖于正在调查的基因组序列的知识,因此并不普遍适用于非模式生物或特定菌株,例如用于生产重组蛋白的菌株芽孢杆菌。因此,RNA-seq,一种最近发展起来的基于下一代测序技术的高通量技术,克服了大部分限制,并预计未来几年将优于微阵列技术。这项技术已用于分析不同枯草杆菌mRNA的衰变。
3.2 蛋白质组学
虽然转录组分析给出了在特定环境条件下基因表达的全面概述,检测到的mRNA转录子只是基因和蛋白质之间的中间产物。相反,蛋白质承担从催化到基因调节的大部分细胞功能,包括核苷酸和氨基酸循环、信号转导和结构稳定。但由于转录后的调节和蛋白酶的活性,很难从转录水平推断它们的浓度,必须用专门的方法测定它们的浓度。
蛋白质组学为了解决这一问题,开发新的分析和计算技术,以检测、识别和量化给定样本中的整套蛋白质,即蛋白质组。蛋白质组学的研究范围还包括翻译后修饰以及蛋白质定位、相互作用和结构的详细表征,充分研究它们的生物学功能。经过详细研究表明,现有的分离和定量技术方法是可用的。通常,通过1D/2D十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶电泳法根据其摩尔质量(MM)和等电点(pI)分离蛋白质,染色;后经凝胶成像定量后,用气相色谱-质谱法进行定性。在重组蛋白生产过程中,对枯草芽孢杆菌和巨大芽孢杆菌的蛋白质组进行分析,解决因素,构建工程菌株。在现代蛋白质组学中,人们越来越关注使用非凝胶色谱分离技术和基于质谱(MS)的定量方法,而凝胶电泳主要是作为初步分离步骤,降低蛋白质或多肽的复杂程度更利于分析。
自1919年阿斯顿发明了第一种质谱仪以来,已经取得了大量的进步,并采用了如矩阵辅助激光解吸/电离(MALDI)和电离等软离子化如喷雾电离(ESI)等方法能测定完整的蛋白质和多肽。然而,对未损坏蛋白质的直接分析仍然具有较大挑战,测定其组成多肽的仍然是蛋白质分析的有效方法。在芽孢杆菌菌株研究方法中,目前除了蛋白质鉴定之外,对MS蛋白质组学和计算方法的改进已经可以做到相对和绝对定量。
3.3 代谢组学
自基因组、转录组和蛋白质组学技术被引入,已被成功地结合起来,得到生物系统功能的新认识。然而,这种组合也迅速显现其限制性,代谢产物的研究则能弥补基因组与其表型之间的鸿沟。测序的基因组通常包括30%~40%的编码具有未知功能的蛋白质的基因,或不考虑微小的构型差异可能带来的潜在生化意义,根据基因相似结构自动归属生化功能。而且,虽然代谢物库在很大程度上取决于酶的浓度和活性,但细胞转录体和蛋白质组变异不一定会导致表型改变,说明存在较强的翻译后调控机制。由于代谢产物进一步连接从基因组到表型和所有合成代谢和分解代谢反应,因此代谢产物很自然地作为下一步研究,以揭示新的基因功能、相互作用、代谢途径和调节系统。Buescher等系统地分析枯草芽孢杆菌在相应环境变化过程中的代谢产物。
生物体在给定的生理条件下合成的所有代谢物构成其代谢组。对生物体而言,它可包含多达200000种代谢物,其化学性质和浓度(从皮摩尔每升到毫摩尔每升)差异很大。这种多样性可获得非常丰富的信息,但同时也使所有代谢物的鉴定和定量,即代谢组学,成为现代生物化学的最大的挑战之一。代谢物指纹图谱的目的是对不同的样品进行分类,而不对代谢物进行定量、鉴别甚至分离,只用它们的特征测量谱作为判别标准。最后,代谢分析旨在对不同的代谢组定性和定量,例如氨基酸、碳水化合物或参与特定途径的那些代谢物,并理解它的生化作用。
3.4 通量组学
在细胞中,代谢物通过复杂、重叠的途径不断转化为其他代谢产物,最终产生能量和活性物质。基因组、蛋白质组、转录组和代谢组之间所有非线性调节和代谢相互作用的最终途径是通过这些代谢通量(即生化转化率)之间多样的调控展现出来的。这些通量均可表征机体的细胞生理方面和可观测外在的表型。所有的代谢通量都直观地展现了系统动力学,而其他组学数据则为解释这些结论提供了必要的基础。通量组学与其他组学技术的互补,充分显示了调控机制的复杂性,并表明转录后和翻译后的影响。有趣的是,在最近的研究中,基于转录组和代谢组学中的通量数据的实际分布和预测之间存在严重差异。通过对枯草芽孢杆菌适应限制营养和渗透变化过程中转录组、蛋白质组、代谢组和通量组的分析,提出了一种多功能分析方法,Kohlstedt等在该研究中提供了大量数据,展现了高超的生物技术水平。
代谢通量分析已经是一种成熟的技术,到目前为止,与其他经济学方法相比,它在研究和工业生产中都被大大低估,无法得到充分利用。它的实际应用范围只限于验证引入的遗传修饰的益处,例如分析突变株或提高重组蛋白在不同芽孢杆菌中的产量。相反,应该将其更广泛地应用于上游基因设计。应用合理的方法减少硅制品的使用,降低因副产物分泌增加、生长缓慢或细胞死亡等改变而产生的意外和有害的副作用,即所谓的降低了生产力。
在过去的十年里,一些研究进一步证实了通量组学在揭示芽孢杆菌表达系统的非常规优化和克服其限制因素中的极大的潜力。例如,一方面,组学技术应用于增加枯草芽孢杆菌和巨大芽孢杆菌中蛋白质和维生素的产量;另一方面,最近的一些研究揭示了通量组学在发现新途径或为已知通路拓展新的生物功能方面的潜力,使之成为发现生物的整体复杂性的不可或缺的工具。
4 前景展望
系统生物学工具在芽孢杆菌基因组、转录组、蛋白质组和代谢组中的应用及整体优化是提高重组蛋白产量的有效方法。系统生物学的思想是沿着现有方法,如在芽孢杆菌中构建新的基因,探究其编码蛋白质及代谢和信号途径。我们已经进行了第一次尝试:例如,根据目的蛋白的表达强度,可以从枯草杆菌启动子库中选择合适启动子;同样,也可以通过选择不同的信号肽,调节重组蛋白的分泌途径和分泌水平。就像启动子和信号肽序列设计是进一步合成更复杂的DNA结构的第一步,那么将多种芽孢杆菌表达、转化系统相结合,生产特定蛋白质也是可能的。为了全面优化芽孢杆菌系统,研究表明通过核糖体工程、人工分泌途径和基因组缩减等方法,能显著提高重组蛋白的产率。
5 结束语
近年来,芽孢杆菌在生产和分泌重组蛋白方面得到越来越广泛的应用,主要得益于高效表达系统的快速发展。芽孢杆菌生产的重组药物产品种类繁多,包括抗体片段、生长因子、干扰素和白细胞介素、胰岛素前体、青霉素G酰化酶、链霉亲和素、葡萄球菌激酶和链激酶等。因此,芽孢杆菌逐渐成为重要工业生产用菌。为提高芽孢杆菌生产分泌能力,必须明确其生化过程中调控机制及其主要遗传特性。因此,应在不同研究水平对芽孢杆菌菌株进行研究,即在不同培养条件下,从基因组学到转录组学,从蛋白质组学到代谢组学和通量组学中的不同特征进行探究。为了实现该目标,近期发展起来的系统生物学和组学技术(基因组学、转录组学、蛋白质组学、代谢组学和通量组学)成为必不可少的工具。总之,面向系统整体的研究方法才刚刚起步,芽孢杆菌的生产潜力是巨大的,因为组学工具和建模方法已在药学领域广泛应用,而应用于芽孢杆菌的实例却寥寥无几。未来,为使重组芽孢杆菌更高效地生产药物,组学技术应更多地用于发现并解决现行生产中的瓶颈,优化工艺达到目标。
