对赛北紫堇总生物碱的急性、亚慢性经口毒性试验研究※
2019-06-16华玉美多杨占婷张得钧李占强樊海宁芦殿香
李 珂,华玉美多,杨占婷,张得钧,李占强*,樊海宁,芦殿香***
(1.青海大学生态环境工程学院,青海 西宁 810001;2.青海大学高原医学研究中心,青海省高原医学应用基础重点实验室,青海-犹他高原医学联合重点实验室,青海 西宁 810001;3.青海大学附属医院肝胆胰外科,青海省包虫病重点实验室,青海 西宁 810001)
赛北紫堇(Corydalisimpatiens) 收录于《中华本草》,藏药名为“当日丝哇”,无毛一年或两年生草本,主要分布于青海等地。其为“扎桑”原植物,在藏药成方中的入药率高达25%。国内外对其毒理学研究仅停留在大体阶段,因此本研究对赛北紫堇总生物碱进行了急性及亚慢性经口毒性研究。
1 材料与方法
1.1 实验材料
赛北紫堇购于青海中藏药材市场,由青海大学张得钧教授鉴定为Corydalisimpatiens(pall.)Fisch.赛北紫堇。
昆明小鼠:20.0±2 g,150只,雌雄各半,由西安交通大学动物实验中心提供,生产许可证号:SCXK(陕)2017-003。
谷丙转氨酶试剂盒(货号:C009-2)、谷草转氨酶试剂盒(货号:C010-2)、肌酐试剂盒(货号:C011-2-1)、总胆固醇试剂盒(货号:A111-1-1)、甘油三酯试剂盒(货号:A110-1)、血尿素氮试剂盒(货号:C013-1)、白蛋白试剂盒(货号:A028-2)购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 赛北紫堇总生物碱制备
取赛北紫堇干燥地上部分30 kg,用85%乙醇闪式提取。乙醇提取液经浓缩至无乙醇味,加稀盐酸酸化(至pH3),用石油醚萃取脱脂,萃余相用10%氨水碱化(至pH10),静置12 h,取沉淀部位干燥后获得赛北紫堇总生物碱(648.2g)。
1.2.2 赛北紫堇总生物碱急性毒性试验
根据我国《食品安全标准 急性经口毒性试验》(GB 15193.3-2014)标准,应用寇氏(Korbor)法研究。以李海丽等[1]测得的半数致死量(medianlethaldose,LD50)为参考,选择的预实验剂量分别为350.0、250.0、178.6、127.6、91.0、65.0、46.4、32.8、23.0 mg/kg,对数等距。每组4只,雌雄各半,灌胃给药(仅1次)后观察14天内的反应,得到的绝对致死量(absolute lethal dose,LD100)与最大耐受剂量(maximal tolerance dose,LD0)为最高剂量与最低剂量。
取小鼠60只,根据预实验中获得的最高剂量与最低剂量,将其分为5个对数等距剂量组:100.0、67.0、47.8、29.9、20.0 mg/kg,每组12只,雌雄各半。根据我国《食品安全标准 急性经口毒性试验》(GB 15193.3-2014)标准中的寇氏法计算LD50及其可信限。
1.2.3 赛北紫堇总生物碱亚慢性毒性试验
亚慢性毒性实验分为4组:空白组,赛北紫堇总生物碱低剂量(5.0mg/kg)、中剂量(10.0mg/kg)、高剂量组(20.0mg/kg)。每组12只,雌雄各半,自由饮食。每日灌胃1次。末次给药后禁食,但予自由饮水。12 h后于眼球取血,取适量血液于含有肝素钠的离心管用半自动血液生化分析仪进行血液生理指标分析,用无肝素钠离心管中的血液制备血清用于生化指标分析。采血后解剖,取小鼠的心、肝、脾、肺、肾,计算脏器指数,并用4%多聚甲醛固定,行常规苏木素-伊红(Hematoxylin and Eosin,HE)染色、封片,用显微镜观察结果并拍照。
1.3 统计学方法

2 实验结果
2.1 赛北紫堇总生物碱急性毒性试验
通过预实验测得赛北紫堇总生物碱LD100为91.0 mg/kg,LD0为23.4 mg/kg。在正式试验中最高剂量和最低剂量设为100.0 mg/Kg和20.0 mg/kg。根据最高剂量和最低剂量对数差,设置5个对数等距的灌胃剂量:100.0、67.0、47.8、29.9、20.0 mg/kg。见表1。

表1 寇式法测定LD50实验结果Table 1 The test result of LD50 determined by Korbor method
表1为寇氏法测定赛北紫堇总生物碱致死率结果,并计算LD50,为42.9 mg/kg,可信限为33.8~54.5。
2.2 赛北紫堇总生物碱对小鼠的亚慢性毒性试验
2.2.1 赛北紫堇总生物碱对小鼠体重与脏器指数的影响
小鼠连续灌胃给药28 d后,中剂量组雌鼠体重与空白组相比具有统计学差异。雌鼠体重明显低于雄鼠,且高、中、低剂量组的雌鼠与雄鼠之间存在统计学差异。见表2。

表2 赛北紫堇总生物碱对小鼠体重的影响值Table 2 Effects of total alkaloids of C.impatiens on Murine body
* :表示与空白组比较差异显著(P<0.05),#:表示同一剂量下雌雄之间差异显著(P<0.05)
小鼠连续灌胃给药28 d后,雄鼠中剂量组,雌鼠低、中、高剂量组心脏指数低于空白组;雄鼠低、高剂量组的肺指数低于空白组。见表3。

表3 赛北紫堇总生物碱对小鼠脏器指数的影响值Table 3 Effects of total alkaloids of C.impatiens on viscera index in
* :表示与空白组比较差异显著(P<0.05)
2.2.2 赛北紫堇总生物碱对小鼠血液学及生化指标的影响
小鼠连续灌胃给药28 d后,与空白组相比,药物组雌鼠的白细胞数(WBC)、单核细胞数(Mon)、中性粒细胞值(Neu)、嗜碱性粒细胞值(Eas)、淋巴细胞数(Lym)明显升高;雌鼠低、高剂量组的嗜酸性粒细胞绝对值(Eos)升高。雄鼠的Neu、Bas与空白组相比升高;低剂量组Eos与空白组相比升高;低、高剂量组的Lym与空白剂量组相比升高。
雌鼠红细胞数(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、红细胞分布宽度变异系数(RDW-CV)、红细胞分布宽度标准差(RDW-SD)与空白组相比明显升高;低、中剂量组的血小板(PLT)显著升高。雄鼠RBC、HGB、HCT、RDW-CV、RDW-SD、PLT与空白组相比明显升高。
雌鼠空白组的WBC、Lym低于雄鼠空白组,而雌鼠低、中剂量组的WBC、Lym高于雄鼠;空白组与药物组的Mon雌鼠均低于雄鼠;空白组与低剂量组的Neu雌雄小鼠存在差异,雌鼠低于雄鼠,而高剂量组雌鼠高于雄鼠;空白组中雌鼠的Eos高于雄鼠;低剂量组雌鼠的RDW-CV、PLT高于雄鼠;低、高剂量组雌鼠的RDW-SD高于雄鼠。见表4。

表4 赛北紫堇总生物碱对小鼠血液指标的影响值Table 4 Effects of total alkaloids of C.impatienson blood indexes in
续表:
* :表示与空白组比较差异显著(P<0.05),#:表示同一剂量下雌雄之间差异显著(P<0.05)
血液生化指标分析发现,赛北紫堇总生物碱对雌鼠的影响较大。雌鼠的谷丙转氨酶(ALT)高于空白组;雌鼠的谷草转氨酶(AST)低、中剂量组与空白组有显著性差异;甘油三酯(TG)中、高剂量组均显著高于空白剂量组。雄鼠的ALT低、中剂量组均与空白组有显著性差异,且低、中剂量组均小于空白剂量组;高、低剂量组AST低于空白剂量组;雄鼠3个剂量组的ALB与空白组比均升高。
雌鼠中、高剂量组尿素氮(BUN)均显著高于空白剂量组(P<0.05);雌鼠中、高剂量组比空白组高;肌酐(CRE)高剂量组低于空白组。雄鼠高剂量组的CRE高于空白组。
雌鼠空白组ALT低于雄鼠,而中剂量组雌鼠高于雄鼠;雌鼠空白组与低、中、高剂量组的AST、BUN相比均高于雄鼠。雌鼠的ALB均低于雄鼠;空白组与低剂量组雌鼠的CRE高于雄鼠;雌鼠TG高于雄鼠。
上述数据见表5。

表5 赛北紫堇总生物碱对血液生化指标的影响值Table 5 Effect of total alkaloids of C.impatiens on blood biochemical

续表:
* :表示与空白组比较差异显著(P<0.05),#:表示同一剂量下雌雄之间差异显著(P<0.05)
2.2.3 赛北紫堇总生物碱对小鼠器官组织病理变化的影响
组织病理切片显示,空白组小鼠心脏、肝脏、脾脏、肺脏和肾脏等脏器的组织结构均正常。相对于空白组,赛北紫堇总生物碱使雌鼠高剂量组心肌间质增宽,见图1。
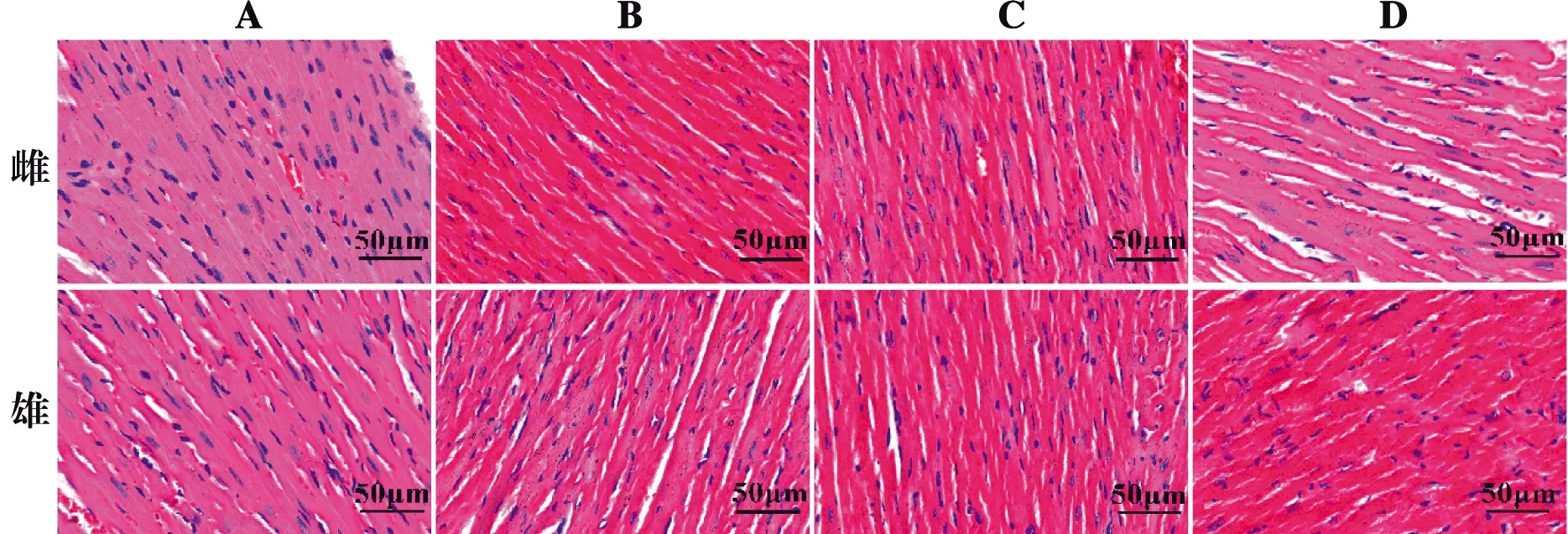
药物组血细胞增多,雌性小鼠的肺泡隔增厚;低剂量组支气管炎症细胞增多;中、高剂量组中可见明显渗出液及肺泡融合现象,出现炎症浸润现象。雄性小鼠肺泡隔变薄,出现明显炎症浸润现象,且雄鼠中剂量、高剂量组支气管出现大量炎性细胞。见图2。
雌鼠低剂量组肝血窦增多,肝索结构模糊,局部水肿;中、高剂量组肝细胞核萎缩,产生水肿。雄鼠低、高剂量组肝索模糊,肝细胞核萎缩,产生水肿,局部有嗜酸性变。雌鼠低剂量组肝索结构模糊较雄鼠严重,水肿现象较雄鼠轻;雌鼠中剂量组核萎缩、水肿现象较雄鼠严重;雄鼠炎症浸润较雌鼠严重。雌、雄小鼠均有炎症反应。见图3。
药物组中,雌鼠的脾脏较为疏松;高剂量组有局部纤维化,炎症细胞较多。雄鼠脾脏的红髓、白髓无明显损伤,雄鼠中、高剂量组有轻微炎症。见图4。
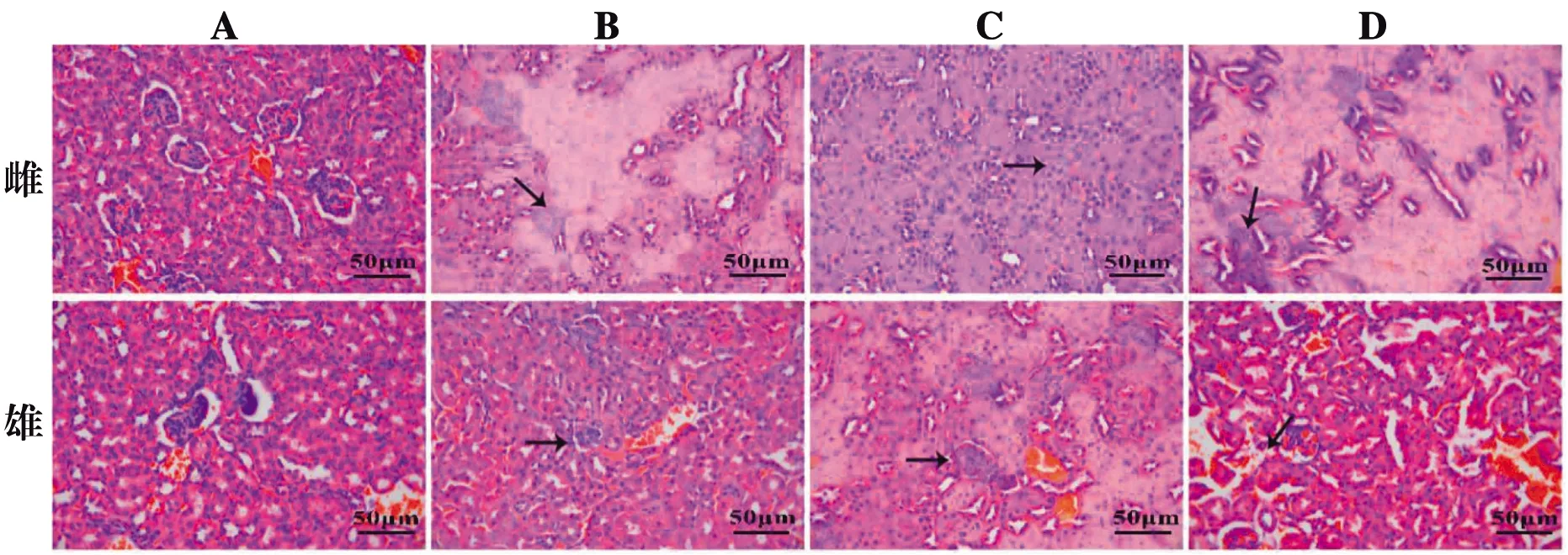
与空白组对比,雌鼠3个剂量组呈现凝固性坏死。雄鼠低剂量组肾小体淡化,边界模糊,远曲小管与近曲小管缩小,中、高剂量组呈现凝固性坏死。雌鼠的肾脏坏死较雄鼠严重。见图5。
A:空白组;B:低剂量组(5mg/kg);C:中剂量组(10mg/kg);D:高剂量组(20mg/kg)图1 小鼠心脏组织的病理变化图(HE,×400)Figure 1 Histopathological changes in the heart of mice(HE,×400)

A:空白组;B:低剂量组(5mg/kg);C:中剂量组(10mg/kg);D:高剂量组(20mg/kg)

A:空白组;B:低剂量组(5mg/kg);C:中剂量组(10mg/kg);D:高剂量组(20mg/kg)
A:空白组;B:低剂量组(5mg/kg);C:中剂量组(10mg/kg);D:高剂量组(20mg/kg)
A:空白组;B:低剂量组(5mg/kg);C:中剂量组(10mg/kg);D:高剂量组(20mg/kg)
3 讨论
本研究结果显示,急性小鼠出现中毒表现;亚慢性小鼠肝、肾损伤严重,且雌鼠损伤大于雄鼠。本研究测得的LD50与李海丽等[1]测得的LD50有一定差异,可能与提取方法有关。
对小鼠的亚慢性毒性研究数据表明:赛北紫堇总生物碱对雌鼠体重的增长具有抑制作用,且给药组雌性小鼠体重较雄鼠低。对小鼠的心、肝、脾、肾的脏器指数无显著性影响,雄性小鼠低、高剂量组肺组织指数降低。根据血液生理指标测定,发现赛北紫堇总生物碱对雌鼠的WBC、Neu、Lym、Mon、Eas影响明显(升高),可能存在炎症反应与水肿。与HE切片相结合,发现雌鼠肺、肝、脾、肾脏炎性细胞增多,具有炎症浸润现象。雌鼠RBC、HGB、HCT、RDW-CV、RDW-SD升高,可能与小鼠缺氧或肺部炎症有关。雄鼠Neu、Bas、RBC、HCT、RDW-CV、RDW-SD升高,可能存在炎症浸润。通过血清生化指标进一步验证发现AST、ALT、BUN、CRE、ALB、TG均有变化,雌鼠中、高剂量的ALT、TG有明显升高,低、中剂量组的AST升高,可能会增加肝脏负担,导致肝脏损伤[2]。雄鼠低、中剂量的ALT,低、高剂量组的AST降低,可能是肝脏存在炎症所致[3]。雌、雄鼠各个组之间均有差异,而不同性别的ALT、AST空白组指标存在明显差异,与血液生理学指标结合,显示赛北紫堇总生物碱对小鼠肝脏具有损伤性。雄鼠ALB升高与小鼠肝脏损伤有关。雌鼠中、高剂量组的BUN显著升高,高剂量组的CRE降低与肾功能有关;病理切片观察结合上述指标研究发现,小鼠肺、肝、脾组织存在炎症反应;雌性肝、肾小鼠炎症浸润较雄鼠严重。小鼠肾小体结构淡化或消失,有局部坏死;雌鼠肾脏凝固性坏死较雄鼠严重。上述结果显示赛北紫堇总生物碱对小鼠的肾脏、肝脏损伤较为明显。
赛北紫堇中含有大量异喹啉类生物碱,已报道23个,niuxiaofeng等对其中11种生物碱含量进行了测定,其中bicuculine与protopine较高,为赛北紫堇总生物碱的总成分,且发现藏地不同区域的塞北紫堇总生物碱主成分存在差异[4-5]。国内外对赛北紫堇总生物碱与其生物碱类成分的毒理学研究极少,因此在后续研究过程中,应当进一步明确主要毒性物质,为药材的质量控制标准提供可靠依据。
综上所述,赛北紫堇总生物碱对雌雄小鼠的影响存在性别差异(雌鼠损伤大于雄鼠);急慢性方面:急性小鼠出现中毒表现;亚慢性小鼠肝、肾损伤严重。
