冷诱导RNA结合蛋白的调控与功能研究进展
2019-06-14王晓慧徐孝娜秦绪军
王晓慧, 徐孝娜, 秦绪军, 王 枫
(第四军医大学 军事预防医学系 营养与食品卫生学教研室, 西安 710032)
体温下降对细胞的直接影响是整体蛋白质的合成受到抑制,从而使细胞转变为维持生存的状态。与大多数蛋白合成降低相反,一小部分蛋白,如冷诱导RNA结合蛋白[Cirbp/CIRP,异质核糖核蛋白A18(hnRNP A18)],表达增加[1-2]。Cirbp属于富含甘氨酸蛋白(GRP)家族,N′端有一个保守的RNA识别基序(RRM),含有两个核糖核蛋白(RNP)域:RNP1和RNP2[3],C’端包含一个富含甘氨酸(RGG)结构域。Cirbp是应激应答基因,它们的表达在多种应激情况下均可诱导,包括低温和高温、低氧、辐射、药物等。
Cirbp是早期发育的关键因子。在两栖类,被广泛用于发育研究模型,Xenopuslaevis(非洲爪蟾)同源xCIRP-1在发育中的肾脏和脑中瞬时表达,对胚胎肾形成至关重要[4]。Cirbp的同系物AxRBP在墨西哥蝾螈的表达在原肠期10~12 d开始,在神经胚期15 d尤其是在神经板和神经褶达到峰值,孵化后下降到低水平[5]。在人类,Cirbp在甲状腺和心脏呈高表达[6]。大鼠慢性间歇性冷暴露能引起代谢相关组织脑、心肌组织、骨骼肌和肝组织中Cirbp表达上调[7]。在亚细胞水平,Cirbp主要分布在细胞核中,参与调控基因的转录或结合mRNA进行转录后调控,在生理或应激的情况下,Cirbp会在细胞核和细胞质之间穿梭[8]。在哺乳动物中,细胞质应激和内质网(ER)应激时,Cirbp RGG结构域精氨酸残基的甲基化会引起Cirbp在细胞质应激颗粒中蓄积,而同应力颗粒TIA-1的形成无关[9]。
临床上,治疗性低温(32℃~34℃)已被证明是缓解缺氧缺血性脑病和成人急性脑损伤患儿神经功能缺损的有力工具,而Cirbp蛋白质的合成在温和到中度低温(32℃~34℃)时达到高峰[10],因此Cirbp是很有前途的研究方向。
1 Cirbp的分子调控
目前,尽管已经提出了一些涉及不同调控水平的模型,但低温和其他应激调节冷诱导蛋白的转录和翻译的确切机制尚不清楚。在转录水平上,小鼠Cirbp基因上的核心启动子和启动子在低温时可被活化[11]。选择性剪接是低温应激应答的重要途径之一,冬眠动物主要表达短的异构体,具有完整的开放阅读框(ORF)[2]。人工低温可以部分促进从长型异构体向短功能亚型的转变[2]。在小鼠成纤维细胞,Cirbp的5′-UTR和全长ORF存在于两个转录体上,这两个转录体在低温条件下均可产生,Cirbp转录体的5′-UTR上包含一个内部核糖体进入位点(IRES),而在热应激条件下,亚型缺少5′-UTR和起始甲硫氨酸的编码序列[12]。Cirbp可在DNA双链断裂(DSBs)修复早期聚集在损伤部位,同PARP-1作用从而调节DSB修复和基因组的稳定性[13]。此外,转录因子可能调控冷诱导基因的转录,同37℃相比,在32℃,大量的转录因子Sp1招募到Cirbp基因5′侧翼区的温和冷反应元件(MCRE),从而增加了Cirbp表达[14]。总的来说,Cirbp对多种应激应答下的表达改变存在多种机制,提示对各种外部和内部的应激存在广泛适应。
2 Cirbp对转录后和翻译的调节
正如其他的RNA结合蛋白,Cirbp能够结合RNAs,从而调节其转录后水平[15-16]。在紫外光的照射下,Cirbp结合到3′-UTR两个应激应答转录体上,复制蛋白A(RPA)和硫氧还蛋白(TRX),从而稳定结合的mRNA表达和促进其翻译[17-18]。Cirbp的RRM结构域和RGG结构域通过eIF4G连接TRX转录体的 5′-和3′-UTRs,eIF4G是增强TRX翻译的一个关键组成部分。除了3′-UTR,poly(A)尾是Cirbp介导转录后调节的一个重要调控元件。Cirbp富含poly(A)位点且控制许多基因的多聚腺苷酸化,如昼夜节律基因等,poly(A)尾可以加强Cirbp同TRX3′-UTR的结合并增强其稳定性[17-18]。
Cirbp在蛋白质翻译中的功能还不清楚。有一些证据表明Cirbp可能通过靶向调控元件内部基因抑制基因转录和翻译。例如,APBP-1,Cirbp鸡同源体,结合到蛋白聚糖基因顺式元件上并抑制其表达[19]。相反,在建系的CHO细胞系,37℃过表达Cirbp提高重组干扰素γ蛋白的生成[20]。
3 生物学功能与疾病
3.1 脑部疾病
治疗性低温不仅能有效地减轻急性缺血和脊髓损伤(SCI)的原发性损伤及防止其继发性损伤,而且能延缓慢性神经变性疾病的进展。Cirbp在脑缺血损伤中的作用仍有争议。大鼠海马缺血后3~6 h,CirbpmRNA表达降低,但在大脑皮层48 h仍保持不变[21]。然而,在相同的脑缺血模型,大鼠皮层脑缺血后24 hCirbpmRNA增加了约5倍,同缺血相反,低温显著诱导Cirbp表达,24 h约增加30倍,低温缺血联合暴露没有累加效应[22]。
ROS水平升高是脑缺血再灌注损伤中氧化应激诱导的一个重要的不利因素。在PC12细胞中,已经观察到H2O2处理产生ROS后 Cirbp的表达下调,当内源性或人工过表达诱导Cirbp表达升高后,对H2O2诱导的神经细胞凋亡有明显抑制,表明Cirbp具有神经保护作用[21, 23]。同胞内的有益作用相反,Cirbp释放进入血液系统与有害的免疫应答有关。体内和体外实验均显示,脑缺血后小胶质细胞分泌的Cirbp同之后的Cirbp介导的TNF-α表达导致的神经炎症反应和引起神经元损伤有关[24]。综上所述,Cirbp在脑缺血再灌注损伤中具有双重作用:一方面,只要Cirbp仍然在细胞内定位,它可以保护神经元免于凋亡;另一方面,一旦Cirbp释放到胞外,会激活小胶质细胞从而引起中枢炎症反应。
3.2 昼夜节律
Cirbp在小鼠视交叉上核(SCN)和大脑皮层的表达存在昼夜调节,Cirbp的表达6 pm达到峰值,3 am表达最低,变化具有光依赖性,且这种波动只发生在幼年和成年小鼠[25]。同哺乳动物一样,光信号已被观察到诱导两栖动物脑Cirbp的表达[26]。2012年,Cirbp被确定为转录后修饰哺乳动物昼夜节律的基因,如 CLOCK基因[15]。
在哺乳动物中,SCN的中枢节律系统将体温周期与环境光-暗周期和外周时钟(如肝脏和胰腺)同步起来[27]。最近的一项研究表明Cirbp导致小鼠肝细胞对温度敏感的振动,同哺乳动物体温和外周组织的昼夜节律的轻微波动有关联[28]。此外,由于肝脏和胰腺是必不可少的代谢器官,营养必然影响这些器官的外周节律,如生酮饮食和禁食,扰乱外周时钟,诱导肝脏Cirbp表达[29]。因此,Cirbp被认为是哺乳动物昼夜节律振荡的一个组成部分,它不仅受体温调节和环境改变应答,如光照的细微改变,而且还控制下游节律基因的表达。
3.3 免疫应答
模式识别受体(PRRs)是识别病原相关分子模式(PAMP)和损伤相关分子模式(DAMP)的原始的关键部件,在植物到哺乳动物具有高保守性[30-31]。2007年,首次发现植物低温诱导蛋白——AtGRP7参与植物免疫调节,AtGRP7显著提高PAMP触发的免疫应答,通过结合两个PRRS(FLS2和EFR)的转录体和蛋白质[32]。哺乳动物的冷诱导蛋白也参与了天然免疫应答。2013年,Cirbp被认定为一种新的炎症介质,在失血性休克和脓毒症时从心脏和肝脏释放入血,结合TLR4-MD2复合体(一类哺乳动物PRRS),刺激TNF-α和HMGB1分泌从而触发炎症反应[33]。相反,Cirbp的表达可被TNF-α或TGF-β抑制,提示存在负反馈调节。低温诱导的肝Cirbp表达通过减少ROS的产生保护肝细胞[34],而当进行抗Cirbp抗体治疗,可显著降低炎症反应,保护肝脏免于缺血再灌注损伤[35]。如今用ELISA法检测外周血中Cirbp水平,探讨Cirbp作为一种新的脓毒症诊断标志物的可能性。胞外Cirbp通过诱发炎症反应诱导细胞损伤,然而,在炎症的晚期,受损的细胞被炎症消除,再生的细胞可以替代功能失调的细胞[36],因此Cirbp介导的免疫反应可能也有有利的方面。
3.4 癌症
Cirbp被认为是一种原癌基因,在增殖和恶性肿瘤细胞中参与细胞周期调控和细胞增殖,且在不同的癌症中与正常组织表达有差异(表1)。在原发性肝细胞癌(HCC),Cirbp可控制ROS蓄积和癌症干/祖细胞扩增促进癌症发生,肝癌复发的风险与肝Cirbp表达呈正相关,抑制Cirbp可能至少在肝癌治疗中具有治疗价值[37]。在结直肠肿瘤,Cirbp通过刺激细胞因子TNF-α和IL-23参与肿瘤发生和慢性炎症[38]。在垂体腺瘤,高Cirbp表达可能通过ERK1/2信号通路同肿瘤的增殖侵袭和复发密切相关[39]。在口腔鳞状细胞癌,Cirbp与TLR4共表达且与短期生存率相关[40]。与正常子宫内膜相比,子宫内膜癌和子宫内膜增生Cirbp表达缺失或明显下降,表明Cirbp在正常组织增殖中发挥作用[41]。Cirbp增加细胞周期调控因子CyclinE1的表达,促进乳腺癌转化增殖和肿瘤进展[42]。总之,越来越多的临床研究表明,Cirbp与肿瘤预后差有关。
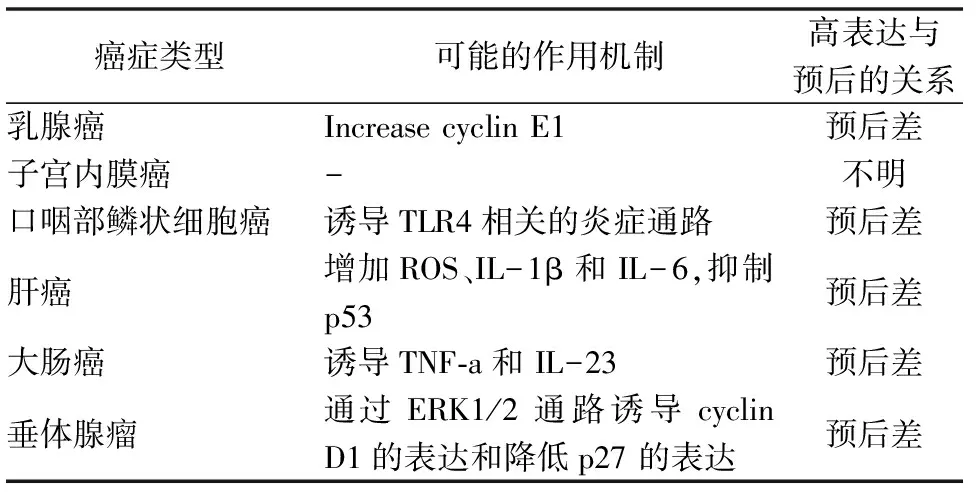
表1 Cirbp在癌症中的作用
3.5 繁殖
1997年,Cirbp在哺乳动物的睾丸生殖细胞中首次被发现[43]。睾丸的生理温度低于体温,这有利于精子的发生。已经提出了几种机制来解释Cirbp在精子和睾丸损伤中的保护作用。在转录后水平,提高阴囊温度导致睾丸和附睾减少Cirbp表达和生精细胞凋亡增加[44-45];减少生殖细胞氧化应激和细胞凋亡防止睾丸扭转复位后睾丸损害,Cirbp表达下调后,生殖细胞的p44/p42、p38和SAPK/JNK MAPK通路活化,从而损害精子的发生[46],抑制促凋亡蛋白p53和Fas降低隐睾诱导的睾丸损伤[47];Cirbp调节细胞周期的关键通路或组件,如同 Dryk1b /Mirk相互作用促进未分化的精原细胞的增殖[48]。
4 结论与展望
综上所述,Cirbp除参与冷应激时细胞的各种生理进程外,在常温下许多内源性和环境应激条件,如渗透压改变、辐射、毒素药物和生长因子等,也发挥重要作用。Cirbp在多种类型的细胞中存在,可以由各种不同的细胞应激激活,在细胞中的作用取决于特定的细胞状态,也就是其他应激应答分子的存在。本文通过阐明Cirbp的上游和下游的分子和细胞方面,全面总结了Cirbp的生物功能,并强调其同体内各种生理和病理过程的关系。作为一个新的增殖相关蛋白,可通过抑制Cirbp的表达来使细胞的增殖受损并增加细胞对化疗的敏感性,因此调节Cirbp的表达可应用到多种类型癌症的治疗。人和雄性动物生殖细胞温度升高后Cirbp表达水平降低,对睾丸Cirbp表达机理的探讨将有助于阐明男性不育的分子机制。目前低温保护已应用于心脏外科、脑外科等,对心脏骤停和脑缺血-再灌注损伤的治疗及预后有重要意义。对今后Cirbp治疗意义的关键是能够将现有的关于Cirbp作用的知识,靶向直接其中一个或者两个蛋白或它们参与的信号通路,从而应用到具体的治疗方法。
