转录因子KLF5调控宫颈癌细胞上皮-间充质转化的分子机制
2019-06-14杨文博李芊芊曲鑫建
杨文博,李芊芊,王 键,曲鑫建
(大连理工大学盘锦校区生命与医药学院,中国辽宁盘锦124221)
宫颈癌是最常见的妇科恶性肿瘤之一,统计数据显示其发病率和死亡率呈逐年上升的趋势[1]。近年来,诊断和筛查技术有了很大的进步,但宫颈癌仍然是威胁女性生命健康的第二大原因[2]。肿瘤间质浸润、淋巴转移等是宫颈癌预后不良的重要因素[3]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)与恶性肿瘤的浸润转移密切相关。EMT是指上皮细胞通过特定程序转化为间质表型细胞的生物学过程,其主要表现为上皮标记E-cadherin、角蛋白等表达降低,间质标记物如波形蛋白、N-cadherin和基质金属蛋白酶等表达增加,细胞的迁移能力增强[4]。EMT可以促进宫颈癌细胞的浸润、侵袭和转移,影响患者的预后[5]。
Krüppel样因子 5(Krüppel-like factor 5,KLF5)又称为BTEB2(basic transcription element-binding protein 2)或 IKLF(intestinal-enriched Krüppel-like factor)。作为一种重要的转录因子,KLF5可调控众多下游靶基因的表达,包括细胞周期蛋白D1(cyclin D1)、细胞周期蛋白 B1(cyclin B1)、纤维细胞生长因子结合蛋白(fibroblast growth factor-binding protein,FGF-BP)等的编码基因[6~9],进而影响细胞的增殖、迁移、侵袭等生物学过程。目前,已有报道显示KLF5在宫颈癌的发生发展中发挥作用。Marrero-Rodríguez等[10]发现 KLF5 在宫颈癌中表达上调,可能在宫颈癌的发生发展及浸润转移中起着作用。Ma等[11]发现KLF5可以通过上调TNFRSF11a的表达促进宫颈癌细胞的增殖、侵袭和转移。尽管如此,KLF5在宫颈癌中发挥作用的机制尚未阐明,仍需进一步研究。本文以宫颈癌细胞为研究对象,探索KLF5在宫颈癌细胞EMT过程中的分子调控机制,为宫颈癌的诊断与治疗提供一定的依据。
1 材料和方法
1.1 材料
1.1.1 细胞
人宫颈癌HeLa细胞、人子宫颈鳞癌SiHa细胞、C33A细胞和Cos7细胞源自美国ATCC(American Type Culture Collection)细胞库。
1.1.2 质粒
pcDNA3.1质粒、Flag-KLF5质粒、GFP-SNAI1质粒、SNAI1-Luc截短体质粒等均来自实验室构建。KLF5干扰质粒由生工生物工程(上海)股份有限公司合成,其序列见表1。
1.1.3 主要试剂
胰酶、青/链霉素、细胞裂解液、1×磷酸盐缓冲液(phosphate buffered saline,PBS)、噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)和脂质体Lipo2000等购自北京索莱宝科技有限公司;胎牛血清(NQBB,澳大利亚)、DMEM 培养基(Dulbecco’s modified Eagle’s medium,Gibco,USA)、EMEM 培养基(Eagle’s minimum essential medium,Hyclone,USA)购自大连赛拓生物科技有限公司;BCA(bicinchoninic acid)试剂盒和Trizol试剂购自碧云天生物科技有限公司;兔抗KLF5抗体、兔抗SNAI1抗体购自生工生物工程(上海)股份有限公司;兔抗E-cadherin抗体、兔抗N-cadherin抗体购自沈阳万类生物科技有限公司;鼠抗GAPDH抗体、鼠抗Flag标签抗体、兔抗GFP标签抗体购自义翘神州(北京)科技有限公司;反转录试剂盒PrimeScriptTMRTMaster Mix(Perfect Real Time)、SYBR GREEN Mixture试剂盒、TaKaRa Ex Taq®Hot Start Version试剂购自宝生物工程(大连)有限公司;β半乳糖苷酶(β-galactosidase,β-gal)表达质粒、荧光素酶报告基因检测试剂盒购自上海翊圣生物科技有限公司。
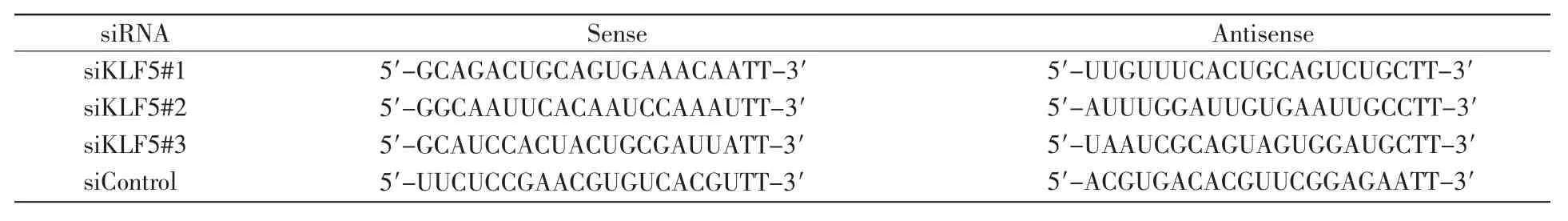
表1 KLF5干扰RNA序列Table 1 KLF5 interfering RNA sequences
1.1.4 主要仪器
Synergy H1酶标仪购自美国BioTek公司;TaKaRa TP600 PCR仪购自宝生物工程(大连)有限公司;EPS 600电泳仪购自上海天能科技有限公司;AlphaImager HP凝胶成像仪购自美国Alpha公司;LightCycler@96荧光定量PCR仪购自瑞士Roche公司。
1.2 方法
1.2.1 细胞培养与转染
细胞培养于含10%胎牛血清的培养基(HeLa、Cos7细胞使用DMEM培养基,SiHa、C33A细胞使用EMEM培养基),于37℃、5%CO2的培养箱中培养,待细胞长至90%时进行传代。
HeLa细胞转染:传代HeLa细胞至两组6 cm培养板,待细胞长至70%~80%时,使用Lipo2000进行转染操作,一组转染6 μg pcDNA3.1空载质粒,另一组转染6 μg Flag-KLF5质粒 (或者6 μg GFP-SNAI1 质粒)。
SiHa细胞转染:传代SiHa细胞至两组6 cm培养板,待细胞长至70%~80%时,使用Lipo2000进行转染操作,一组转染6 μg siControl序列,另一组转染 6 μg siKLF5 序列(6 μg siKLF5#1、6 μg siKLF5#2、6 μg siKLF5#3、6 μg siKLF5#Mix=2 μg siKLF5#1+2 μg siKLF5#2+2 μg siKLF5#3)。
Cos7细胞转染:传代Cos7细胞至24孔培养板,待细胞长到70%~80%时,6个孔为一组,每组转染 300 ng的 β-gal表达质粒和 300 ng的SNAI1-Luc质粒,然后其中3个孔转染400 ng的pcDNA3.1空载质粒,另外3个孔转染400 ng的Flag-KLF5质粒 (或者梯度转染150 ng、300 ng、600 ng Flag-KLF5 质粒)。
1.2.2 MTT比色法
HeLa细胞转染24 h后,胰酶消化收集细胞,按照每孔 1×103~2×103个细胞接种 96孔板。将细胞置于培养箱中培养5~6 d,每天固定一个时间点每孔加入10 μL的MTT,避光孵育4 h,吸除上清液。吸除最后一天的样品上清液后,每孔加入100 μL 的二甲基亚砜(dimethyl sulfoxide,DMSO)。将锡箔纸包裹的96孔板置于水平摇床上,室温避光溶解15~30 min,直至没有杂质,随后用酶标仪检测OD490处的吸光值,用GraphPad Prism 5.0处理数据。
1.2.3 细胞划痕及Transwell实验
细胞划痕实验:HeLa细胞转染24 h后,用枪头在培养皿中清晰笔直且等距离地划三道线;在倒置显微镜下观察0 h、24 h时同一视野区域并拍照,记录划痕宽度。
Transwell细胞迁移实验:HeLa细胞转染24 h后,消化细胞,用无血清DMEM培养基悬浮并计数。取24孔板并加入500 μL含10%胎牛血清的DMEM培养基,放入Transwell小室;取10 000个细胞接种于Transwell小室,培养40 h后取出Transwell小室,用PBS洗两遍,5%戊二醛固定30 min;用棉签擦去上室内的细胞,对下室细胞进行结晶紫染色30 min,显微镜下拍照计数。
Transwell细胞侵袭实验:HeLa细胞转染24 h后,消化细胞,用无血清DMEM培养基悬浮并计数。取24孔板并加入500 μL含10%胎牛血清的DMEM培养基,放入Transwell小室,在上室内加入100 μL基质胶溶液(用4℃预冷DMEM培养基稀释至1 mg/mL),37℃温浴4~5 h使其干成胶状;取50 000个细胞接种于Transwell小室,培养40 h后取出Transwell小室,用PBS洗两遍,5%戊二醛固定30 min;用棉签擦去上室内的细胞,对下室细胞进行结晶紫染色30 min,显微镜下拍照计数。
1.2.4 Western-blot检测
HeLa(或 SiHa、C33A)细胞转染 24 h 后,PBS洗涤两遍,加入适量RIPA裂解液,4℃裂解30 min,随后在4℃条件下12 000 r/min离心10 min,上清液即为提取的细胞总蛋白质。用10%SDSPAGE进行电泳,转移至PVDF膜,5%脱脂奶粉室温封闭1 h,4℃条件下一抗孵育过夜,PBST洗膜3次,室温孵育二抗1 h,化学发光法显示结果。以GAPDH为内参,实验至少重复3次。
1.2.5 Real-time PCR检测
HeLa(或 SiHa、C33A)细胞转染 24 h 后,PBS洗两遍,加入1 mL Trizol试剂裂解细胞,转移至离心管后加入200 μL氯仿,震荡混匀并静置10 min;4℃、12 000 r/min离心15 min,吸取上层水相至另一离心管,加入500 μL异丙醇混匀,室温静置10 min;4℃、12 000 r/min离心10 min,弃上清,加入1 mL预冷75%乙醇悬浮沉淀;4℃、7 500 r/min离心5 min,弃上清,室温晾干后加入30 μL DE-PC水溶解RNA样品并测定浓度。利用反转录试剂盒PrimeScriptTMRT Master Mix(Perfect Real Time)说明书将提取的RNA反转录为cDNA,反转录条件为:37℃反应15 min,85℃失活5 s。由生工生物工程(上海)股份有限公司设计并合成KLF5、SNAI1(snail family transcriptional repressor 1)、SLUG(snail family transcriptional repressor 2)、E-cadherin(cadherin 1)、N-cadherin(cadherin 2)、MMP9(matrix metallopeptidase 9)、ZEB1(zinc finger E-box binding homeobox 1)、ZEB2(zinc finger E-box binding homeobox 2)、TWIST1(twist family bHLH transcription factor 1)、GAPDH等基因的荧光定量PCR引物,引物如表2所示。
图 4为Ma∞=1.5时燃烧室内的流线、 声速线和当地Mach数分布图. 根据图 4(a)可见楔板后侧和凹腔内均出现较大范围回流区, 图 4(b)显示除喷流膨胀区和楔板后缘小部分区域外, 燃烧室整体为亚声速流动(Ma<1), 这是由于当Ma∞=1.5时, 燃烧室内发生高化学当量比的富油燃烧, 燃烧产生的巨大热量造成热壅塞, 使流动发生壅堵, 隔离段内产生正激波且被推至隔离段入口处(如图4(b)所示).
以上述cDNA为模板,采用SYBR GREEN Mixture 试剂盒检测 KLF5、SNAI1、SLUG、E-cadherin、N-cadherin、MMP9、ZEB1、ZEB2、TWIST1 的mRNA水平。以GAPDH为内参,每个样品设置3个复孔。实时定量PCR反应条件为:95℃预变性30 s;95℃变性10 s,60℃延伸30 s,共40个循环;95℃10 s,65℃60 s,97℃1 s解离。反应结束后,分析扩增曲线和融解曲线,并利用2-△△Ct方法进行统计学分析。
1.2.6 荧光素酶报告基因实验
JASPAR数据库(http://jaspar2016.genereg.net/)能预测启动子区可能的转录因子结合位点。我们根据预测的KLF5结合位点设计不同长度的SNAI1启动子截短体PCR引物,并在5′端添加酶切位点KpnⅠ(AAGCTT)和 HindⅢ (GGTACC)以及保护碱基,具体引物信息如表3所示。上述引物由生工生物工程(上海)股份有限公司合成。
按照TaKaRa Ex Taq®Hot Start Version说明书中的步骤,用PCR法从HeLa细胞基因组DNA中克隆所需的SNAI1启动子截短体片段。PCR反应条件为:94℃预变性5 min;94℃变性30 s,59℃退火30 s,72℃延伸2.5 min,反应进行30个循环;72℃最后延伸10 min。对扩增产物双酶切后插入到荧光素酶报告基因质粒(pGL3-basic)中,筛选阳性克隆测序,随后扩增克隆并提纯质粒备用。
Cos7细胞转染20~24 h后,按照荧光素酶报告基因检测试剂盒说明书测定荧光强度,并测定β-gal含量以计算相对荧光强度。

表2 荧光定量PCR引物Table 2 Primers used for real-time quantitative PCR analysis

表3 SNAI1启动子截短体的PCR扩增引物Table 3 Primer sequences of SNAI1 promoter truncation for PCR amplification
1.2.7 数据处理
2 结果
2.1 过表达KLF5基因能够抑制宫颈癌HeLa细胞的迁移和侵袭
为了研究KLF5基因在宫颈癌细胞中发挥的作用,选取C33A、SiHa和HeLa等几种宫颈癌细胞系作为研究对象。首先通过Western-blot和realtime PCR技术检测这几种细胞系中KLF5基因的表达情况,结果显示KLF5基因在SiHa细胞中呈高表达,在HeLa和C33A细胞中表达量较低,且在HeLa细胞中的表达量更低(图1)。鉴于此,本论文选择HeLa细胞和SiHa细胞为研究对象,在KLF5基因低表达的HeLa细胞中过表达KLF5基因,在KLF5基因高表达的SiHa细胞中沉默KLF5基因以便进一步研究。
在宫颈癌细胞HeLa中分别转染Flag-KLF5质粒(实验组)和pcDNA3.1空载质粒(对照组),然后进行MTT实验,结果表明:与对照组相比,过表达KLF5基因后宫颈癌细胞HeLa的增殖变化不显著(图2A)。但是,进一步的细胞划痕实验结果显示:过表达KLF5基因可以显著地抑制HeLa细胞的迁移能力(图2B)。而且,我们通过Transwell实验也得到同样的结果,即KLF5基因可以抑制HeLa细胞的转移和侵袭能力(图2C)。
2.2 过表达KLF5抑制HeLa细胞的EMT过程
为了探究转录因子KLF5调控宫颈癌细胞转移和侵袭的分子机制,采用real-time PCR和Western-blot实验来检测HeLa细胞中转移相关蛋白质的表达水平。首先,在HeLa细胞中过表达Flag-KLF5质粒,结果显示Flag-KLF5质粒在HeLa细胞中可以正常表达(图3A)。进一步的real-time PCR实验结果显示:过表达KLF5基因后,细胞转移相关因子的mRNA表达水平发生变化,其中上皮样标志分子E-cadherin的mRNA表达升高,间质样标志分子N-cadherin和迁移标志分子MMP9的mRNA表达降低。通过检测E-cadherin基因的上游调控因子发现,SNAI1、SLUG、ZEB1/2、TWIST1等转录因子的mRNA表达下降(图3B,C)。转录因子SNAI1是EMT过程中重要的参与者,可以结合到E-cadherin启动子的E-box元件从而抑制其转录,此外,其还可以调控SLUG、ZEB1/2、TWIST1、N-cadherin和MMP9的表达。Westernblot检测结果显示:过表达KLF5后,HeLa细胞的E-cadherin表达上调,N-cadherin和SNAI1表达下调(图3D)。
2.3 沉默KLF5基因促进SiHa细胞的EMT过程
为了验证KLF5基因是否确实可以调控宫颈癌细胞的迁移和侵袭,在KLF5基因高表达的Si-Ha细胞中用siRNA沉默KLF5基因,然后采用real-time PCR和Western-blot检测相关基因的表达。结果如图4所示,沉默KLF5基因后,E-cadherin表达降低,N-cadherin表达升高,MMP9变化不显著(图4B)。同时,其上游基因SNAI1、SLUG等表达升高,且SNAI1变化最为显著,ZEB1/2升高不显著(图4C)。Western-blot实验显示E-cadherin表达下调,N-cadherin和SNAI1表达上调(图4D)。以上结果说明,KLF5基因可以调控宫颈癌细胞的EMT过程,且有可能是通过调控SNAI1的表达来实现。
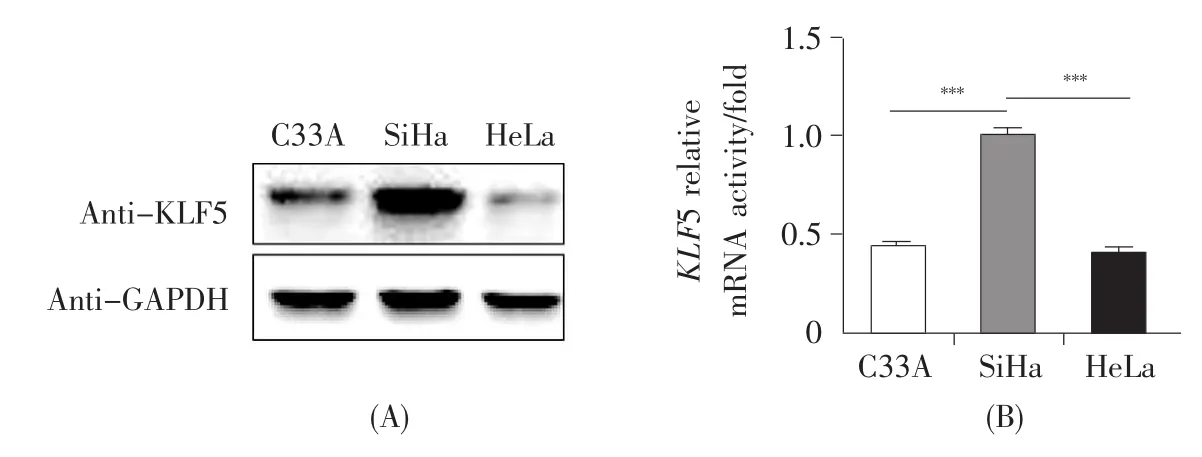
图1 三种宫颈癌细胞中KLF5基因的表达分析(A)3种宫颈癌细胞中KLF5蛋白表达水平的检测;(B)3种宫颈癌细胞中KLF5基因mRNA表达水平的检测。Fig.1 The expression of KLF5 gene in three cervical cancer cell lines(A)The expression of KLF5 protein in three cervical cancer cell lines;(B)The expression of KLF5 mRNA in three cervical cancer cell lines.
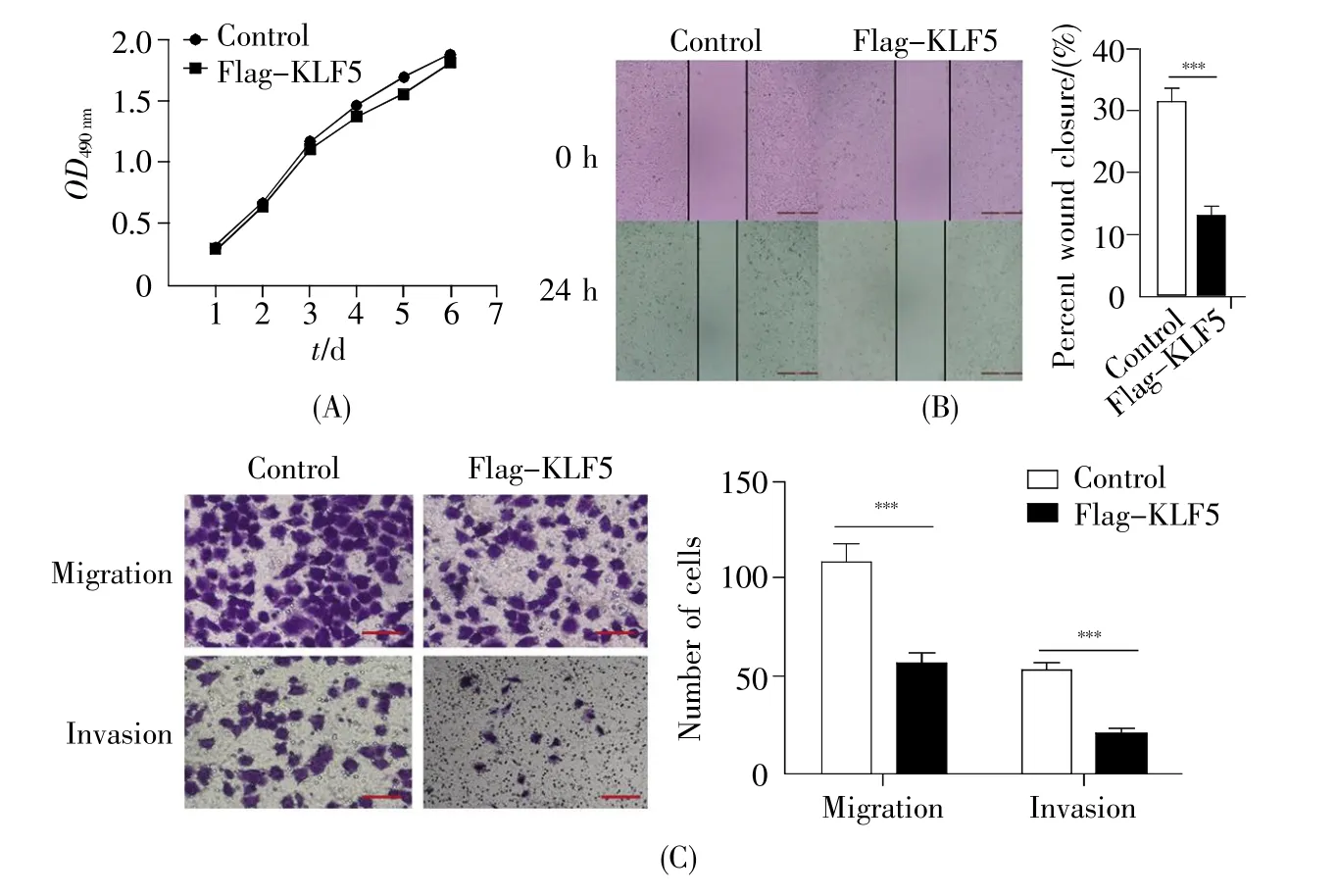
图2 KLF5基因对HeLa细胞增殖和迁移的影响(A)MTT实验检测过表达KLF5基因对HeLa细胞增殖的影响;(B)细胞划痕实验检测KLF5基因对HeLa细胞迁移能力的影响;(C)Transwell实验检测KLF5基因对HeLa细胞转移和侵袭能力的影响。Fig.2 The effects of KLF5 on proliferation and migration of HeLa cells(A)The effect of KLF5 gene on proliferation of HeLa cells detected by MTT assay;(B)The effect of KLF5 gene on migration ability of HeLa cells detected by cell scratch assay;(C)The effect of KLF5 gene on metastasis and invasion ability of HeLa cells detected by Transwell assay.
2.4 KLF5抑制SNAI1启动子的活性
为了进一步验证KLF5是否通过抑制SNAI1基因的表达来调控宫颈癌细胞的EMT过程,我们首先利用生物信息学数据库JASPAR预测KLF5结合SNAI1启动子区的位点。结果发现:SNAI1启动子区域含有多个预测的KLF5结合位点(图5A)。基于预测结果,我们构建不同片段的截短体,并在Cos7细胞中采用荧光素酶报告基因实验检测KLF5对SNAI1启动子区域的影响。荧光素酶报告基因实验结果显示:KLF5对SNAI1-Luc-1000、SNAI1-Luc-500、SNAI1-Luc-300、SNAI1-Luc-200具有显著抑制作用,抑制作用最高达到80%,但是当截短到上游100 bp后,KLF5对SNAI1启动子的抑制作用减弱,不再具有显著性差异,说明SNAI1启动子-200至-100区域含有KLF5的结合位点,KLF5可以结合到SNAI1启动子区域(-200至-100)来抑制SNAI1基因的表达(图5B)。
为了进一步检测KLF5对SNAI1-Luc-200的抑制作用,在24孔板中梯度浓度转染Flag-KLF5质粒,结果发现KLF5可以剂量依赖性地抑制SNAI1-Luc-200的表达(图5C)。这说明KLF5确实可以结合到SNAI1基因的启动子上游-200至-100区域抑制SNAI1基因的表达,并且这种抑制效应呈剂量依赖性。
2.5 过表达SNAI1对HeLa细胞EMT相关基因表达的影响
上述实验结果表明KLF5可以结合到SNAI1基因的启动子区域抑制其表达,进而影响宫颈癌细胞的EMT过程。为了验证SNAI1对宫颈癌细胞EMT过程的影响,在HeLa细胞中过表达SNAI1基因,利用real-time PCR技术检测EMT相关基因的mRNA水平。结果显示:与对照组相比,过表达SNAI1抑制了E-cadherin的表达,同时促进了N-cadherin和MMP9的表达,而且过表达SNAI1也可以促进其下游转录因子SLUG、ZEB1、ZEB2、TWIST1等mRNA水平的表达(图6)。因此,SNAI1是EMT过程的关键转录因子,KLF5对SNAI1基因的调控会影响宫颈癌细胞的EMT过程。
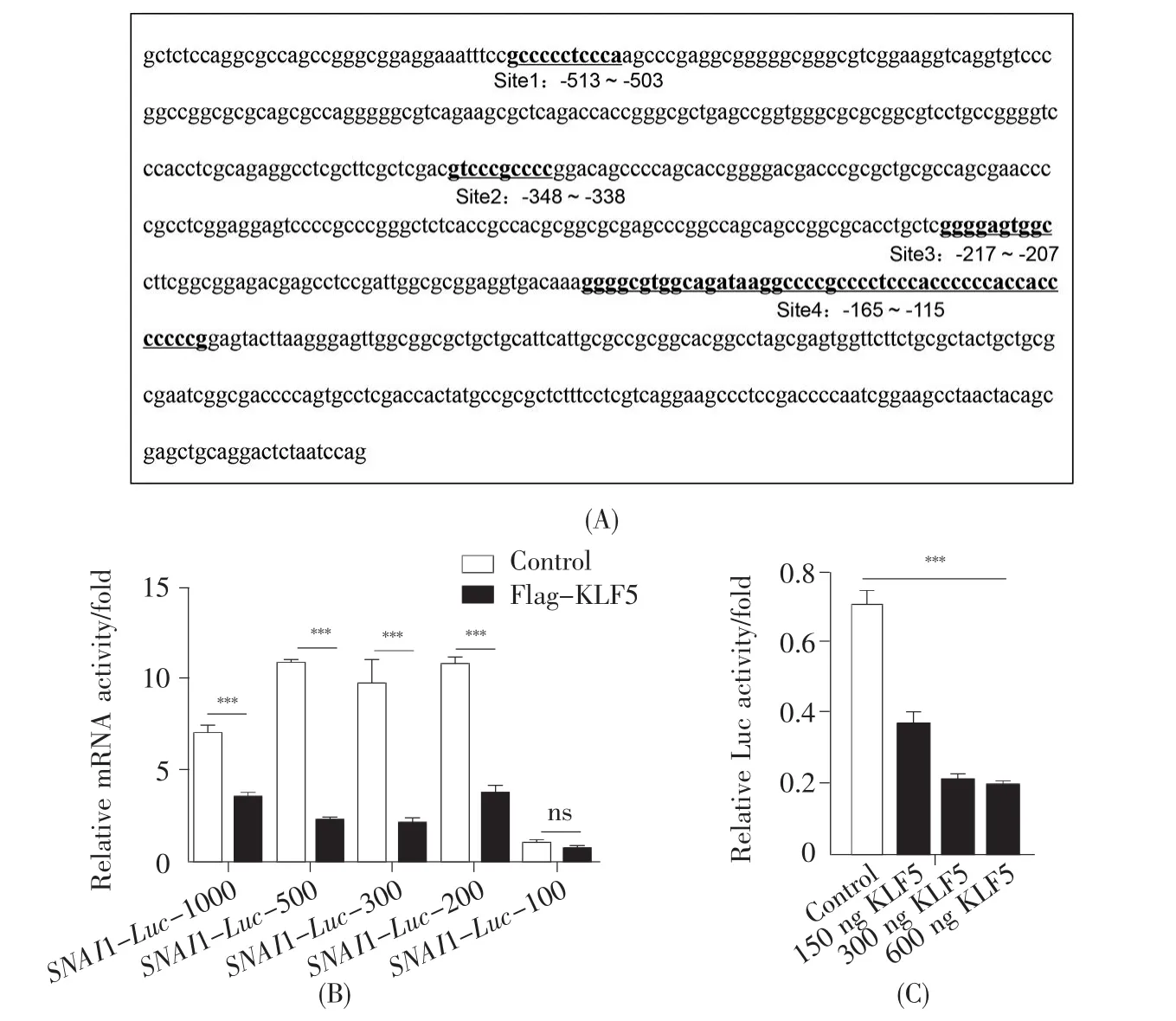
图5 KLF5对SNAI1启动子截短体活性的影响(A)JASPAR软件预测SNAI1启动子区域KLF5的结合位点;(B)荧光素酶报告基因实验检测KLF5对不同长度SNAI1启动子截短体活性的影响;(C)荧光素酶报告基因实验检测梯度转染Flag-KLF5质粒对于SNAI1-Luc-200启动子片段活性的影响。Fig.5 The effects of KLF5 on the activity of SNAI1 promoter truncation(A)The binding site of KLF5 in the SNAI1 promoter region predicted by JASPAR software;(B)The effect of KLF5 gene on the activities of different lengths of truncated SNAI1 promoters by luciferase reporter gene assay;(C)The effect of gradient transfection of the Flag-KLF5 plasmid on the activity of the SNAI1-Luc-200 promoter fragment by luciferase reporter gene assay.

图6 HeLa细胞中过表达SNAI1对EMT相关基因表达的影响(A)在HeLa细胞中检测过表达SNAI1对迁移相关基因E-cadherin、N-cadherin和MMP9转录水平的影响;(B)在HeLa细胞过表达SNAI1后,E-cadherin、N-cadherin和MMP9等迁移相关基因上游转录因子的转录水平检测结果。Fig.6 The effects of overexpressing SNAI1 gene on the expression of EMT-related genes in HeLa cells(A)The effects of overexpression of the SNAI1 gene on the transcriptional levels of the migration-related genes E-cadherin,N-cadherin and MMP9 in HeLa cells;(B)The effects of overexpression of SNAI1 gene on the transcriptional levels of upstream transcription factors of migration-related proteins such as E-cadherin,N-cadherin and MMP9 in HeLa cells.
3 讨论
据统计,我国每年因宫颈癌死亡人数大约5.3万,占女性因恶性肿瘤死亡人数的18.4%,可见宫颈癌是危害我国女性健康与生命的重要疾病[12],因此,研究宫颈癌的发生发展对于预防和治疗这种恶性疾病具有积极的意义。
KLF5在多种肿瘤类型中异常表达[13~17]。Marrero-Rodríguez等[10]的研究结果显示 KLF5 的表达随宫颈病变恶性程度逐渐升高,且在宫颈癌的发生发展过程中可能作为一个独立的影响因素。本研究发现KLF5在调控宫颈癌转移方面具有重要作用,在以宫颈癌HeLa细胞为研究对象的实验中,过表达KLF5可抑制HeLa细胞的迁移和侵袭能力(图2B,C)。在癌症的发生发展过程中,上皮细胞会经历EMT过程,期间细胞的极性和细胞间黏附作用消失,运动能力增强。伴随着细胞的形态变化,EMT指示性分子E-cadherin等表达降低,N-cadherin、波形蛋白、基质金属蛋白酶等表达增多,细胞的迁移和侵袭能力增强。有研究显示,KLF5可以作为TGF-β通路的一个辅助因子,参与调控癌症的EMT过程[18]。此外,E-cadherin、N-cadherin和基质金属蛋白酶等的上游转录因子,如 SNAI1、SLUG、ZEB1、ZEB2、TWIST1 等,也是TGF-β通路调节的重要分子[19]。我们的研究结果显示,在宫颈癌HeLa细胞中过表达KLF5后,SNAI1、SLUG等转录因子mRNA水平和蛋白质水平的表达均下降(图3C,D)。对比研究发现,在KLF5高表达的SiHa细胞中沉默KLF5基因后,SNAI1、SLUG等基因表达上调(图4C,D)。这些结果说明KLF5可以通过TGF-β信号通路调控宫颈癌细胞的EMT过程。在上述转录因子中,SNAI1被认为是调节各种癌症EMT过程的主要转录因子[20],可以调控ZEB1、ZEB2等的表达;同时,SNAI1可以与E-cadherin启动子结合,增强波形蛋白和MMP9的表达水平,并最终促进EMT[21]。因此,我们推测KLF5通过抑制SNAI1的表达来抑制EMT过程。
KLF5是一种基本的转录因子,通过3个锌指结构域与富含GC的DNA序列(如Sp1位点、GC盒、CACCC盒等)结合来调节其转录[22]。JASPAR数据库可以预测真核生物转录因子的结合位点。本研究利用该数据库预测了KLF5结合SNAI1基因启动子的多个结合位点(图5A)。为了研究KLF5发挥作用的结合位点,我们构建了含有不同结合位点的启动子截短体质粒。荧光素酶报告基因实验结果显示,KLF5可以结合到SNAI1启动子的-200至-100区域来抑制SNAI1基因的表达(图5B)。综合上述信息,KLF5很可能是通过结合到SNAI1的启动子区域抑制SNAI1基因的转录活性,进而抑制宫颈癌HeLa细胞的EMT过程。SNAI1诱导EMT过程中,除可直接下调E-cadherin蛋白的表达外,可以上调N-cadherin、波形蛋白、基质金属蛋白酶、TWIST、ZEB1和ZEB2等蛋白质的表达水平[21]。为了进一步验证KLF5是否通过调控SNAI1介导的EMT通路来影响宫颈癌细胞的侵袭和迁移,在HeLa细胞中过表达SNAI1基因,real-time PCR实验结果证实过表达SNAI1可以下调E-cadherin基因的表达,同时增强了 N-cadherin、MMP9、SLUG、TWIST、ZEB1/2 基因的表达(图 6)。
因此,本研究发现KLF5可能通过抑制SNAI1基因的表达来参与宫颈癌HeLa细胞的EMT过程,进而抑制宫颈癌细胞的迁移和侵袭。但是,KLF5调控SNAI1的表达是否还有其他基因或者通路的参与有待进一步研究。
