芒柄花黄素对人增生性瘢痕成纤维细胞生长的作用
2019-06-14林时秀郭冰玉徐志山
回 蔷,林时秀,郭冰玉,常 鹏,徐志山,陶 凯
0 引言
增生性瘢痕通常继发于烧伤、创伤及手术后,表现为局部组织僵硬、发红、瘙痒和隆起于皮肤表面,好发于颏部、耳部、双上臂及胸前区等部位,严重时可发生挛缩,造成关节畸形和器官移位,不仅影响美观,还会给患者的日常生活带来困扰[1]。成纤维细胞过度增殖、以胶原为主的细胞外基质成分异常沉积是增生性瘢痕形成的机制之一,因此,对成纤维细胞作用的研究成为治疗增生性瘢痕的关键[2]。
芒柄花黄素又名刺芒柄花素、芒柄花素,是从豆科植物红车轴草的花序及带花枝叶或刺芒柄花全草中提取的异黄酮类成分之一。越来越多的研究表明,芒柄花黄素具有抗氧化、抗肿瘤和抗炎等多种药理作用[3]。有文献报道,芒柄花黄素能够抑制细胞增殖,诱导细胞凋亡[4],因此,推断芒柄花黄素对增生性瘢痕也具有一定的治疗作用。
本研究初步探讨了芒柄花黄素对人增生性瘢痕成纤维细胞增殖与凋亡的作用,并对细胞周期蛋白与抗凋亡蛋白的变化进行了分析,旨在为增生性瘢痕的预防与临床治疗奠定理论基础。
1 材料与方法
DMEM、胎牛血清、胰蛋白酶(北京索莱宝科技有限公司),Annexin V-FITC、PI、NP-40裂解液(上海碧云天生物技术有限公司),二甲基亚砜(国药集团化学试剂有限公司),芒柄花黄素(美国Selleck生物科技有限公司),细胞周期检测试剂、总RNA提取试剂盒、反转录试剂盒、SYBR试剂盒(宝生物工程大连有限公司),Cyclin D1抗体、Bcl-2抗体和GAPDH抗体(艾博抗上海贸易有限公司)。
2 方法
2.1 细胞提取与培养 随机选取2017年3-8月于我院整形外科就诊的8位患者,手术切除创伤愈合后的增生性瘢痕组织,留取局部皮瓣转移修复后剩余的正常皮肤,提取成纤维细胞后进行培养。将切取的新鲜增生性瘢痕组织与正常皮肤的真皮层置于5 ml 0.25%的胰蛋白酶溶液中,4 ℃冷消化过夜。加入适量含10%胎牛血清的DMEM,置于37 ℃ 5% CO2饱和湿度的孵箱中进行培养。
2.2 MTT试验 选取对数生长期的成纤维细胞,胰蛋白酶消化后进行离心,重新制成单细胞悬液。以1×103/孔的密度将成纤维细胞接种于96孔板中,12 h后加入二甲基亚砜(DMSO)、10 μmol/L和20 μmol/L的芒柄花黄素处理细胞,每组3个复孔。避光条件下,分别于第0、12、24、36、48小时在每孔中加入5 mg/ml的MTT,37 ℃孵箱中孵育4 h。用1 ml无菌注射器吸去上清液,分别加入100 μl DMSO溶解形成的MTT-甲臜结晶,使用酶标仪测量490 nm处的吸光值。
2.3 流式细胞检测 以1×106/L的浓度将细胞接种于6孔板中,待细胞贴壁后分别加入DMSO,10、20 μmol/L的芒柄花黄素处理细胞24 h。胰蛋白酶消化后制成单细胞悬液,加入预冷的70%乙醇固定过夜。以800 r/min的速度离心5 min,弃上清,PBS洗涤细胞。在每管细胞中加入500 μl染色缓冲液,充分缓慢混匀,制成单细胞悬液。加入25 μl碘化丙啶(PI)染色液并充分混匀,再加入10 μl Rnase,37 ℃条件下避光染色30 min,进行流式检测。
2.4 AV-PI染色 分别以DMSO及10、20 μmol/L的芒柄花黄素处理细胞24 h,胰蛋白酶消化后离心5 min,收集下层的细胞沉淀,PBS洗涤后制成单细胞悬液。在每管细胞中加入500 μl的Binding Buffer进行重悬,依次加入5 μl Annexin V-FITC和5 μl PI。轻轻混匀细胞,室温下避光孵育15 min,流式细胞仪进行分析。
2.5 Hoechest 33258染色 分别用DMSO及10、20 μmol/L的芒柄花黄素处理细胞24 h,依次在每孔中加入100 μl Hoechest 33258染色液,室温条件下孵育15 min,荧光显微镜下观察细胞的染色情况。
2.6 Western blot试验 以DMSO及10、20 μmol/L的芒柄花黄素处理细胞24 h,NP-40裂解液裂解细胞,制备细胞裂解液。分别取30 μg蛋白进行SDS-PAGE电泳,电转移至PVDF膜后置于5%的脱脂奶粉中,室温封闭1 h。加入一抗Cyclin D1、Bcl-2和GAPDH,4 ℃条件下孵育过夜。洗膜,加入二抗室温孵育1 h。采用ECL发光法检测蛋白的表达情况。
2.7 RT-PCR试验 应用DMSO及10、20 μmol/L的芒柄花黄素处理细胞24 h,按照试剂盒说明书的操作步骤提取细胞总RNA,反转录成cDNA后进行RT-PCR反应,共进行40个循环。计算相对于GAPDH水平的基因表达水平,合成的引物序列为Cyclin D1,F(5′-3′):CCGAGGAGCTGCTGCAAATGGAGC,R(5′-3′):TGAAATCGTGCGGGGTCATTGCGGC;Bcl-2,F(5′-3′):GGTGAACTGGGGGAGGATTG,R(5′-3′) GGCAGGCATGTTGACTTCAC;GAPDH,F(5′-3′):AGAAGGCTGGGGCTCATTTG,R(5′-3′):AGGGGCCATCCACAGTCTTC。
3 结果
3.1 不同浓度芒柄花黄素对正常皮肤与增生性瘢痕成纤维细胞的作用 分别加入10、20 μmol/L的芒柄花黄素处理24 h,其对正常皮肤组织成纤维细胞的增殖影响较小,与对照组比较,差异无统计学意义,见图1A。而增生性瘢痕成纤维细胞的增殖均受到明显抑制,且药物浓度越高、作用时间越长,抑制作用越明显,与对照组比较,差异有统计学意义,见图1B。
3.2 不同浓度芒柄花黄素对人增生性瘢痕成纤维细胞周期的影响 通过流式细胞技术检测发现,经芒柄花黄素处理的成纤维细胞大部分阻滞于G1期,进入S期的细胞减少,细胞周期的进程受到阻断。细胞增殖受抑制程度与药物的浓度呈正比,与对照组比较,差异有统计学意义(P<0.05),见图2。
3.3 不同浓度芒柄花黄素对人增生性瘢痕成纤维细胞凋亡的影响 Annexin V-FITC/PI双染色法显示,芒柄花黄素作用后,成纤维细胞的早期凋亡率有所增加,并且随着药物浓度的递增,促凋亡作用愈加明显(P<0.05),见表1。在荧光显微镜下观察Hoechest 33258染色后的细胞凋亡情况,与对照组比较,经芒柄花黄素处理的成纤维细胞凋亡率有所增加,当浓度为20 μmol/L时,细胞凋亡最显著,见图3。

图1 不同浓度芒柄花黄素对正常皮肤(A)与增生性瘢痕(B)成纤维细胞的作用
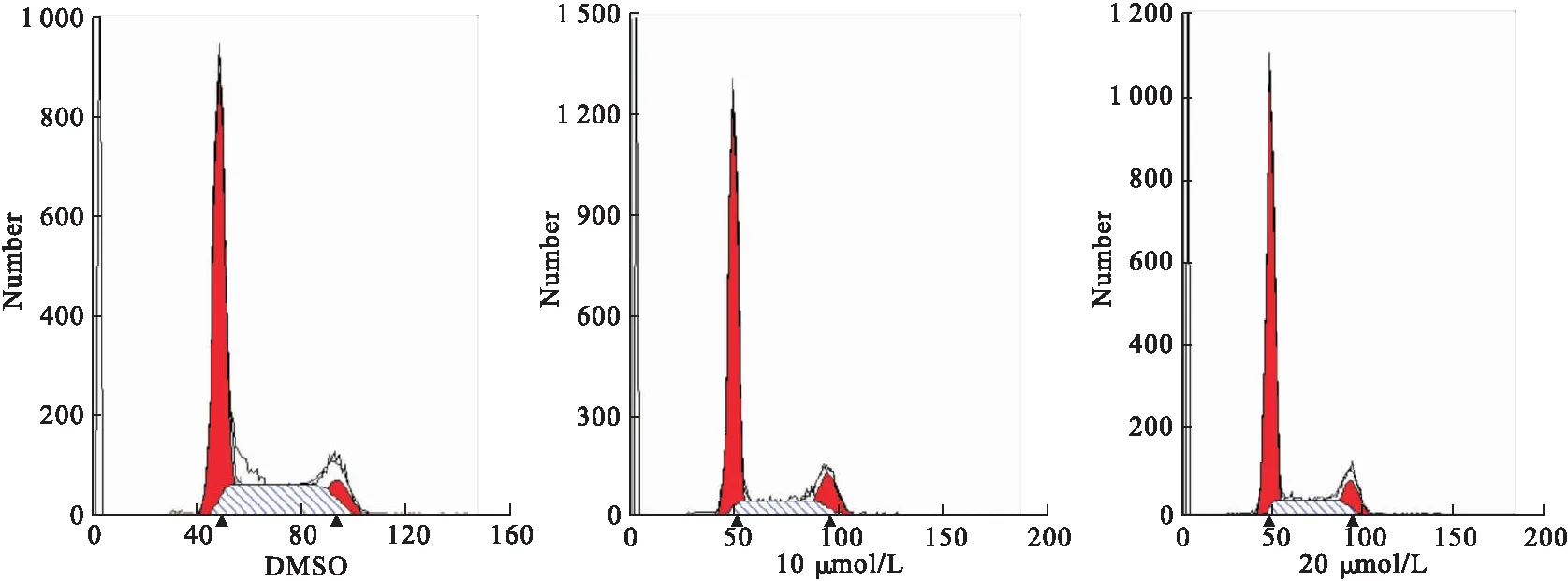
图2 不同浓度芒柄花黄素对成纤维细胞周期的影响

表1 不同浓度芒柄花黄素对成纤维细胞凋亡的影响
注:UL:坏死细胞,UR:晚期凋亡,LL:正常细胞,LR:早期凋亡。*与DMSO组比较,P<0.05;#与10 μmol/L组比较,P<0.05

图3 不同浓度芒柄花黄素对成纤维细胞凋亡的影响
3.4 芒柄花黄素对成纤维细胞增殖相关蛋白的影响 芒柄花黄素对Cyclin D1具有一定程度的抑制作用,且药物浓度越高,抑制作用越强,见图4。RT-PCR实验结果显示,与对照组比较,芒柄花黄素能够在RNA水平上下调Cyclin D1的表达,随着药物浓度的升高,Cyclin D1 mRNA的表达水平逐渐下降,见图5。

图4 芒柄花黄素对成纤维细胞Cyclin D1的影响
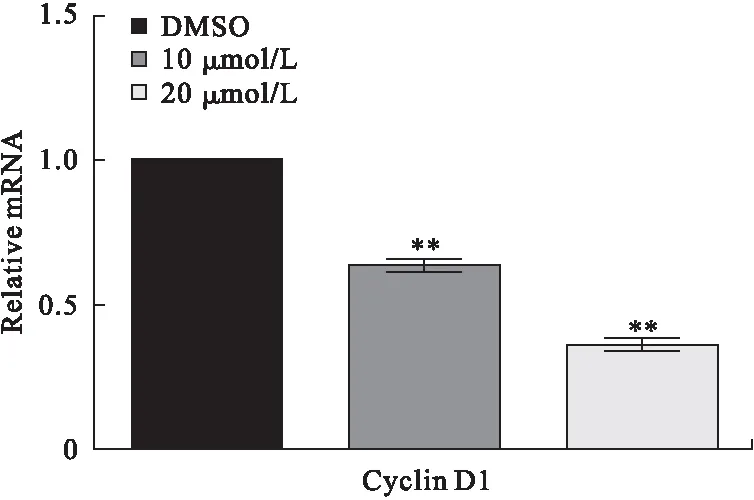
图5 芒柄花黄素对成纤维细胞Cyclin D1 mRNA表达的影响
3.5 芒柄花黄素对成纤维细胞凋亡相关蛋白的影响 通过Western blot和RT-PCR实验发现,与对照组比较,不同浓度的芒柄花黄素对细胞凋亡相关蛋白Bcl-2均有影响,能够有效抑制凋亡相关蛋白Bcl-2的表达。处理细胞的药物浓度越高,其对Bcl-2的抑制作用越明显(P<0.05),见图6、图7。

图6 芒柄花黄素对成纤维细胞Bcl-2的影响
4 讨论
增生性瘢痕是成纤维细胞对组织损伤应答而形成的细胞外基质过量沉积的一种纤维化疾病,主要特征是真皮层成纤维细胞过度增殖与活化、细胞外基质蛋白代谢紊乱[5]。增生性瘢痕突出于皮肤表面,形状不规则、质韧,伴有瘙痒感甚至灼痛感,对患者的外观和骨骼肌功能造成了不利影响[6]。成纤维细胞是增生性瘢痕形成的重要效应细胞之一,因此,抑制成纤维细胞的增殖、促进其凋亡是治疗增生性瘢痕的关键。

图7 芒柄花黄素对成纤维细胞Bcl-2 mRNA表达的影响
芒柄花黄素是一种具有生物活性的非甾体多酚,广泛存在于多种植物中,具有类雌二醇分子结构,是一种有效的植物雌激素[7]。诸多文献报道,芒柄花黄素能够抑制肿瘤细胞的增殖、促进其凋亡[8]。Wang等[9]的研究发现,芒柄花黄素能够通过microRNA 149介导的EphB3下调和抑制PI3K/AKT与STAT3信号通路来抑制结肠癌细胞的生长和侵袭。Zhang等[10]通过体外实验证实,芒柄花黄素作用于卵巢癌细胞后,凋亡相关蛋白caspase 3/9表达与Bax/Bcl-2的比率呈剂量依赖性增加,表明芒柄花黄素能够通过诱导凋亡来抑制卵巢癌细胞的增殖。增生性瘢痕是创伤后组织修复的异常结局,组织学特点是成纤维细胞大量增殖,临床表现为瘤样增生[11]。因此,我们推断芒柄花黄素对增生性瘢痕也具有一定的抑制作用。
在本研究中,MTT试验结果显示,芒柄花黄素对正常皮肤成纤维细胞的增殖影响较小,对增生性瘢痕成纤维细胞的增殖具有一定的抑制作用,且药物浓度越高、作用时间越长,抑制作用越明显。通过流式细胞技术检测发现,经芒柄花黄素处理的成纤维细胞大多数阻滞于G1期,S期细胞的百分比显著下降,表明芒柄花黄素可能通过调节细胞周期来实现对细胞增殖的抑制作用。Cyclin D1是重要的细胞周期调节蛋白,调控细胞周期由G1期向S期转化[12]。我们通过Western blot与RT-PCR对Cyclin D1蛋白水平及其mRNA的表达水平进行了检测,与对照组比较,人增生性瘢痕成纤维细胞经芒柄花黄素处理24 h后,Cyclin D1的蛋白水平及其mRNA表达水平显著下降。Annexin-V-FITC/PI与Hoechest 33258染色法显示,芒柄花黄素呈剂量依赖的形式诱导成纤维细胞的凋亡,当浓度为20 μmol/L时,细胞的凋亡率最高。Bcl-2蛋白家族在细胞凋亡的线粒体通路中起着关键作用,Bcl-2是细胞凋亡的重要抑制因子之一[13]。Western blot检测显示,不同浓度的芒柄花黄素对Bcl-2表达均有抑制作用,且浓度越高,抑制作用越强。RT-PCR进一步验证了芒柄花黄素能够通过调节mRNA的表达水平来调控Bcl-2的蛋白表达。
综上所述,芒柄花黄素通过抑制Cyclin D1表达影响人增生性瘢痕成纤维细胞的细胞周期进程,使细胞周期阻滞于G1/S期,通过下调Bcl-2的表达诱导细胞凋亡,可考虑用于增生性瘢痕的预防和临床治疗。
