MAD1基因在主动脉夹层中的表达及对主动脉平滑肌细胞的影响
2019-06-14
(1.中国医学科学院阜外医院胸心外科,北京 100037;2.中国医学科学院阜外医院 北京协和医学院 国家心血管病中心 心血管疾病国家重点实验室 心脏外科,北京100037)
主动脉夹层指主动脉腔内的血液从主动脉内膜撕裂处进入主动脉中膜,形成的真假两腔分离状态[1],是一种起病迅速、死亡率高的大血管疾病[2];若未得到及时有效治疗,死亡率至发病起以每小时2%~5%递增[3]。虽然近年来临床对主动脉夹层的诊治水平有了明显提升,但围手术期患者死亡率仍超过20%[4]。目前对主动脉夹层的发病机制仍未完全明确,阐明发病机制对改良治疗方案,提升患者预后水平具有重要意义。研究者发现,主动脉中膜在维持主动脉生理结构和功能中发挥决定作用,血管平滑肌细胞是主动脉中膜最主要的组成成分[5]。亦有研究显示,主动脉夹层发生、发展中存在明显的主动脉中膜血管平滑肌细胞丢失,被认为与血管平滑肌细胞增殖、凋亡功能异常有关[6],但分子机制仍未阐明。有丝分裂阻滞缺陷蛋白(Mitotic arrest deficient protein,MAD)和MAX作用蛋白(Max interacting protein,MAX),均属于原癌基因Myc family oncogene(MYC家族)[7];相关研究显示,MAX高表达可明显抑制主动脉平滑肌细胞生长,促进凋亡,参与主动脉夹层的发生、发展[8]。但关于MAD表达与主动脉平滑肌细胞的关系及在主动脉夹层发病中的作用仍未见研究报道。MAD各亚型中以MAD1研究最为广泛,已有报道证实,MAD1基因在白血病、乳腺癌、鼻咽癌等多种恶性肿瘤中发挥调控作用[9-10]。本研究收集了Stanford A型主动脉夹层患者的升主动脉病变组织中膜标本,检测MAD1基因表达水平;并通过腺病毒载体转染技术在体外建立MAD1基因高表达人主动脉血管平滑肌细胞模型,检测细胞增殖、凋亡情况以及凋亡相关蛋白的表达水平。
1 材料与方法
1.1 研究对象
选取2017年3月至2018年6月间在本院行手术治疗的主动脉夹层患者30例。入选标准:①经CT、MRI、超声检查并结合临床症状确诊为Stanford A型主动脉夹层患者;②发病到住院时间≤14天。排除标准:①Stanford B型或慢性主动脉夹层患者;②马凡氏综合征、主动脉瓣二叶瓣化畸形的患者。其中男性22例,女性8例;年龄28~68岁,平均年龄(46.30±12.75)岁。收集术中切除的升主动脉病变组织,保留富含血管平滑肌的中膜组织标本为主动脉夹层组。收集同期在本院行尸检,且无手术史、无大血管病变史的升主动脉壁内组织标本18份为对照组,其中男性10例,女性8例;年龄30~65岁,平均年龄(46.15±6.90)岁。两组性别、年龄之间差异无统计学意义(P>0.05)。本研究经本院伦理委员会审核通过,受试者家属签署知情同意书。
1.2 材料与主要试剂
人主动脉血管平滑肌细胞(HA-VSMC)购于上海沪震生物科技有限公司;腺病毒载体AdEasy系统由北京安必奇生物科技有限公司设计合成;CCK8试剂盒、Annexin V细胞凋亡检测试剂盒购于上海钰博生物科技有限公司;兔抗人MAD1多克隆抗体,鼠抗人含半胱氨酸的天冬氨酸蛋白水解酶(csyteine aspartic acic specific protease,Caspase)Caspase-3、Caspase-8、Caspase-9单克隆抗体均购于北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 细胞培养与转染 HA-VSMC细胞放入含10%胎牛血清的DMEM培养基中,37 ℃ 5%CO2的细胞培养箱中培养并传代,传至5~6代时取对数生长细胞用于后续实验。使用腺病毒载体AdEasy系统过表达MAD1,分为空白对照组、空载体转染组、MAD1过表达组;转染48h后通过RT-PCR和Western blot验证各组细胞中MAD1 mRNA和蛋白表达情况。
1.3.2 细胞增殖和凋亡实验 使用CCK8试剂盒检测细胞增殖能力,按5 000个/孔的密度将细胞接种于96孔板中,常规培养12 h后分别以重组腺病毒AdEasy-MAD1和空载体转染细胞,同时设置空白对照组,分别于转染前,转染后24 h、48 h、72 h,每孔滴加10 μL CCK8溶液,继续培养1h后,酶标仪读取490 nm处吸光度值。细胞凋亡实验:细胞转染48 h后,使用Annexin V细胞凋亡检测试剂盒进行测定,操作按试剂盒说明进行。
1.3.3 RT-PCR检测 Trizol法提取主动脉组织和HA-VSMC细胞中的总RNA,反转录得到cDNA。引物合成由上海捷瑞生物工程有限公司完成,MAD1引物序列:上游5′-CCAACGAGAAGCAGCGAGAG-3′,下游5′-GTGAGGTTCCTCTCTTCCGT-3′;Caspase-3引物序列:上游5′-CAGTTAGGACAGGCACAGGC-3′,下游5′-GCTTGCTCTGAGACCGTACG-3′;Caspase-8引物序列:上游5′-GGACAGCCGAAGACGATA-3′,下游5′-GTAACGACCAGAGTGACC-3′。Caspase-9引物序列:上游5′-CCACTAT CTAACCAGGTTAAC-3′,下游5′-TGTTCAGTAATAATGGGAGTG-3′。反应体系30 μL,反应条件:94 ℃ 2 min,94 ℃ 30 s,52 ℃ 30 s,共40个循环,延伸72 ℃ 1 min。行2%琼脂糖凝胶电泳,以GAPDH为内参,计算MAD1、Caspase-3、Caspase-8 、Caspase-9 mRNA的相对表达量。
1.3.4 Western blot检测 对Caspase-3、Caspase-8、Caspase-9 从前提转变为cleaved Caspase-3、Caspase-8、Caspase-9 的蛋白表达水平进行检测,RIPA提取主动脉组织和HA-VSMC细胞中总蛋白,BCA法蛋白定量。蛋白样品行10%聚丙烯酰胺凝胶电泳,湿法转膜至PVDF,5%脱脂奶粉室温下封闭1 h,滴加兔抗人MAD1多克隆抗体(1∶200),鼠抗人Caspase-3、Caspase-8、Caspase-9单克隆抗体(1∶500),4 ℃过夜,滴加HRP标记羊抗兔IgG、羊抗鼠IgG(1∶1 000),室温反应2 h,ECL显色,避光显影,以GAPDH为内参对照计算各条带灰度值。
1.4 统计学分析
使用SPSS18.0软件分析,以均数±标准差表示,多组间进行F检验,两组间进行t检验,以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结 果
2.1 主动脉夹层中MAD1 mRNA和蛋白表达分析
RT-PCR检测显示,主动脉夹层组患者主动脉夹层中MAD1 mRNA相对表达量明显高于对照组(P<0.05);Western blot检测显示,主动脉夹层组患者主动脉夹层中MAD1蛋白相对表达量明显高于对照组。见图1,表1。

图1 主动脉夹层中MAD1蛋白表达的Western blot电泳图注:1~2为对照组;3~4为主动脉夹层组

表1 两组主动脉夹层中MAD1 mRNA和蛋白表达分析
2.2 过表达MAD1的细胞系构建与验证
转染48 h后,空白对照组、空载体转染组、MAD1过表达组MAD1mRNA相对表达量分别为1.42±0.11、1.50±0.18、8.05±0.73;MAD1蛋白相对表达量分别为1.07±0.09、1.12±0.14、7.63±0.59。MAD1过表达组MAD1mRNA和蛋白相对表达量均明显高于空白对照组、空载体转染组,差异有统计学意义(P<0.05);证明已成功构建过表达MAD1的HA-VSMC。
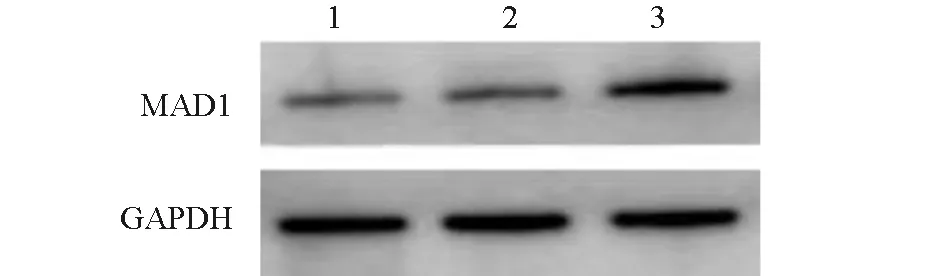
图2 各组MAD1蛋白的Western blot电泳图1:空白对照组;2:空载体转染组;3:MAD1过表达组
2.3 各组细胞增殖情况
转染前各组细胞增殖情况之间差异无统计学意义(P>0.05);随着转染时间的延长,各组细胞增殖水平均逐渐增加,转染48 h、72 h后MAD1过表达组细胞增殖明显低于空白对照组、空载体转染组(P<0.01);空白对照组与空载体转染组细胞增殖之间差异无统计学意义(P>0.05)。见表2。
表2 各组细胞增殖情况分析(OD值)
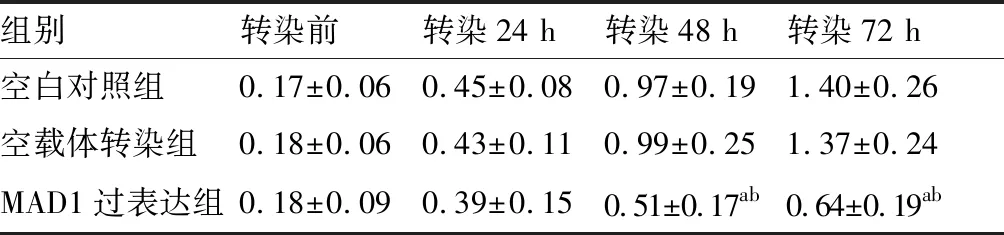
组别转染前转染24 h转染48 h转染72 h空白对照组0.17±0.060.45±0.080.97±0.191.40±0.26空载体转染组0.18±0.060.43±0.110.99±0.251.37±0.24MAD1过表达组0.18±0.090.39±0.150.51±0.17ab0.64±0.19ab
与空白对照组比较,aP<0.05;与空载体转染组比较,bP<0.05
2.4 各组细胞凋亡情况分析
转染48 h后,空白对照组、空载体转染组、MAD1过表达组细胞凋亡率分别为:(5.31±0.86)%、(5.40±0.93)%、(17.65±2.50)%。MAD1过表达组细胞凋亡率明显高于空白对照组、空载体转染组,差异有统计学意义(P<0.01);空白对照组与空载体转染组细胞凋亡率之间差异无统计学意义(P>0.05)。见图3。
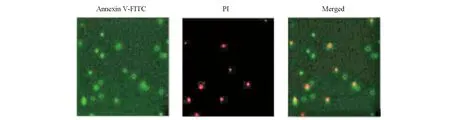
图3 Annexin V细胞凋亡检测(400×)
2.5 各组Caspase-3、Caspase-8、Caspase-9 mRNA表达水平比较
MAD1过表达组Caspase-3、Caspase-8、Caspase-9 mRNA相对表达量明显高于空白对照组、空载体转染组,差异有统计学意义(P<0.05);空白对照组与空载体转染组Caspase-3、Caspase-8、Caspase-9 mRNA相对表达量差异无统计学意义(P>0.05)。见表3。

表3 各组Caspase-3、Caspase-8、Caspase-9 mRNA相对表达量比较
与空白对照组比较,aP<0.05;与空载体转染组比较,bP<0.05
2.6 各组Caspase-3、Caspase-8、Caspase-9蛋白表达水平比较
MAD1过表达组Caspase-3、Caspase-8、Caspase-9蛋白相对表达量明显高于空白对照组、空载体转染组(P<0.05);空白对照组与空载体转染组Caspase-3、Caspase-8、Caspase-9蛋白相对表达量差异无统计学意义(P>0.05)。见表4、图4。
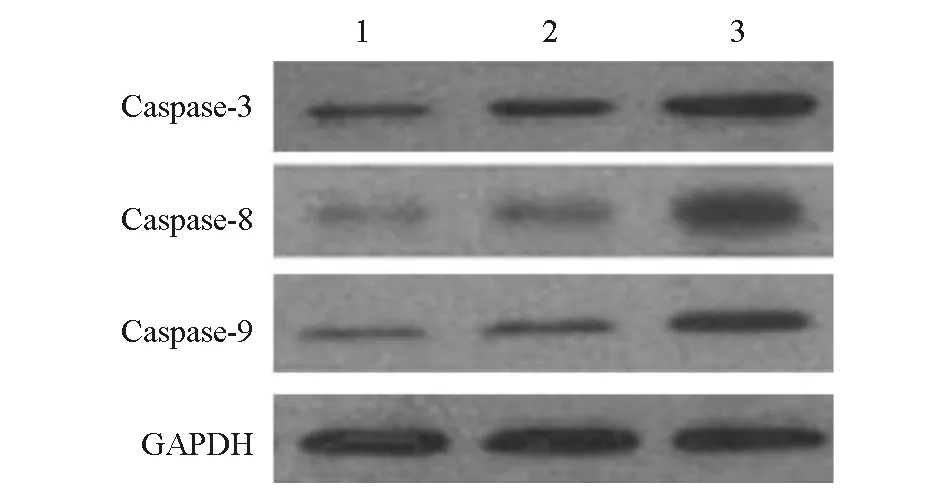
图4 各组细胞凋亡相关蛋白的Western blot电泳图1:空白对照组;2:空载体转染组;3:MAD1过表达组

表4 各组Caspase-3、Caspase-8、Caspase-9蛋白相对表达量比较
与空白对照组比较,aP<0.05;与空载体转染组比较,bP<0.05
3 讨 论
随着近年来我国人口老龄化和高血压患者的增加,主动脉夹层的发病率明显提升,而且已成为严重威胁居民生命安全的危重症之一[11]。主动脉夹层可累及体内多个系统,表现复杂多样,常表现为高血压、胸痛、主动脉瓣关闭不全等[12]。主动脉夹层发病机制目前仍未完全明确,研究者认为,主动脉内膜、中膜和外膜结构和功能的改变可能在主动脉夹层发生发展中发挥重要作用,其中主动脉中膜在维持主动脉壁生理结构和功能的首要因素,平滑肌细胞丢失、凋亡、数量下降等导致的主动脉中膜重构是主动脉夹层发生的病理基础[13]。MAD和MAX可通过与自身或MYC家族其他成员形成同源二聚体或异源二聚体,在细胞生长和凋亡中发挥调控作用[14]。已有研究证实,MAX表达上调可抑制主动脉平滑肌细胞生长,促进细胞凋亡。目前研究发现,MAD1基因在白血病、乳腺癌、鼻咽癌等多种癌症的发生、发展过程中发挥调控作用;但在主动脉夹层发病过程中的作用仍未见相关研究报道。
Stanford A型主动脉夹层是一种急需手术治疗的致命性疾病,是主动脉夹层中致死率最高的类型[15]。本研究以在本院行手术治疗的Stanford A型主动脉夹层患者为研究对象,收集术中切除的升主动脉病变组织中膜部分为研究标本。研究结果显示,Stanford A型主动脉夹层患者升主动脉病变组织中膜部分组织中MAD1 mRNA和蛋白表达水平明显高于正常升主动脉壁内组织。提示MAD1高表达可能在主动脉夹层发生发展中发挥调控作用。进一步在体外建立MAD1基因过表达人主动脉血管平滑肌细胞模型,检测细胞增殖和凋亡情况发现,MAD1基因过表达可明显抑制HA-VSMC细胞增殖,促进细胞凋亡,加重主动脉夹层病情。
Caspase家族是一组存在于细胞质溶胶中的半胱氨酸蛋白酶,目前已确定至少11种亚型,在细胞凋亡信号传导中发挥重要作用,是细胞凋亡的执行者[16]。研究者发现,Caspase级联反应是细胞凋亡的主要原因,其中Caspase-3、Caspase-8、Caspase-9作用最明显[17];Caspase-3位于级联反应下游,直接诱导细胞凋亡[18]。细胞凋亡的胞外途径中,凋亡信号传导分子与Caspase-8特异性结合,活化后的Caspase-8与Caspase-3相互作用,激活Caspase-3,诱导细胞凋亡[19];细胞内途径中,凋亡信号因子与相关蛋白酶形成复合物,之后与细胞质中Caspase-9前体结合,激活Caspase-9,进而活化下游Caspase-3,诱导细胞凋亡[20]。本研究中,MAD1过表达组Caspase-3、Caspase-8、Caspase-9表达水平较空白对照组与空载体转染组明显增加,提示MAD1过表达促进HA-VSMC细胞凋亡可能通过激活细胞外凋亡途径和细胞内凋亡途径来实现的。
