2016年莱州湾扇贝养殖区浮游植物群落生态特征❋
2019-06-14杨俊丽李希磊崔龙波
杨俊丽, 李希磊, 于 潇, 崔龙波
(烟台大学生命科学学院, 山东 烟台264005)
浮游植物是海洋生态系统中最重要的初级生产者,一方面浮游植物的光合作用为海洋提供了95%左右的生产力[1];另一方面为鱼、虾和扇贝等海洋生物提供饵料,其生长和代谢过程中释放的溶解有机物也为细菌等提供了营养资源[2],因此,浮游植物群落结构间接或直接地影响着海洋生态系统的物质循环和能量流动。此外,浮游植物群落结构和种类的改变也受到海洋生态环境的影响,能够在一定程度上反应海洋生态环境的状况[3]。因此,对浮游植物群落结构的研究也是海洋生态研究的重要内容。
莱州湾是渤海三大海湾之一,位于山东半岛北部,是鱼、虾、蟹以及贝类等经济生物的主要繁育场,也是山东省重要的养殖渔业基地。近年来,对莱州湾浮游植物的研究已经有诸多报道[4-9],但对莱州湾养殖区浮游植物群落变化及月份变化却鲜有报道,且多采用网采的方法,难免会漏掉部分个体小于76 μm的物种。本实验采用有机玻璃采水器采集扇贝养殖区表层和底层的水样,采取逐步浓缩的方法,避免了以往网采样品的弊端,更加系统地对养殖区内浮游植物的群落组成、数量变化以及多样性做出了分析,希望为莱州湾海域浮游植物群落和生态环境的变化提供背景资料,并为莱州湾渔业资源评估和管理以及合理的养殖开发提供科学依据。
1 材料与方法
1.1 采样时间与站位设置
于2016年4—11月每月中旬进行采样,根据莱州湾扇贝养殖区的分布状况,选取了8个海湾扇贝养殖区,分别命名为L1~L8,具体位置见图1。每个养殖区设置4个平行采样点,最后取其平均值记录实验结果。
1.2 浮游植物的采集与处理
于2016年4—11月每月中旬在上述站位水域用有机玻璃采水器进行采样,每个采样点采集表层和底层混合等量水样1 L,加入15 mL 10%的鲁哥氏液,带回实验室,静置24~48 h后浓缩至20~40 mL,暂储存于50 mL磨口玻璃瓶中,观察时将样品摇匀,取0.1 mL滴于浮游植物计数板上,然后在显微镜下观察鉴定,并记录样品中浮游植物的种类与数量[10]。
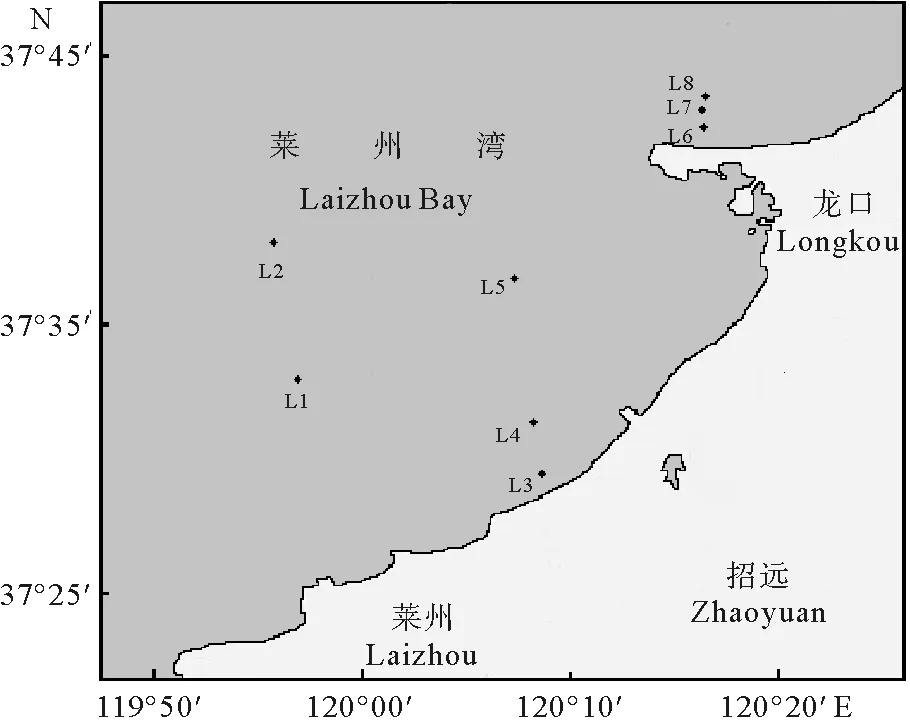
图1 莱州湾海域扇贝养殖区调查站位
1.3 数据处理
采用物种优势度Y(McNaughton)[11]判断群落的优势种,采用物种多样性指数H′(Shannon-Wiener index)[12]、均匀度指数J(Pielou index)[13]和物种丰富度指数D(Margalef index)[14]来研究浮游植物群落的结构特征。计算公式分别为:
Y=(ni/N)fi;
J=H′/log2S;
D=(S-1)/InN。
式中:ni为第i种的总个数;N为所有种类的总个数;fi为该种在各样品中出现的频率;Pi为第i种的个体数与样品中总个体数的比值;S为样品中种类总数。
2 结果与分析
2.1 浮游植物种类组成
莱州湾8个扇贝养殖区在4—11月共鉴定出浮游植物5门96种,其中硅藻门最多,有63种,占所有物种的65.5%;其次为甲藻门和绿藻门,分别有14和9种,分别占所有物种的14.6%和9.4%;金藻门和隐藻门最少,各有5种,分别占所有物种的5.2%(见表1)。

表1 莱州湾扇贝养殖区浮游植物种类组成
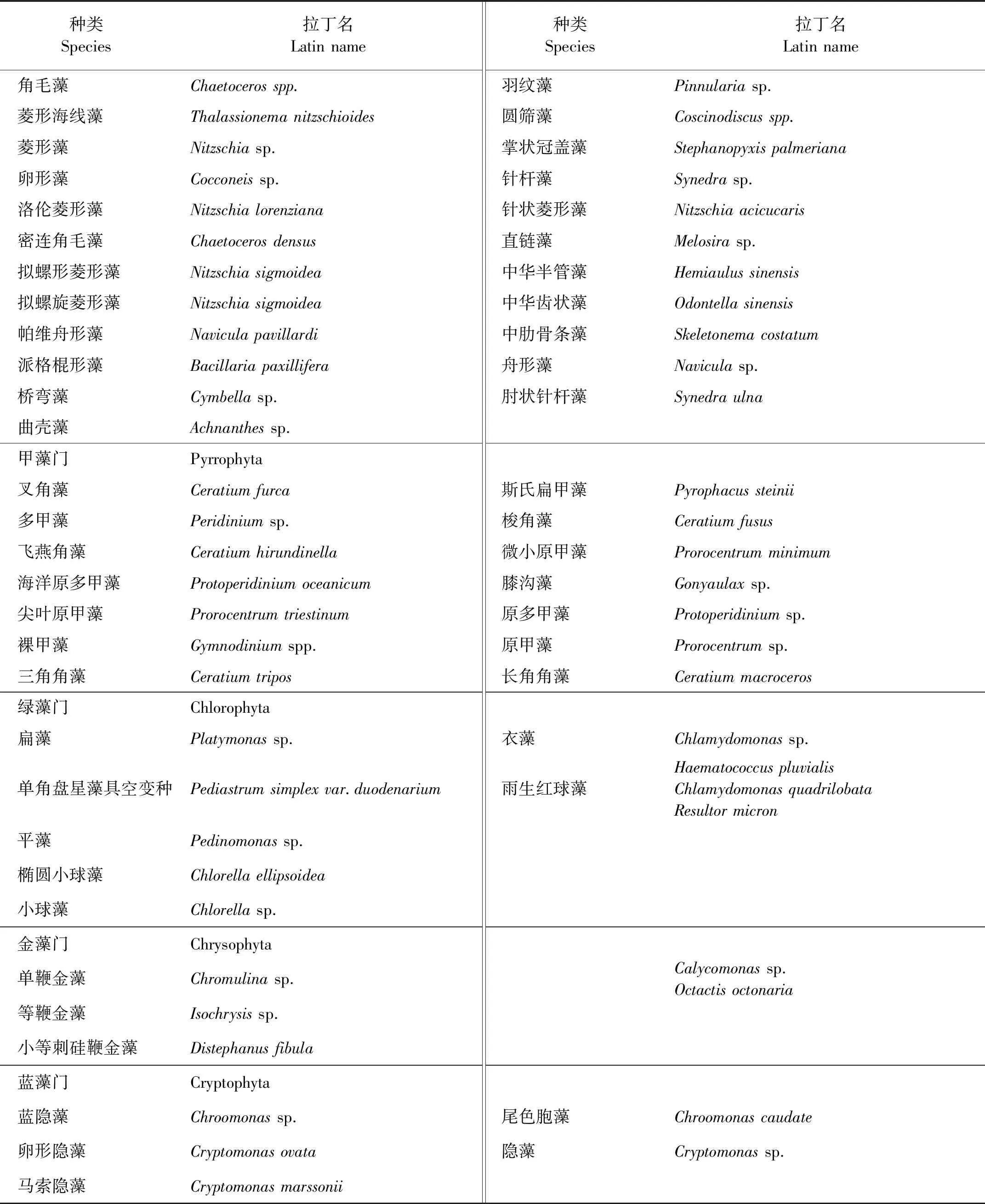
续表1
所有扇贝养殖区在4—11月浮游植物各门类所含物种数见图2。硅藻门10月份检出物种数最多,有40种,4月份检出物种数最少,有11种;甲藻门9月份检出物种数最多,有11种,4月份检出种类数最少,有2种;绿藻门5月份检出物种数最多,有8种,9—11月份检出种类数最少,各有1种;金藻门5、7和8月份各检出4种,6和9月份未检出;隐藻门4—8月份各检出2~3种,其余月份均未检出。

图2 莱州湾扇贝养殖区浮游植物各门类所含物种数分布图
2.2 浮游植物优势种变化
本研究取优势度(Y)≥0.02为优势种,8个扇贝养殖区在4—11月浮游植物的优势种及其优势度见表2。由表2可知浮游植物在不同月份所形成的优势种虽有所相同,但总体呈现演替状态,有的浮游植物只在单一季节形成优势种,如单鞭金藻、等鞭金藻、新月筒柱藻、针杆藻以及针状菱形藻等只在春季形成优势种;群生舟形藻、小球藻、舟形藻、尖布纹藻以及膝沟藻只在夏季形成优势种;布纹藻、浮动弯角藻以及尖刺拟菱形藻等只在秋季形成优势种。有的浮游植物在两个季节出现,如扁藻、蓝隐藻、柔弱几内亚藻、隐藻、长菱形藻、圆筛藻、角毛藻以及斯氏几内亚藻等。
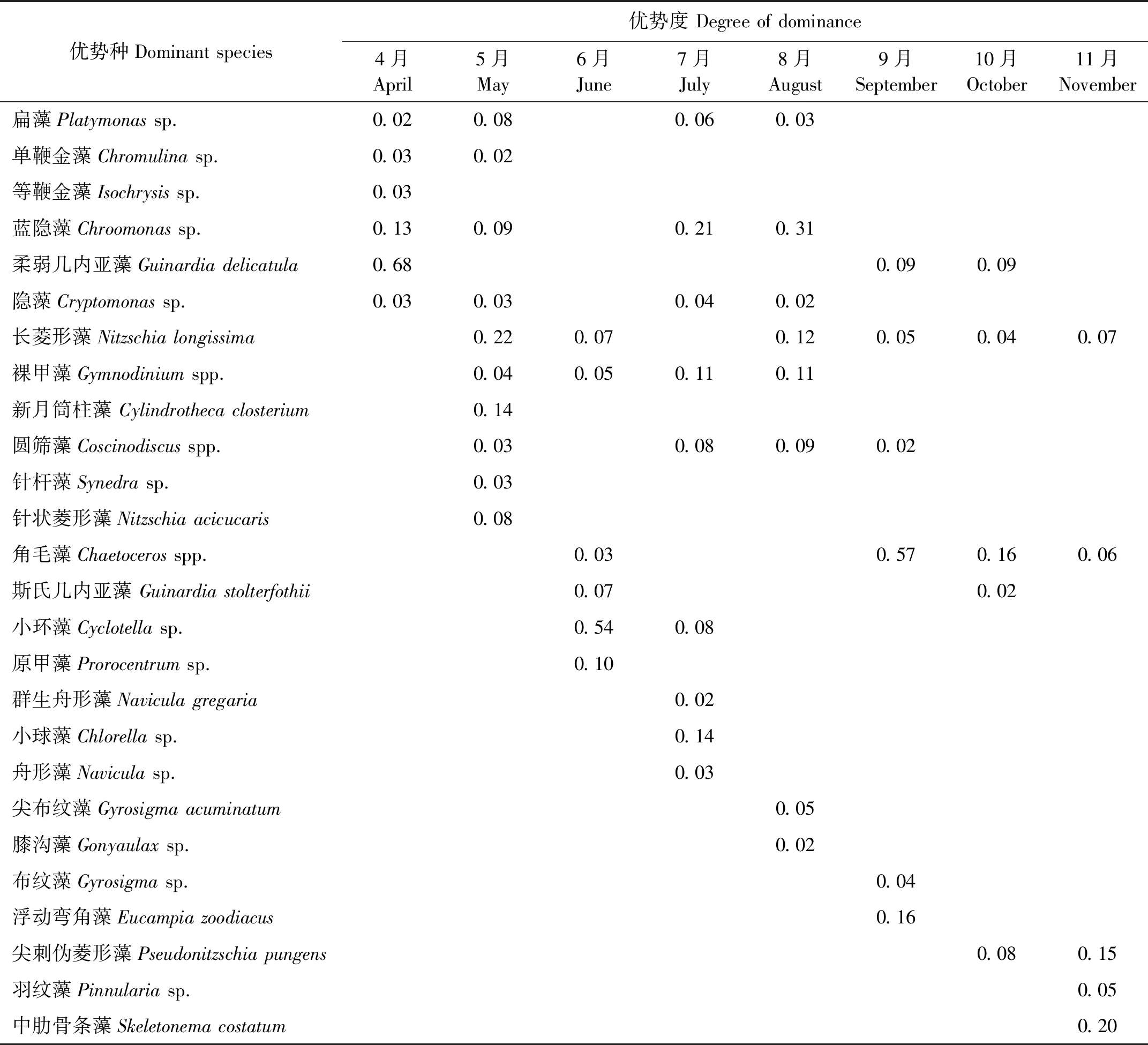
表2 莱州湾扇贝养殖区浮游植物优势种及其优势度
注:空白表示该物种在该月份未形成优势。
Note: The gap indicates that the species did not have an advantage in this month.
2.3 浮游植物密度变化
莱州湾8个扇贝养殖区在4—11月浮游植物密度变化如图3所示,春季(3和4月)密度变化范围为3.72×104~19.90×104cell/L,平均值为8.86×104cell/L,不同养殖区之间密度差异较小;夏季(6—8月)密度变化范围为1.62×104~112.04×104cell/L,平均值为14.11×104cell/L,其中6月份养殖区之间浮游植物密度分布差异较大,L1养殖区密度最大,L2养殖区密度最小,约相差9倍;秋季(9—11月)密度变化范围为0.43×104~36.80×104cell/L,平均值为7.97×104cell/L,其中9月份L4和L5养殖区浮游植物密度明显大于其他养殖区,10和11月份养殖区之间差异较小,整体明显为6月浮游植物平均密度最大,11月份平均密度最小。

图3 莱州湾扇贝养殖区浮游植物密度月份变化规律
2.4 浮游植物群落多样性分析
莱州湾8个扇贝养殖区在4—11月浮游植物多样性指数(H′)、均匀度(Y)以及物种丰富度指数(D)如表3所示。由表3可知,(1)8个扇贝养殖区在4—11月浮游植物多样性指数的变化范围为1.06~3.92,平均为2.86。L5和L6养殖区在4月、L1和L2养殖区在6月以及L3和L4养殖区在9月游植物多样性指数(H′)较低,其余月份与其他养殖区一样均处于动态变化之中。(2)8个扇贝养殖区在4—11月份浮游植物均匀度的变化范围为0.26~0.96,平均为0.72。L1养殖区在6月以及L3养殖区在9月份浮游植物均匀度略小于0.3,物种分布较不均匀,但整体来看,8个扇贝养殖区浮游植物物种分布较均匀。(3)8个扇贝养殖区在4—11月份浮游植物丰富度指数的变化范围为2.09~4.89,平均为3.27,同一养殖区在不同月份以及不同养殖区在同一月份差异均不大,整体处于动态波动之中,说明8个养殖区在8个月份浮游植物物种数分布较均匀。
3 讨论
3.1 浮游植物种类变化
本研究通过对莱州湾扇贝养殖区浮游植物的调查,检出硅藻门、甲藻门、隐藻门、金藻门和绿藻门共5门96种,除隐藻门在秋季未检出外,其它4门在春、夏和秋均有检出。程玲[7]、孙慧慧[9]以及吴雪[10]的研究结果表明莱州湾海域(包括养殖区海域)域浮游植物组成中,硅藻门在丰度和种类数上均占绝对优势,其次是甲藻门。郭术津等[15]、孙雪梅等[16]以及苑明莉等[17]对渤海海域浮游植物的调查也得出相同结论,均与本研究结果较为一致。
3.2 浮游植物密度变化
莱州湾8个扇贝养殖区浮游植物密度呈较明显的季节变化特征,最高值出现在夏季(6月),平均值为30.48×104cell/L,最低值出现在秋季(11月),平均值为1.98×104cell/L,历史资料显示,2003年[4]和2009[5]年莱州湾浮游植物数量均值最高值均出现在夏季(8月),最低值出现在春季(5月);2012—2014年[7]莱州湾浮游植物丰度最高值均在夏季(8月),最低值在秋季(11月);2015年[10]莱州湾扇贝养殖区浮游植物密度最高值在夏季(6月),最低值在秋季(11月),说明14年间莱州湾浮游植物群落结构的季节演替发生了变化,虽然浮游植物密度最高值都出现在夏季,但养殖区和非养殖区最高值出现的月份不相同,可能原因为7和8月份是扇贝的生长速度最快,对浮游植物的需求最大,期间绝大多数的浮游植物被扇贝摄取,所以养殖区内浮游植物密度在6月份最高而不是8月份。
本研究结果显示,莱州湾8个养殖区浮游植物密度变化范围为0.43×104~112.04×104cell/L,年平均值为10.60×104cell/L,其密度明显大于莱州湾海域历年研究结果,主要原因为历年采样均采用网采方法,相比本研究的水采方法,采样过程中难免会漏掉一部分直径小于浅水Ⅲ型浮游生物网孔径的微藻,另一原因可能为浮游植物在物种粒径上有趋于“小型化”的趋势,个体数增加[18],比如,圆筛藻属物种的地位有所下降,并逐渐被更小的小环藻(Cyclotellasp.)、蓝隐藻(Chroomonassp.)、裸甲藻(Gymnodiniumspp. )以及伪菱形藻(Pseudonitzschiasp.)等取代。张建乐等[19]研究结果表明2007年北戴河贝类养殖区的浮游植物丰度年均值为1.14×104cell/L;王大鹏等[20]研究结果表明2010—2011年北海营盘新珍珠贝养殖区浮游植物丰度为2.80×104~9.60×104cell/L;陈丽梅等[21]研究结果表明2012年大神堂贝类养殖区浮游植物密度年均值为6.22×104cell/L;与其它养殖区相比,该养殖区浮游植物密度处于较高水平,可见浮游植物作为贝类的饵料,其细胞数量足以满足扇贝生长的需求。
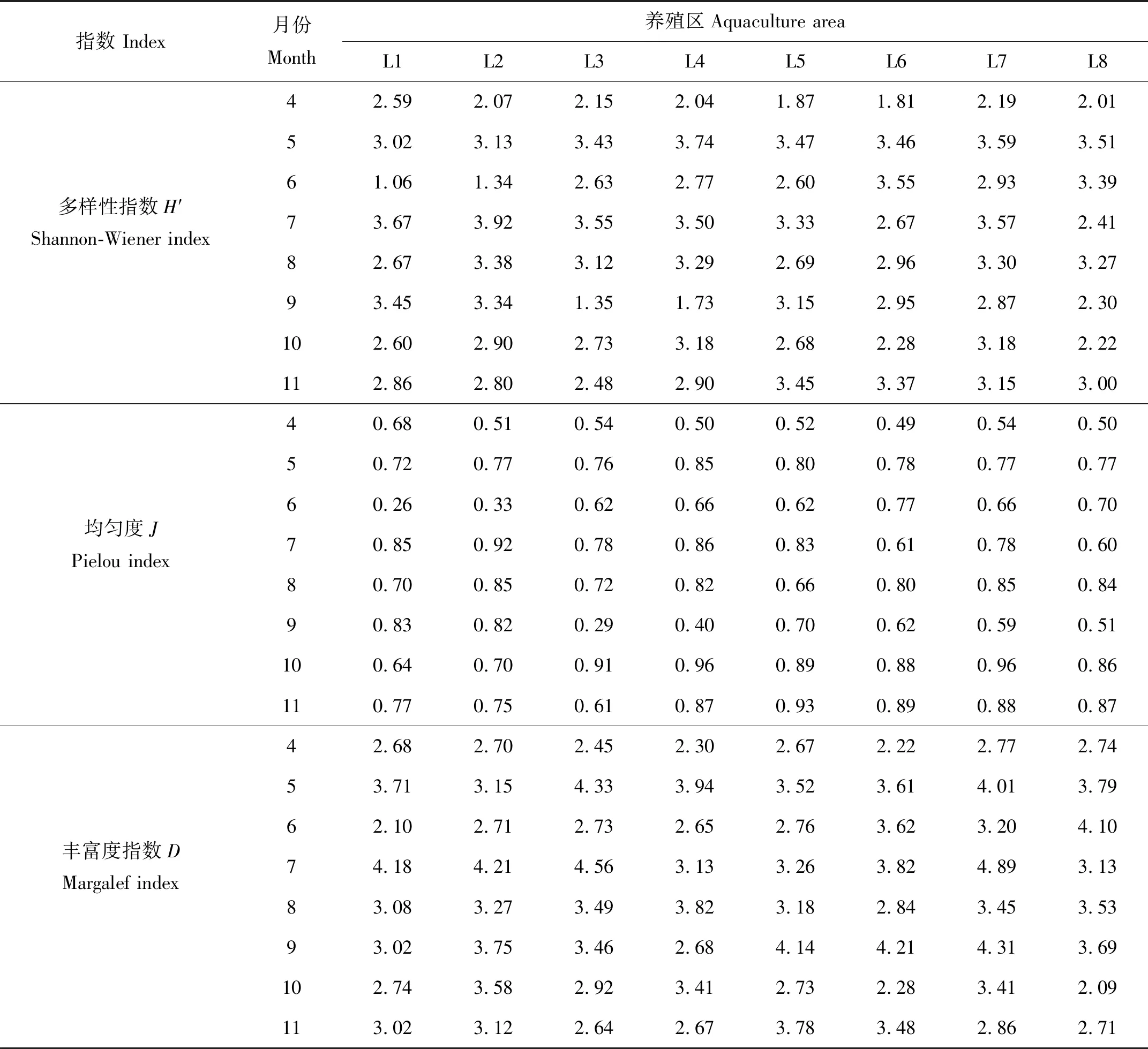
表3 莱州湾扇贝养殖区浮游植物多样性分析表
3.3 浮游植物优势种变化
优势种对浮游植物群落结构的变化产生着重要影响,其优势度越大,优势种的地位就越突出。本研究选取优势度(Y)≥0.02的种类为优势种。8个养殖区浮游植物优势种表现为既交叉又演替的状态,有的优势种在几个月份交替出现,有的优势种只在单个月份中出现。春季共有优势种12种,夏季共有优势种15种,秋季共有优势种11种,其中春、秋季节绝对优势种较为单一,除4月份蓝隐藻(Chroomonassp.)形成绝对优势种外,其余均属于硅藻门,如柔弱几内亚藻(Guinardiadelicatula)、长菱形藻(Nitzschialongissima)、新月筒柱藻(Cylindrothecaclosterium)、浮动弯角藻(Eucampiazoodiacus)、角毛藻(Chaetocerosspp.)、尖刺伪菱形藻(Pseudonitzschiapungens)和中肋骨条藻(Skeletonemacostatum),而夏季,绝对优势种种类较多,有硅藻门的小环藻(Cyclotellasp.)和长菱形藻(Nitzschialongissima),隐藻门的蓝隐藻(Chroomonassp.),甲藻门的原甲藻(Prorocentrumsp.)和裸甲藻(Gymnodiniumspp.)以及绿藻门的小球藻(Chlorella sp.),硅藻门相比春、秋季密度有所下降,其他门类的比例有所上升,特别是甲藻门。硅藻喜低温,最适合的温度通常低于18 ℃[22-23],而甲藻群落则与温度呈显著正相关[9],莱州湾海域春、秋季(除9月份)的水温[9,24]均是硅藻生长的理想温度,从而能促进其大量繁殖,形成明显的优势种,而夏季水温较高.甲藻数量开始增加,且7和8月份又是扇贝生长最快的时期,对硅藻的需求量大大增加,从而使硅藻门的优势地位下降,甲藻门优势地位增强。
近10年的研究发现(见表4),优势种绝大多数属于硅藻门,偶尔出现甲藻门,且体积较大,而近2年隐藻门、绿藻门和金藻门的藻类也有优势种出现,且大型浮游植物如圆筛藻(Coscinodiscusspp.)、三角角藻(Ceratiumtripos)和布氏双尾藻(Ditylumbrightwellii)等虽有检出,但其密度所占比例大幅度降低,优势种有向“小型化”发展的趋势。
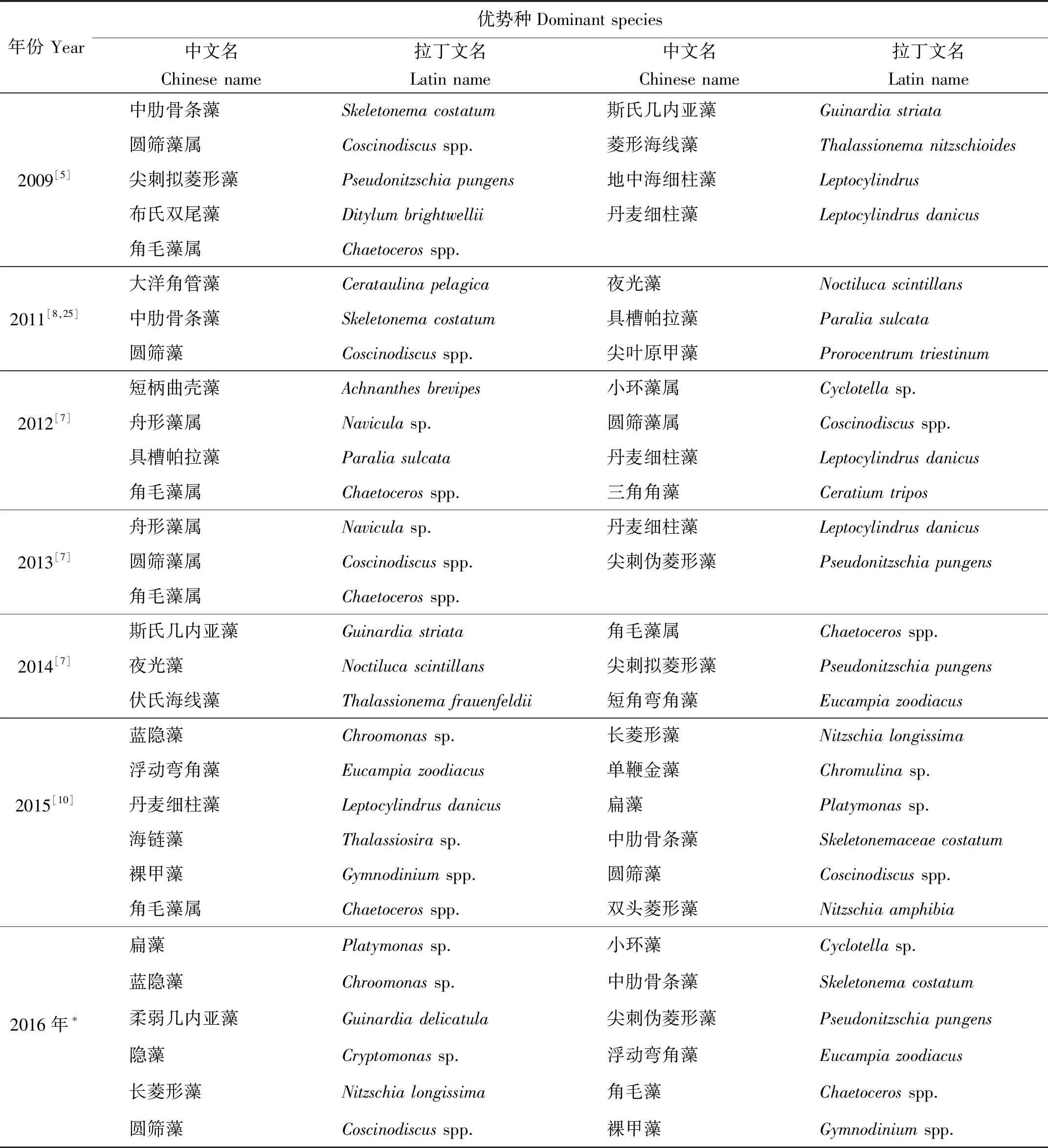
表4 莱州湾邻近海域浮游植物优势种历年资料的比较
注:*为本研究结果。Note:*is the content of this study.
3.4 浮游植物多样性变化
多样性指数(H′)可以反映浮游植物群落结构的复杂程度;均匀度(Y)和物种丰富度指数(D)可以反映群落个体和物种数的分布情况,三者均能在一定程度上反应浮游植物群落结构的特征。一般来说,多样性指数(H′)、均匀度(Y)和物种丰富度指数(D)越高,该群落所属的生态系统就越稳定和成熟,在浮游植物生物多样性评价中常以多样性指数小于1.0、均匀度指数小于0.30作为群落多样性较差的标准[4]。本研究结果显示,8个养殖区的多样性指数(H′)、均匀度指数(Y)和物种丰富度指数(D)变化范围分别1.06~3.92、0.26~0.96和2.09~4.89,多样性指数(H′)均大于1,均匀度指数(Y)除L1养殖区(6月)和L3养殖区(9月)小于0.3之外,其它养殖区浮游植物均匀度均大于0.3,整体生物多样性较好,物种分布较均匀,群落结构较复杂。此外,多样性指数(H′)又可作为环境质量评估的依据,根据生物多样性指数评价标准[26]:H′ > 3.0,生态环境质量优良;2.0≤H′ < 3.0,生态环境质量一般;1.0≤H′< 2.0,生态环境质量较差;H′<1.0,生态环境质量极差,可知4月L5和L6养殖区、6月L1和L2养殖区以及9月L3和L4养殖区生态环境质量较差,其余月份所有养殖区生态环境质量一般或者优良。
4 结论
(1)2016年莱州湾8个扇贝养殖区共检出浮游植物5门96种,包括硅藻门、甲藻门、隐藻门、金藻门和绿藻门,其中以硅藻门种类数最多。
(2)浮游植物密度变化范围为0.51×104~11 204×104cells/L,6和9月密度较高,呈现季节差异性。浮游植物优势种主要有柔弱几内亚藻、小环藻、长菱形藻、角毛藻、蓝隐藻、尖刺菱形藻、尖刺伪菱形藻和中肋骨条藻。
(3)莱州湾8个扇贝养殖区浮游植物多样性指数较高,其中生物多样性指数在1.06~3.92之间,均匀度指数在0.26~0.96之间,物种丰富度指数在2.09~4.89之间,总体群落结构较复杂,生态环境较稳定。
