转水稻条纹病毒NS3本氏烟的抗病性
2019-06-11吴根土陈广香张珈源胡桥马明鸽窦彦霞李明骏青玲
吴根土,陈广香,张珈源,胡桥,马明鸽,窦彦霞,李明骏,青玲
转水稻条纹病毒本氏烟的抗病性
吴根土,陈广香,张珈源,胡桥,马明鸽,窦彦霞,李明骏,青玲
(西南大学植物保护学院植物病害生物学重庆市高校级重点实验室,重庆 400716)
【目的】编码的蛋白是水稻条纹病毒(,RSV)RNA沉默抑制子。笔者前期研究发现,转本氏烟()对RSV有一定的抗性。为深入揭示NS3在寄主体内的作用机制,本文将进一步探究转本氏烟对其他烟草病害的抗性。【方法】以野生型本氏烟和转本氏烟为试验材料,通过农杆菌浸润法接种马铃薯X病毒(,PVX)侵染性克隆,观察病毒症状,抽提系统发病叶片总RNA,并利用RT-qPCR方法检测病毒的相对积累量;采用灌根接种法分别接种烟草青枯病菌()、烟草黑胫病菌(var.),观察植株表型并统计发病率和病情指数。【结果】PVX侵染本氏烟后,植株叶片主要表现为花叶、褪绿等症状,表达植株与野生型植株具有相同的PVX症状表现。在接种PVX 10 d后,RT-qPCR检测发现与野生型植株病毒积累量相比,表达抑制了PVX在本氏烟体内的积累水平,两个转株系(NS3-6、NS3-9)中PVX的相对积累量分别为野生型植株的68.17%和81.01%。青枯病菌在野生型植株和转基因植株上均引起萎蔫、猝倒等典型的病害症状,且两者的症状无明显差异。在青枯病菌侵染早期,表达在一定程度上利于病菌的侵染,表现出对青枯病较为敏感;而在接种14 d,野生型植株的发病率为100.00%,病情指数为78.67,而NS3-6、NS3-9株系的发病率分别为95.00%、98.33%,病情指数分别为70.00、73.00;14 d之后发病率和病情指数逐渐升高,而表达株系的病情指数均低于野生型植株。黑胫病菌在野生型植株和转基因植株上均为在茎基部出现黑褐色坏死斑等典型病害症状,且表达也不影响本氏烟的症状表现。在黑胫病菌的侵染初期,NS3-6株系的发病率高于野生型植株;但在整个黑胫病发生过程中,转株系的病情指数均低于野生型植株,在接种12 d,野生型本氏烟的发病率为96.67%,病情指数为77.50,而NS3-6、NS3-9株系的发病率分别为90.00%、86.67%,病情指数分别为64.17、62.08。【结论】通过病原侵染过程观察表明表达在一定程度上影响了烟草病害在本氏烟上的侵染和严重程度,且对不同病原菌的影响不同。
水稻条纹病毒;;转基因本氏烟;抗病性
0 引言
【研究意义】植物RNA沉默(RNA silencing)不仅调节内源基因的表达,也是抵御病原物侵染的重要机制[1]。然而,几乎所有的植物病毒均会编码RNA沉默抑制子(viral suppressors of RNA silencing,VSR)来干扰寄主的RNA沉默,进而影响植物的正常生长发育[2-5]。同时,VSR还可协助病毒积累,加重病毒病症状[6-8]。前期研究发现,水稻条纹病毒(,RSV)NS3同时具有作为VSR协助RSV侵染和作为寄主防卫反应诱导因子抑制病害发生的双重功能[9-10]。本研究继而以转RSV本氏烟()为材料,分析其对烟草重要病害的抗性,对深入揭示VSR在寄主体内的双重功能具有重要意义,并可为植物抗病育种提供理论依据。【前人研究进展】由RSV引发的水稻条纹叶枯病在我国稻区时有发生,造成严重的经济损失[11]。RSV基因组由4条RNA单链(RNA1、RNA2、RNA3、RNA4)组成,共编码7个蛋白。除RNA1反义编码RNA依赖RNA聚合酶(RNA dependent RNA polymerase,RdRp)外,其他3条RNA链均以双义编码策略编码病毒蛋白,分别含有2个不重叠的开放阅读框(open reading frame,ORF),这2个ORF由具有转录终止功能的非编码区(intergenic region,IR)间隔[12-13]。NS3是RNA3正义链编码的蛋白,被鉴定为RNA沉默抑制子[14]。通过遗传转化方法获得转水稻()和本氏烟,表型观察发现表达的转基因植株未呈现生长异常,因此认为其不是症状决定因子[9,14]。但是,NS3蛋白在维持病毒与传播介体昆虫,病毒与寄主植物的互作过程中起到很大的作用。NS3可以与介体灰飞虱()体内蛋白酶体途径中的重要因子LsRPN3(regulatory-particle non-ATPase subunit 3)互作,进而抑制26S蛋白酶体途径,帮助昆虫介体传播病毒[15]。NS3与OsDRB1(dsRNA-binding protein)互作,增加microRNA(miRNA)的积累,从而有利于RSV在水稻中的侵染和积累[16]。姜良良[17]研究发现,NS3蛋白与本氏烟核定位蛋白NbPip3(protein interacting with p3)互作,从而促进自噬途径对NS3降解,参与植物抗RSV侵染的作用途径。因此,NS3在RSV传播、侵染及在寄主体内积累等过程中均起到一定的作用,其在病原与寄主互作过程中起着多重作用。随着气候逐渐变暖和植物产品调动日益频繁,植物病原物不断扩散及危害加重的可能性增大,为抗病育种工作者带来挑战。在抗植物病毒研究中,人们通常是以转入病毒基因来获取抗病毒材料[18-20]。研究发现,VSR除了作为RNA沉默抑制子协助病毒侵染,还可以促使寄主对其他病原物产生抗性,例如转入烟草蚀纹病毒(,TEV)的植物对番茄黑斑病毒(,TBRV)和烟草霜霉菌()抗性增强[21]。【本研究切入点】在前期工作中,笔者通过农杆菌介导遗传转化获得转水稻和本氏烟。转基因水稻接种RSV后发现,在RSV侵染早期,水稻对RSV敏感性增强,表现为症状加重、病毒积累量增多;而在侵染后期,与野生型植株上的病毒相比,转水稻上病毒症状较轻,而病毒积累量却无明显变化。进一步抗性分析发现,转水稻对稻瘟病菌()的抗性增强[9];在转本氏烟上接种RSV后发现病毒症状较轻,且病毒的发病率和积累量显著降低,通过转录组测序分析发现,表达影响了寄主内源抗性基因表达[10]。因此,表达是否会通过影响本氏烟抗性基因表达而增强对其他病原菌的抗性有待验证。【拟解决的关键问题】针对该问题,本研究在转基因本氏烟上分别接种马铃薯X病毒(,PVX)、烟草青枯病菌()、烟草黑胫病菌(var.),观察发病情况并统计发病率和病情指数,为揭示在寄主体内的作用机制和抗病育种提供理论依据。
1 材料与方法
试验于2017年4月至2018年6月在西南大学植物保护学院植物病理学温室完成。
1.1 试验材料
供试烟草:野生型本氏烟(wild-type)、转本氏烟(-transgenic)由笔者实验室保存,种于西南大学植物保护学院植物温室中,温室条件为16 h光照/8 h黑暗,温度24℃。植株培养至4—6叶期备用。在前期工作中,已对转本氏烟的生长发育与野生型植株进行了比较,表达对本氏烟发芽速率、生长速率、株型、叶型及株高均未造成影响,与野生型植株生长发育相一致;同时,利用PCR技术及Northern杂交技术检测了阳性植株和基因转录情况[10],利用Western杂交技术检测了阳性植株NS3蛋白表达[22]。
供试菌株:PVX侵染性克隆由宁波大学植物病毒研究所燕飞研究员提供;青枯病菌为西南大学植物保护学院农药学研究室丁伟教授赠送;黑胫病菌为笔者实验室 窦彦霞老师培养、保存。
供试培养基:试验过程使用的培养基包括LB培养基、肉汁冻培养基(NA)、TTC培养基(TCC)和燕麦琼脂培养基(OA)。
主要试剂:CTAB,北京鼎国昌盛生物技术有限公司;总RNA抽提试剂盒(TaKaRa 9697),反转录试剂盒(TaKaRa RR037A);ExTaq DNA聚合酶,宝日医生物技术(北京)有限公司;SYBR Green I荧光染料,Promega公司。
1.2 试验方法
1.2.1 DNA抽提及PCR检测 DNA抽提:用CTAB法抽提野生型和转基因本氏烟总DNA。取少量的本氏烟叶片放入2 mL的EP管中,用液氮快速研磨成粉末后进行总DNA抽提,DNA沉淀用50 μL的ddH2O溶解。取2 μL DNA溶液进行琼脂糖凝胶电泳,检测DNA质量。
PCR检测:用抽提的总DNA作为模板,以已构建好的pCV/NS3质粒作为阳性对照,野生型植株DNA作为阴性对照,ddH2O作为空白对照,用RSV基因特异性引物进行PCR扩增,引物序列为NS3 det F:5′- ATGGAAGGGAAGACTATGTTC-3′,NS3 det R:5′-TTAACCCATGCTGGGAGTATC-3′,检测转本氏烟的阳性率。
1.2.2 浸润接种PVX 将含有PVX侵染性克隆的农杆菌GV3101涂于含50 μg∙mL-1卡那霉素(Kan)和40 μg∙mL-1利福平(Rif)抗生素LB固体培养基平板上,28℃培养箱中培养;挑取转化的农杆菌单菌落于含有相同抗性的LB液体培养基中,28℃,220 r/min摇培16 h后菌液做PCR扩增,并进行阳性检测。检测结果为阳性的菌液以1﹕100转接到新的相应抗性的LB液体培养基中,培养至OD600为0.6—0.8,5 000 r/min离心10 min 收集菌体,并用ddH2O洗菌体2—3次。
用瞬时转染液(含10 mmol·L-1MgCl2,10 mmol·L-1MES,200 μmol·L-1AS)悬浮菌体并将菌液OD600值调到1.0左右。室温放置4 h后注射5叶期野生型本氏烟小苗、转本氏烟,每个株系浸润20株。系统发病后(大约7 d),观察PVX症状,取系统叶抽提RNA,用RT-qPCR方法检测PVX积累量。重复3次。
1.2.3 荧光定量PCR(RT-qPCR)检测病毒积累量 取感染PVX的本氏烟叶片,经液氮冷冻后研磨成粉末,总RNA提取具体操作参照TaKaRa 9697试剂盒说明进行。总RNA用50 μL RNase Free ddH2O溶解,取2 μL RNA进行琼脂糖凝胶电泳,检测总RNA质量。
cDNA合成参照TaKaRa RR037A试剂盒体系进行。
用PVX的一段序列设计定量引物(PVX qF:5′-GGACATGAAGGTGCCCACAGA-3′,PVX qR:5′-CCACTGGAGCATACTTCATGCA-3′),以本氏烟甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因为内参,进行RT-qPCR检测,检测体系:2×qPCR Mix 10.0 μL,PVX qF(10 nmol·L-1)0.3 μL,PVX qR(10 nmol·L-1)0.3 μL,cDNA 1.0 μL,ddH2O 8.4 μL。读取Ct值,相对表达量通过2-ΔΔCt法计算。
1.2.4 青枯病菌的制备与侵染 菌液制备:接种环蘸取青枯病菌菌液在TTC培养基平板上划线,30℃培养48 h。待有单菌落长出,用移植环挑取单菌落连续在TTC平板上纯化[23]。病菌的致病力测定参照方中达[24]的方法,略有改变:在TTC培养基上,致病菌株菌落呈不规则圆形,边缘液体状乳白色带宽,中心粉红色点小,黏液多。将青枯致病菌株在NA培养基平板上活化,30℃扩大培养,并用无菌水稀释为OD600为0.1。
青枯病菌侵染本氏烟:用上述配制好的青枯病菌菌液对5叶期野生型和转本氏烟进行灌根处理,每株10 mL,每个处理20株。设等体积无菌水灌根处理作为空白对照。接种后的本氏烟苗置于25℃的温室中,并每天喷雾进行保湿,隔天观察发病情况。烟草青枯病的严重度依据王海波[25]制定的分级标准进行。试验重复3次。
1.2.5 黑胫病菌的制备与侵染 黑胫病菌游动孢子悬浮液的制备:参照马国胜等[26]的方法培养,略有改动。供试菌株在OA平板上25℃暗培养3 d,从菌落边缘切取10块大小约2 mm×2 mm的菌丝块,移入盛有20 mL液体OA培养基的培养皿中,25℃暗培养3 d,用灭菌镊子把菌丝丛转移到另一无菌培养皿中,加入灭菌水20 mL,每12 h换一次灭菌水,直至孢子囊大量形成。待大量孢子囊产生后,将培养皿置于4℃冰箱中15 min,取出置于25℃下30 min,即得到有大量孢子的孢子悬浮液。取样镜检测定其浓度,并将其稀释成104个/mL。
黑胫病菌游动孢子悬浮液灌根接种:用上述游动孢子悬浮液对5叶期野生型和转本氏烟进行灌根处理,每株10 mL,每个处理20株。设等体积无菌水灌根处理作为空白对照。并每天喷雾进行保湿。接种后的烟草苗置于25℃的温室中,观察发病情况。烟草黑胫病的严重度依据王岩[27]使用的分级标准进行。试验重复3次。
1.3 数据处理与分析
应用Excel 2013软件进行数据输入、计算平均值和方差分析。
2 结果
2.1 PCR检测
对提取成功的本氏烟植株DNA进行PCR扩增,获得大小为636 bp RSV扩增产物(图1)。阳性样品均能扩增到目标大小的DNA片段,而阴性对照和空白对照均无扩增产物,说明PCR体系和反应程序没有问题,引物没有污染。NS3-6株系的10个植株均能获得目标大小的DNA片段(图1-A),而NS3-9株系的10个植株中只有1个植株未能获得目标大小的DNA片段(图1-B),因此,所检测的NS3-6、NS3-9株系的阳性率分别为100%、90%。
2.2 PVX症状观察
用含有PVX侵染性克隆农杆菌GV3101浸润接种本氏烟后8 d,植株主要表现为轻型花叶,系统侵染叶片通常表现为坏死斑,稍有波纹,之后发展为大小不等、形状不规则的坏死斑驳、褪绿、花叶等症状(图2-B、2-C、2-D)。与未接种PVX野生型本氏烟(图2-A)相比,野生型及转的2个株系本氏烟接种PVX后均表现出花叶的症状,但转本氏烟接种PVX后表现症状(图2-C、2-D)与野生型本氏烟接种PVX后的症状(图2-B)并无明显差异。

A:转基因本氏烟NS3-6株系NS3-transgenic N. benthamiana line 6;B:转基因本氏烟NS3-9株系NS3-transgenic N. benthamiana line 9。M:Marker;a:阳性对照Positive control;b:阴性对照Negative control;c:ddH2O;1—10:1—10号样品The ten plants of transgenic N. benthamiana

A:野生型本氏烟未接种PVX the healthwild-type N. benthamiana plants;B:野生型本氏烟接种PVX wild-type N. benthamiana inoculated with PVX;C:转基因本氏烟NS3-6株系接种PVX NS3-transgenic N. benthamiana line 6 inoculated with PVX;D:转基因本氏烟NS3-9株系接种PVX NS3-transgenic N. benthamiana line 9 inoculated with PVX
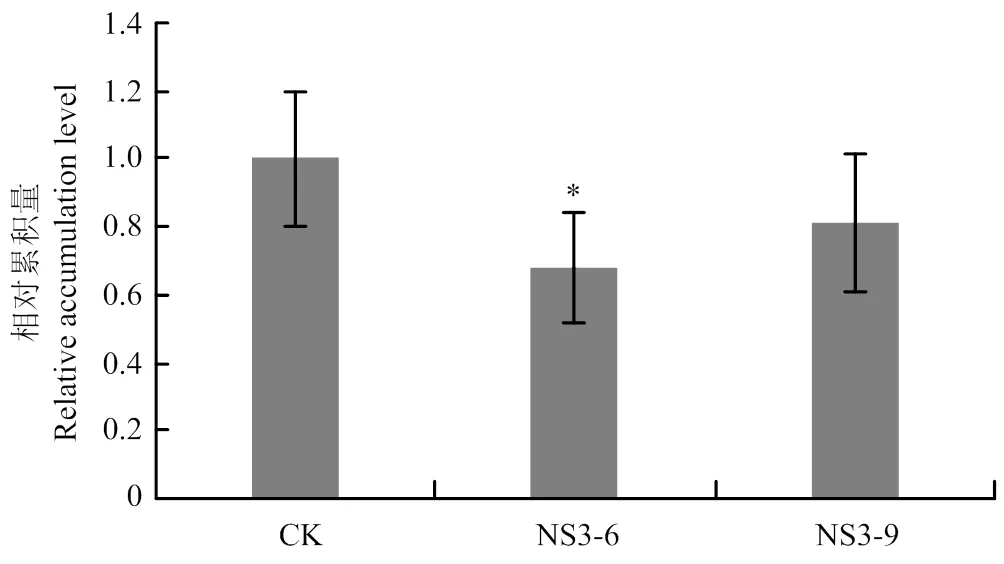
2.3 PVX在本氏烟中的积累量
提取受PVX侵染10 d的转RSV的2个株系本氏烟(NS3-6、NS3-9)与野生型本氏烟(CK)的系统叶总RNA并进行RT-qPCR检测,结果显示,受PVX侵染的2个转株系本氏烟的病毒积累量较野生型本氏烟的低。NS3-6、NS3-9株系的PVX积累量分别为野生型本氏烟的68.17%、81.01%,且NS3-6株系病毒的积累量与CK植株的积累量差异显著(图3),表明表达在一定程度上抑制了病毒的积累水平。
2.4 转NS3本氏烟对青枯病的抗性
受青枯病菌侵染的转株系(NS3-6、NS3-9)与野生型本氏烟(CK)均表现出青枯病的典型症状。初发病时,病株多向一侧枯萎呈现“半边疯”状态,有的先在叶片支脉间局部叶肉产生病变,茎上出现长形黑色条斑,有的条斑扩展到病株顶部或枯萎的叶柄上。发病中期全部叶片萎蔫,发病表皮变黑腐烂,根部也变黑腐烂,病株茎杆变黑。发病后期整株枯萎,叶片和茎变黑、猝倒。按照青枯病的病情分级标准,每个病级的转植株与野生型(CK)本氏烟表现症状并无差异(图4)。
每个柱子代表3次独立试验平均值,*表示差异显著(0.01≤P<0.05)。下同
从开始发病进行隔天统计发病率和病情指数(图5、图6)。接种烟草青枯病菌10 d后野生型本氏烟(CK)的发病率为60.00%,病情指数为29.67,NS3-6株系的发病率和病情指数均与CK的相当,而NS3-9株系的发病率和病情指数均略高于CK,且随着病害的发展,CK和转株系的发病率和病情指数逐渐升高。在接种14 d后,CK的发病率为100.00%,病情指数为78.67,而转株系的发病率和病情指数均低于CK;在接种18 d后,CK和转株系的发病率均为100.00%;CK的病情指数为85.67,株系的病情指数80.00。由此可见,在感染烟草青枯病菌时,与CK相比,转本氏烟在发病初期发病率和病情指数稍高,后期发病率逐渐持平,发病14 d后,转株系病情指数显著低于野生型植株。

图4 本氏烟接种青枯病菌后不同病害等级症状
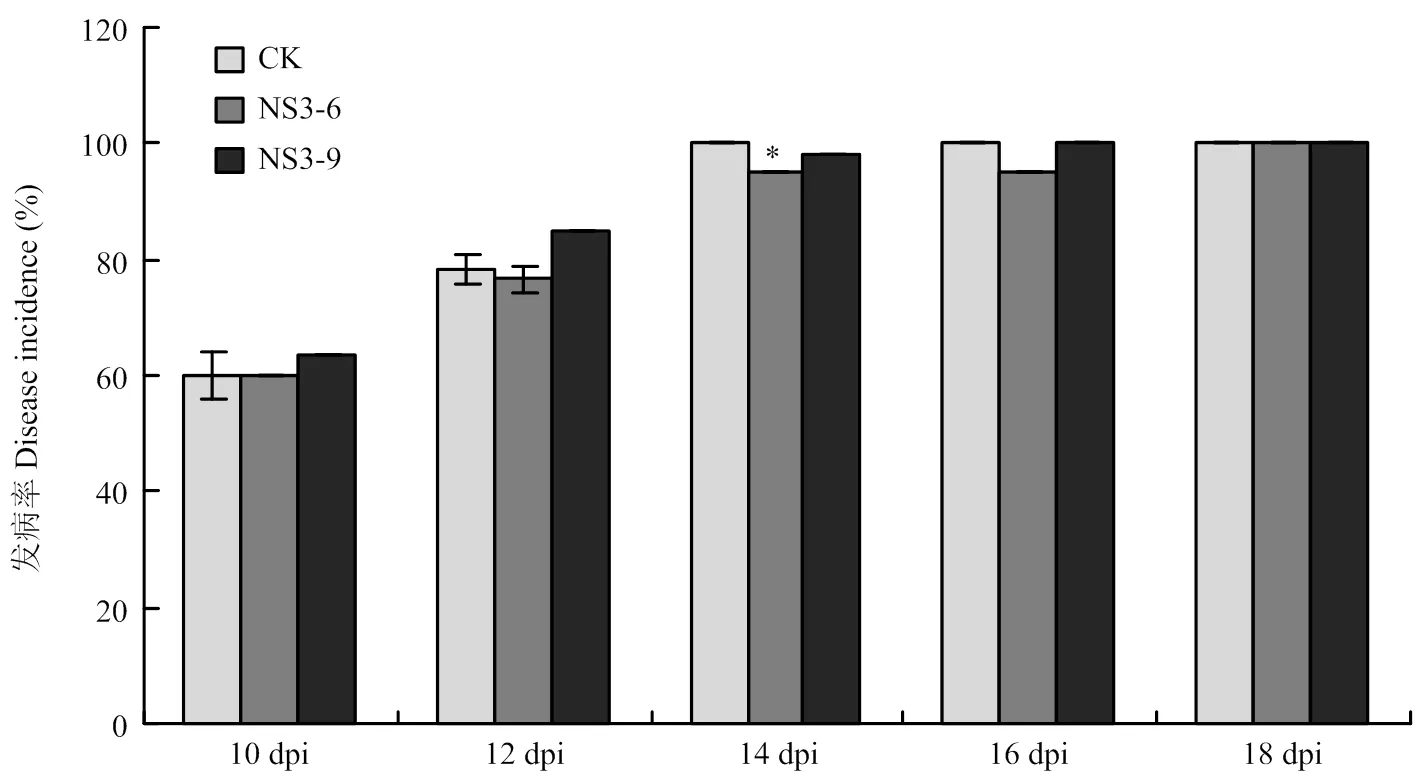
图5 接种青枯病菌后本氏烟的发病率
2.5 转NS3本氏烟对黑胫病的抗性
受黑胫病菌侵染转株系(NS3-6、NS3-9)与野生型本氏烟(CK)均表现出黑胫病的典型症状。茎基部出现黑斑,并环绕全茎向上延伸,有的植株猝倒,植株中部叶片发病后,病斑可通过主脉、叶基蔓延到茎部,造成茎中部出现黑褐色坏死,俗称“腰烂”。湿度大时,病部长满白色菌丝,病株叶片自下向上依次变黄、萎蔫,以至全株叶片凋萎。按照烟草黑胫病菌的病情分级标准,每个病级的转株系与CK表现症状并无差异(图7)。
从开始发病进行隔天统计发病率和病情指数(图8、图9)。接种烟草黑胫病菌8 d后CK的发病率为75.00%,病情指数为57.08,NS3-6的发病率略高于CK,而NS3-9的发病率和病情指数均显著低于CK。随着病害的发展,CK和转株系的发病率和病情指数逐渐上升,最后CK和NS3-6株系的所有植株均发病。从接种12 d开始,CK的发病率和病情指数均高于转株系,且转株系病情指数均显著低于CK。接种18 d后,NS3-9株系的个别植株没有发病,发病率为98.33%。由此可见在感染黑胫病菌时,转本氏烟在烟草黑胫病发病初期发病率与CK并无较大差异,后期逐渐低于CK,且转本氏烟的病情指数在不同发病时期均较CK低,表明转基因植株的病害严重度低于对照植株。

图6 接种青枯病菌后本氏烟的病情指数

图7 本氏烟接种黑胫病菌后不同等级症状
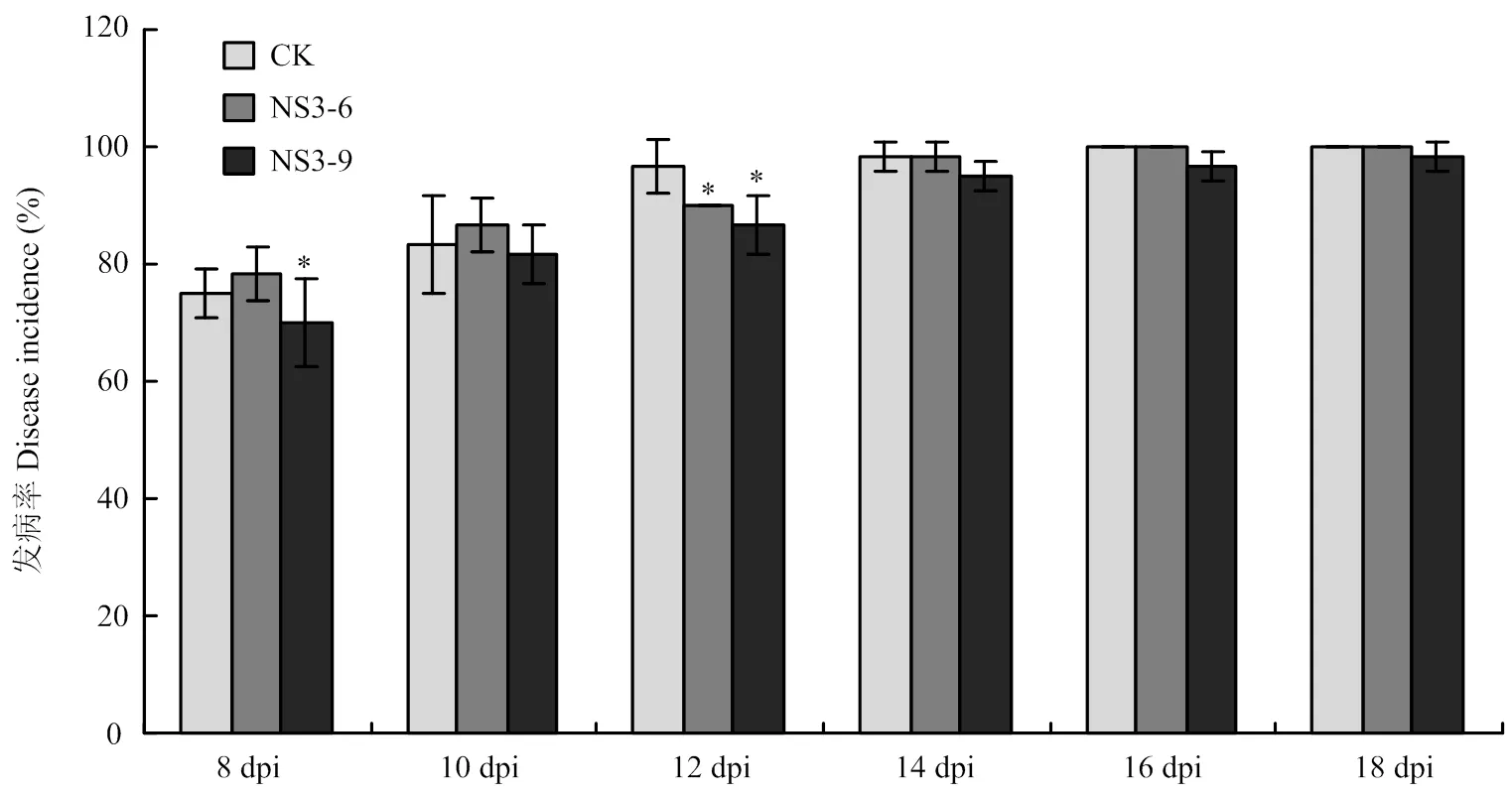
图8 接种黑胫病菌后本氏烟的发病率

图9 接种黑胫病菌后本氏烟的病情指数
3 讨论
RNA沉默抑制子(VSR)是病毒在长期进化过程中为抵御寄主的RNA沉默而产生的,帮助病毒顺利侵入、复制和扩散;同时,共表达异源VSR的重组病毒通常毒力增强并加重在寄主上造成的症状;而且通过转基因表达某些VSR可导致植物生长与生殖器官的发育缺陷,比如芜菁花叶病毒(,TuMV)编码的VSR,P1/HC-Pro影响寄主miR171的调控作用,导致拟南芥生长异常[28];TAKAGI等[29]报道将黄瓜花叶病毒(,CMV)编码的转入大豆中导致其种皮颜色异常。相反,在笔者实验室前期工作中得到的转RSV的本氏烟,其表型正常,与野生型本氏烟无差别,说明该基因不是致病决定因子;对其进行摩擦接种RSV,发现转基因本氏烟上的病毒症状较野生型要轻,且发病率和病毒积累量显著降低,说明转入使本氏烟对RSV抗性增加,这种抗性增加的根本机制需要进一步研究,可能与定位于细胞核中的NS3活性有关[14]。
通过转基因方法将病毒基因导入植物,从而获得抗病毒植株的研究已经取得较大进展。刘玉乐等[30]研究发现,表达CMV卫星RNA的转基因烟草对烟草花叶病毒(,TMV)的抗性比野生型强,其机制可能是卫星RNA与病毒基因组RNA争夺病毒RNA复制酶,从而干扰了病毒基因组RNA的复制;刘晓玲等[31]研究发现,将非翻译的PVX转入烟草中得到了在RNA水平上对PVX高度抗病的转基因烟草;郭兴启等[32]研究表明,将非翻译的马铃薯Y病毒(,PVY)的转入烟草,获得了由RNA介导的抗PVY的转基因植株,其抗病性与转基因拷贝数成正比,与转基因mRNA在细胞质中的积累水平呈负相关,且这种抗病性不受接种物剂量的影响。本试验在转本氏烟上接种PVX,观察其发病情况并检测病毒积累量,发现受PVX侵染的转本氏烟中病毒积累量较野生型本氏烟低,说明转入不利于PVX在寄主中积累,但其具体机制还有待进一步研究。
ZHANG等[33-34]将大豆中的转入烟草中诱导了病程相关基因的表达,而且转基因烟草增强了对青枯病和TMV的抗性;Jaynes等[35]将天蚕素B类似物转入烟草后,与对照相比,转基因烟草上青枯病症状出现延迟且病害程度和死苗率均较低;徐莺等[36]研究发现,转烟草对烟草青枯病同样具有一定的抗性;Hassan等[37]将转入马铃薯,增强了马铃薯对青枯病的抗性。本试验中,本氏烟在接种烟草青枯病菌后,观察其发病情况、统计发病率及病情指数,发现转本氏烟在接种初期发病率和病情指数稍高,后期发病率逐渐与野生型持平但病情指数低于野生型对照,说明转本氏烟对青枯病菌更为敏感,易感病,但后期随着的表达,逐渐产生抗病反应。
有研究报道,转入TEV的烟草对烟草霜霉菌抗性增强,进一步研究发现其抗性增强是依赖于水杨酸(salicylic acid,SA)途径的防卫反应[21],且转烟草拥有更快和更有效的防御机制。进一步将HC-Pro蛋白与烟草寄主蛋白进行酵母双杂交试验发现,HC-Pro蛋白和一个与RNA沉默有关的钙调蛋白互作[21],并且此蛋白还与寄主早期防御信号有关,表明转入的还可能影响了寄主其他的防御机制。另外,有研究报道将大豆中一个茉莉酸(jasmonic acid,JA)信号途径的基因转入本氏烟中能够增强寄主的抗真菌以及抗盐和抗旱能力[38]。WU等[9-10]研究还发现,转RSV水稻中病程相关蛋白基因和抗病基因NBS-LRR均发生上调,转水稻对水稻白叶枯病和稻瘟病的抗性比野生型要强,且诱导寄主抗性增加并不依赖于SA和JA途径。本试验在接种黑胫病菌后,观察其发病情况、统计发病率及病情指数,发现转RSV本氏烟在接种前期发病率低于野生型本氏烟,后期基本与野生型持平,而转基因本氏烟病情指数在接种不同天数均较野生型对照低,说明与野生型相比转本氏烟对烟草黑胫病菌敏感性较低,且转入后使本氏烟对烟草黑胫病产生了抗性。
4 结论
在转RSV本氏烟上接种PVX、烟草青枯病菌和烟草黑胫病菌,结果表明表达不影响这3种病原在植株上的症状,但是在一定程度上影响了PVX的积累,同时在一定程度上抑制了青枯病、黑胫病的发生和病害的严重度。研究结果再次佐证了RSV NS3在寄主体内具有病毒RNA沉默抑制子和寄主防卫反应诱导因子双重功能。
[1] COGONI C, MACINO G. Post-transcriptional gene silencing across kingdoms., 2000, 10(6): 638-643.
[2] Azevedo J, Garcia D, Pontier D, Ohnesorge S, Yu A, Garcia S, Braun L, Bergdoll M, Hakimi M A, Lagrange T, Voinnet O. Argonaute quenching and global changes in Dicer homeostasis caused by a pathogen-encoded GW repeat protein., 2010, 24(9): 904-915.
[3] Chen J, Li W X, Xie D, Peng J R, Ding S W. Viral virulence protein suppresses RNA silencing-mediated defense but upregulates the role of microrna in host gene expression., 2004, 16(5): 1302-1313.
[4] Chiu M H, Chen I H, Baulcombe D C, Tsai C H. The silencing suppressor P25 ofinteracts with Argonaute1 and mediates its degradation through the proteasome pathway., 2010, 11(5): 641-649.
[5] Mallory A C, Ely L, Smith T H, Marathe R, Anandalakshmi R, Fagard M, Vaucheret H, Pruss G, Bowman L, Vance V B. HC-Pro suppression of transgene silencing eliminates the small RNAs but not transgene methylation or the mobile signal., 2001, 13(3): 571-583.
[6] Dunoyer P, Lecellier C H, Parizotto E A, Himber C, Voinnet O. Probing the microRNA and small interfering RNA pathways with virus-encoded suppressors of RNA silencing., 2004, 16(5): 1235-1250.
[7] Jay F, Wang Y, Yu A, Taconnat L, Pelletier S, Colot V, Renou J P, Voinnet O. Misregulation ofunderlies the developmental abnormalities caused by three distinct viral silencing suppressors in., 2011, 7(5): e1002035.
[8] Shen W J, Ruan X L, Li X S, Zhao Q, Li H P. RNA silencing suppressor Pns11 ofinduces virus-like symptoms in transgenic rice., 2012, 157(8): 1531-1539.
[9] Wu G T, Wang J Y, Yang Y, DONG B, WANG Y L, SUN G C, YAN C Q, Yan F, Chen J P. transgenic rice expressingNS3 protein, a suppressor of RNA silencing, shows resistance to rice blast disease., 2014, 48(3): 566-569.
[10] Wu G T, Zheng G X, Hu Q, Ma M G, Li M J, Sun X C, Yan F, Qing L. NS3 protein fromaffects the expression of endogenous genes in., 2018, 15: 105.
[11] Yan F, Zhang H M, Adams M J, Yang J, Peng J J, Antoniw J F, Zhou Y J, Chen J P. Characterization of siRNAs derived fromin infected rice plants by deep sequencing., 2010, 155(6): 935-940.
[12] Zhu Y, Hayakawa T, Toriyama S. Complete nucleotide sequence of RNA 4 ofisolate T, and comparison with another isolate and with., 1992, 73(5): 1309-1312.
[13] Wu G T, Lu Y W, Zheng H Y, Lin L, Yan F, Chen J P. Transcription of ORFs on RNA2 and RNA4 ofterminate at an AUCCGGAU sequence that is conserved in the genus., 2013, 175(1): 71-77.
[14] Xiong R Y, Wu J X, Zhou Y J, Zhou X P. Characterization and subcellular localization of an RNA silencing suppressor encoded by., 2009, 387(1): 29-40.
[15] Xu Y, Wu J X, Fu S, Li C Y, Zhu Z R, Zhou X P. Rice stripe tenuivirus nonstructural protein 3 hijacks the 26S proteasome of the small brown planthopper via direct interaction with regulatory particle non-ATPase subunit 3, 2015, 89(8): 4296-4310.
[16] Zheng L J, Zhang C, Shi C N, Wang Y, Zhou T, Sun F, Wang H, Zhao S S, Qin Q Q, Qiao R, Ding Z M, Wei C H, Xie L H, Wu J G, Li Y.protein regulates primary miRNA processing through association with the miRNA biogenesis factor OsDRB1 and facilitates virus infection in rice., 2017, 13(10): e1006662.
[17] 姜良良. 水稻条纹病毒p3蛋白与寄主核定位蛋白NbPip3的互作研究[D]. 南京: 南京农业大学, 2017.
JIANG L L. Studies on interaction between RSV p3 protein and a host nucleus-localized protein Nbpip3[D]. Nanjing: Nanjing Agricultural University, 2017. (in Chinese)
[18] DASGUPTA I, MALATHI V G, MUKHERJEE S K. Genetic engineering for virus resistance., 2003, 84(3): 341-354.
[19] RUBINO L, CAPRIOTTI G, LUPPO R, RUSSO M. Resistance to cymbidium ringspot tombusvirus infection in transgenicplants exprssing the virus coat protein gene., 1993, 21(4): 665-672.
[20] 余晓红, 朱玉贤, 应华澄, 陈章良. 烟草花叶病毒运动蛋白基因的cDNA克隆、序列测定及植物转化. 生物工程学报, 1996, 12(2): 211-214.
YU X H, ZHU Y X, YING H C, CHEN Z L. Molecular cloning, nucleotide sequencing and plant transformation of a cDNA coding for themovement protein., 1996, 12(2): 211-214. (in Chinese)
[21] Pruss G J, Lawrence C B, Bass T, Li Q Q, Bowman L H, Vance V. The potyviral suppressor of RNA silencing confers enhanced resistance to multiple pathogens., 2004, 320(1):107-120.
[22] 郑桂贤. RSV四川分离物p3基因原核表达及其影响本氏烟内源基因表达研究[D]. 重庆: 西南大学, 2018.
ZHENG G X. The study about prokaryotic expression offrom Sichuan RSV isolate andaffects on endogenous gene expression of[D]. Chongqing: Southwest University, 2018. (in Chinese)
[23] 王羽, 肖崇刚. 番茄青枯病病菌无致病力菌株的分离和控病研究. 西南农业大学学报(自然科学版), 2004, 26(4): 426-428.
WANG Y, XIAO C G. Isolation of avirulent strains of bacterial wilt of tomato () and its application in biocontrol of the disease., 2004, 26(4): 426-428. (in Chinese)
[24] 方中达. 植病研究方法. 3版. 北京: 中国农业出版社, 2007.
Fang Z D.. Beijing: China Agriculture Press, 2007. (in Chinese)
[25] 王海波. 两株烟草黑胫病和青枯病拮抗菌的诱变选育[D]. 重庆: 西南大学, 2009.
WANG H B. Study on mutation breeding of two antagonistic bacterium strains against[D]. Chongqing: Southwest University, 2009. (in Chinese)
[26] 马国胜, 高智谋. 烟草黑胫病菌培养性状的研究. 中国农业科学, 2007, 40(3): 512-517.
MA G S, GAO Z M. Cultural characteristics ofvar.pathogen of tobacco blank shank., 2007, 40(3): 512-517. (in Chinese)
[27] 王岩. 烟草黑胫病菌、青枯病菌拮抗放线菌的筛选及控病研究[D]. 重庆: 西南大学, 2009.
WANG Y. Screening and biocontrol effect of antagonistic actinomycetes againstand[D]. Chongqing: Southwest University, 2009. (in Chinese)
[28] KASSCHAU K D, XIE Z, ALLEN E, LLAVE C, CHAPMAN E J, KRIZAN K A, CARRINGTON J C. P1/HC-Pro, a viral suppressor of RNA silencing, interferes withdevelopment and miRNA function., 2003, 4(2): 205-217.
[29] TAKAGI K, NISHIZAWA K, HIROSE A, KURAUCHI T, SENDA M, MASUTA C, ISHIMOTO M. Seed coat pigmentation in transgenic soybean expressing the silencing suppressor 2b gene of., 2013, 32(12): 1903-1912.
[30] 刘玉乐, 王振东, 朱锋, 康良仪, 田波. 表达黄瓜花叶病毒卫星RNA的转基因烟草耐烟草花叶病毒. 微生物学报, 1994, 34(5): 403-405.
LIU Y L, WANG Z D, ZHU F, KANG L Y, TIaN b. Tolerance of the transgenic tobacco expressing satellite RNA ofto., 1994, 34(5): 403-405. (in Chinese)
[31] 刘晓玲, 宋云枝, 刘红梅, 温孚江, 朱常香, 白庆荣. 马铃薯X病毒25 kD运动蛋白基因和外壳蛋白基因介导的抗病性研究. 作物学报, 2005, 31(7): 827-832.
LIU X L, SONG Y Z, LIU H M, WEN F J, ZHU C X, BAI Q R. Virus resistance mediated by the cDNAs encoding for the movement and coat proteins of., 2005, 31(7): 827-832. (in Chinese)
[32] 郭兴启, 韩宏岩, 张杰道, 王洪刚. 转不可翻译PVYNCP基因烟草的抗病性分析. 实验生物学报, 2003, 36(3): 176-184.
GUO X Q, HAN H Y, ZHANG J D, WANG H G. The viral resistance of transgenic tobacco plants containing untranslatable PVYNcoat protein gene., 2003, 36(3): 176- 184. (in Chinese)
[33] ZHANG G, CHEN M, LI L, XU Z, CHEN X, GUO J, MA Y. Overexpression of the soybean GmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco., 2009, 60(13): 3781-3796.
[34] ZHANG G, CHEN M, CHEN X, XU Z, LI L, GUO J, MA Y. Isolation and characterization of a novel EAR-motif-containing genefrom soybean (L.)., 2010, 37(2): 809-818.
[35] JAYNES J M, NAGPALA P, DESTEFANO-BELTRAN L, HUANG J H, KIM J, DENNY T, CETINER S. Expression of a Cecropin B lytic peptide analog in transgenic tobacco confers enhanced resistance to bacterial wilt caused by., 1993, 89(1): 43-53.
[36] 徐莺, 白永延, 卫志明, 许智宏. Shiva A基因在转基因烟草中的表达及其对烟草青枯病菌(pv.)的抗性. 实验生物学报, 1999, 32(1): 73-76.
XU Y, BAI Y Y, WEI Z M, XU Z H. Enhanced resistance of transgenic tobacco expressing Shiva A gene against bacterial wilt disease (pv.)., 1999, 32(1): 73-76. (in Chinese)
[37] HASSAN M, SINDEN S L, KOBAYASHI R S, Nordeen r o, Owens L D. Transformation of potato () with a gene for an anti-bacterial protein, ceropin., 1993, 336: 127-132.
[38] MUKHTAR M S, DESLANDES L, AURIAC M C, MARCO Y, SOMSSICH I E. Thetranscription factor WRKY27 influences wilt disease symptom development caused by., 2008, 56(6): 935-947.
(责任编辑 岳梅)
Disease resistance of-transgenic
WU Gentu, CHEN Guangxiang, ZHANG Jiayuan, HU Qiao, MA Mingge, DOU Yanxia, LI Mingjun, QING Ling
(Chongqing Key Laboratory of Plant Disease Biology, College of Plant Protection, Southwest University, Chongqing 400716)
【Objective】The protein encoded byis a suppressor of RNA silencingof(RSV). In previous study, it was found thatexpression enhanced the resistance ofto RSV using transgenic technology. In order to reveal the detailed function of NS3 in host plants, the resistance of-transgenicto other tobacco diseases will be analyzed in this study.【Method】Wild-typeand-transgenicwere used to study the infection of(PVX),, andvar.. PVX infectious clone was inoculated by agro-infiltration, viral symptoms were observed. The total RNA of infected leaves was extracted, and viral relative accumulation was detected by RT-qPCR. The method of filling root was used to inoculateandvar., respectively, disease symptoms were observed, and the incidence and disease index were analyzed.【Result】The main symptoms of PVX inleaves were mosaic and chlorosis, and the-transgenicplants had the same PVX symptoms as those of wild-type plants. At 10 days past inoculation (dpi), the results of RT-qPCR showed thatexpression inhibited the accumulation of PVX in, the relative accumulation of PVX in NS3-6line and NS3-9 line was 68.17% and 81.01% of that of wild-type,respectively.After the infection of, the symptoms both in wild-type and-transgenicplants were wilting and damping-off.In the early stage of disease, the expression ofwas beneficial to the infectionofto a certain extent, which showed that it was more sensitivity to bacterial wilt. At 14 dpi, the incidence and disease index of bacterial wilt of wild-typewere 100.00% and 78.67, while the incidence of NS3-6, NS3-9 line was 95.00%, 98.33%, and the disease index was 70.00, 73.00, respectively.After 14 dpi, the incidence and disease index increased gradually, while the disease index of-transgenic lines was lower than that of wild-type plants. The black-brown necrotic patches at the base of stem were observed both in wild-type and transgenic plants aftervar.infection, and the expression ofdid not affect the symptoms of. At the early stage ofvar.infection, the incidence of black shank disease in NS3-6 was higher than that of wild-type, however, during the whole process of black shank disease, the disease index of-transgenic lines was lower than that of wild-type. At 12 dpi, the incidence and disease index of black shank diseasein wild-typewere 96.67% and 77.50, while the incidence of NS3-6, NS3-9 line was 90.00%, 86.67%, and the disease index was 64.17, 62.08,respectively.【Conclusion】The observation of pathogen infection process showed that the expression ofaffected the infection and severity of tobacco diseases onto a certain extent, and the effects on different pathogens were also different.
(RSV);; transgenic; disease resistance
10.3864/j.issn.0578-1752.2019.10.005
2019-01-15;
2019-03-04
国家自然科学基金青年科学基金(31601607)、重庆市基础科学与前沿技术研究专项(cstc2017jcyjAX0129)、浙江省植物有害生物防控重点实验室开放基金(2010DS700124-KF1709)
吴根土,E-mail:wugtu6066@swu.edu.cn。通信作者青玲,E-mail:qling@swu.edu.cn
