仙茅苷对成骨细胞增殖分化和炎症因子表达的影响及机制分析
2019-06-11朱芳兵章英良侯桥张治金严世贵
朱芳兵 章英良 侯桥 张治金 严世贵
1.浙江中医药大学附属江南医院/杭州萧山中医院骨科,浙江 杭州 311200 2.浙江大学医学院附属第二医院骨科,浙江 杭州 310009
骨质疏松症以骨量减少、骨组织微结构破坏、骨脆性增加和易于骨折为特征的代谢性骨病,骨质疏松患者一旦发生骨折,严重影响老年人的生活质量和寿命[1]。成骨细胞和破骨细胞在骨骼的发育和骨代谢过程中发挥重要作用,成骨细胞骨形成减少和破骨细胞骨吸收增加,导致骨量丢失及骨质疏松。
仙茅苷作为中草药仙茅中的主要生物活性成分,研究发现其能促进成骨细胞增殖和成骨细胞碱性磷酸酶(alkaline phosphatase,ALP)的活性、减少破骨细胞数、降低抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)的活性和骨吸收作用[2],可用于骨质疏松的治疗[3]。但是仙茅苷(curculigoside,CCG)在模拟骨质疏松体外成骨细胞培养环境中能否抑制炎症因子释放以及正向调控RANKL/RANK/OPG系统,目前仍然不清楚。
本文通过地塞米松(dexamethasone,DEX)构建骨质疏松体外成骨细胞培养体系,系统研究了CCG对DEX诱导的大鼠颅骨成骨细胞增值分化、氧化损伤、炎症细胞因子释放以及RANKL/RANK/OPG系统蛋白表达的影响,以期为CCG发挥防治骨质疏松作用进一步提供理论证据。
1 材料和方法
1.1 主要材料和试剂
必需培养基(DMEM)和胎牛血清(FBS)购于Gibco公司;I型胶原酶购于HyClone公司;Rhodamine-123(Rho-123)染料和DEX购于Sigma公司;ALP活性检测试剂盒和酶联免疫吸附法试剂盒从南京建城生物工程研究所购买;OPG﹑β-catenin、BMP-2和GAPDH抗体购于Abcamm公司;购于美国Santa Cruz的RANKL和RANKL抗体进行Western印迹分析。
1.2 成骨细胞的分离和培养
将新生(3 d)Sprague-Dawley大鼠的颅骨通过顺序酶消化分离成骨细胞。将颅盖骨切碎并在37 ℃下在含有0.4%I型胶原酶的酶溶液中振荡孵育20 min,然后用0.4%I型胶原酶孵育90 min,再用10%FBS停止消化。将细胞分别在含有10%FBS和抗生素(100 mg/mL青霉素G和100 IU/mL链霉素)的DMEM中培养。达到80%~90%汇合后,将细胞从每个培养瓶中取出并合并在一起。
1.3 细胞分组与处理
收集细胞并随机分为5组:对照组(未处理组)、DEX处理组和CCG处理组(25、50和100 μg/mL)。DEX处理组,将细胞与含有1 μmol/L DEX的培养基一起孵育。在CCG组中,细胞与不同浓度的CCG预温育24 h,然后与1 μmol/L DEX一起孵育。
1.4 细胞增殖测定
通过细胞计数试剂盒-8(CCK-8,Dojindo,Kumamoto,Japan)测定评估细胞增殖。将细胞以5×104个细胞/孔的密度接种在96孔板中,并在37 ℃的培养箱中培养12 h。在指定的时间点除去培养上清液,用PBS洗涤细胞,然后向每个孔中加入100 μL与CCK-8溶液混合的新鲜培养基。在37 ℃孵育1 h后,除去含有CCK-8溶液的培养基。使用分光光度计酶标仪(Bio-Tek,Winchester,USA)测量450 nm处的吸光度。
1.5 线粒体膜电位
用四甲基罗丹明甲酯(tetramethyl rhodamine methyl ester,TMRM)染料检测线粒体膜电位(mitochondria membrane potential,MMP)。在6孔板上培养细胞(1×106个细胞/孔)。用不同浓度的CCG(25﹑50和100 μg/mL)处理24 h后,用PBS洗涤细胞,用TMRM(10 nmol/L)孵育,然后进行流式细胞术。
1.6 活性氧检测
用流式细胞术检测活性氧(reactive oxygen species,ROS)。按照5×104个细胞/孔在6孔板中培养细胞,以不同浓度的CCG(25﹑50和100 μ/mL)处理12 h后,用PBS洗涤细胞,再用10 μmol/L DCFH-DA在37 ℃下孵育20 min。用流式细胞仪测定ROS荧光强度,激发波长480 nm,发射波长525 nm。
1.7 ALP活性测定
ALP是骨细胞分化的明确标志。按照制造商的方案使用ALP测定试剂盒检测ALP活性。在520 nm处测定样品和标准样品的吸光度。
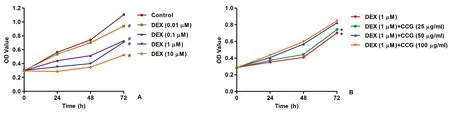
图1 CCG对DEX诱导的成骨细胞损伤的保护作用 A:DEX对细胞增殖的剂量依赖性作用。1 μmol/L DEX显著降低孵育72 h后的细胞增殖;B:CCG预处理(25、50和100 μg/mL,24 h)抑制DEX诱导的细胞损伤。与对照相比,#P<0.05;与DEX组相比,*P<0.05。DEX:地塞米松(下同)。Fig.1 Protective effects of CCG on DEX-induced cell injury in osteoblasts. A: Dose-dependent effect of DEX on cell proliferation. DEX at 1 μM significantly reduced cell proliferation after 72 h of incubation; B: Pretreatment with CCG (25, 50 and 100 μg/mL, 24 h) alleviated DEX-induced cell injury. The data were presented as the mean±SD (n=3); #P<0.05 vs. control without any treatment group, *P<0.05 vs. the DEX only group.
1.8 酶联免疫吸附测定
使用市售鼠特异性夹心酶联免疫吸附试验(ELISA)试剂盒按照制造商的方案测定成骨细胞分泌的TNF-α、IL-1β、IL-6、COX-2、IGF-1和M-CSF水平。
1.9 蛋白质提取和蛋白质印迹(Western blot)
在加1 μmol/L苯基甲基磺酰氟(PMSF)的RIPA缓冲液(Beyotime)中,收集细胞并在冰上溶解30 min。等量的细胞裂解物用SDS-PAGE电泳,用适当的原代和辣根过氧化物酶结合的次级抗体进行Western blot分析。BMP-2(1∶1000)、β-catenin(1∶1000)、RANKL(1∶500)、RANK(1∶1000)、OPG(1∶1000)和GAPDH(1∶1000)在4 ℃下孵育。
1.10 统计学分析
通过GraphPad Prism 5(GraphPad Software,La Jolla,CA)分析并通过t检验评估不同组之间的差异,至少3次独立重复的实验数据采用平均值±标准差表示。P<0.05表示差异有统计学意义。
2 结果
2.1 CCG保护成骨细胞免受DEX诱导的细胞损伤
DEX(0.01~10 μmol/L)以剂量和时间依赖性的方式显著降低细胞增殖,1 μmol/L DEX处理后细胞增殖降低至对照组的35.7%(图1 A)。但研究发现,CCG以25、50和100 μg/mL的剂量预处理24 h显著保护成骨细胞免受DEX诱导的细胞损伤,并与剂量正相关(图1B)。
2.2 CCG提高DEX抑制的成骨细胞分化
如图2A所示,DEX诱导的成骨细胞的ALP活性略有下降。用CCG以25、50和100 μg/mL的剂量预处理成骨细胞24 h显著增强ALP的活性(图2B)。如图3所示,用DEX(1 μmol/L)处理刺激了RANKL和RANK的表达,并且抑制了OPG、BMP-2、β-catenin、IGF-1和M-CSF的表达。然而,剂量为25、50和100 μg/mL的CCG显著下调DEX刺激的RANKL和RANK表达,但是增加成骨细胞中OPG、BMP-2、β-catenin、IGF-1和M-CSF的表达。
2.3 CCG抑制DEX诱导的线粒体凋亡途径
MMP的缺失与线粒体凋亡途径有关。如图4 A所示,DEX(1 μmol/L)处理成骨细胞可引起MMP中度去极化。然而,CCG处理24 h后,呈剂量依赖性提高MMP水平。另一方面,活性氧的生成也与线粒体有关。如图4B所示,DEX(1 μmol/L)处理成骨细胞后,细胞内活性氧积累明显增加。而CCG处理24 h后,剂量依赖性地显著降低ROS的积累。
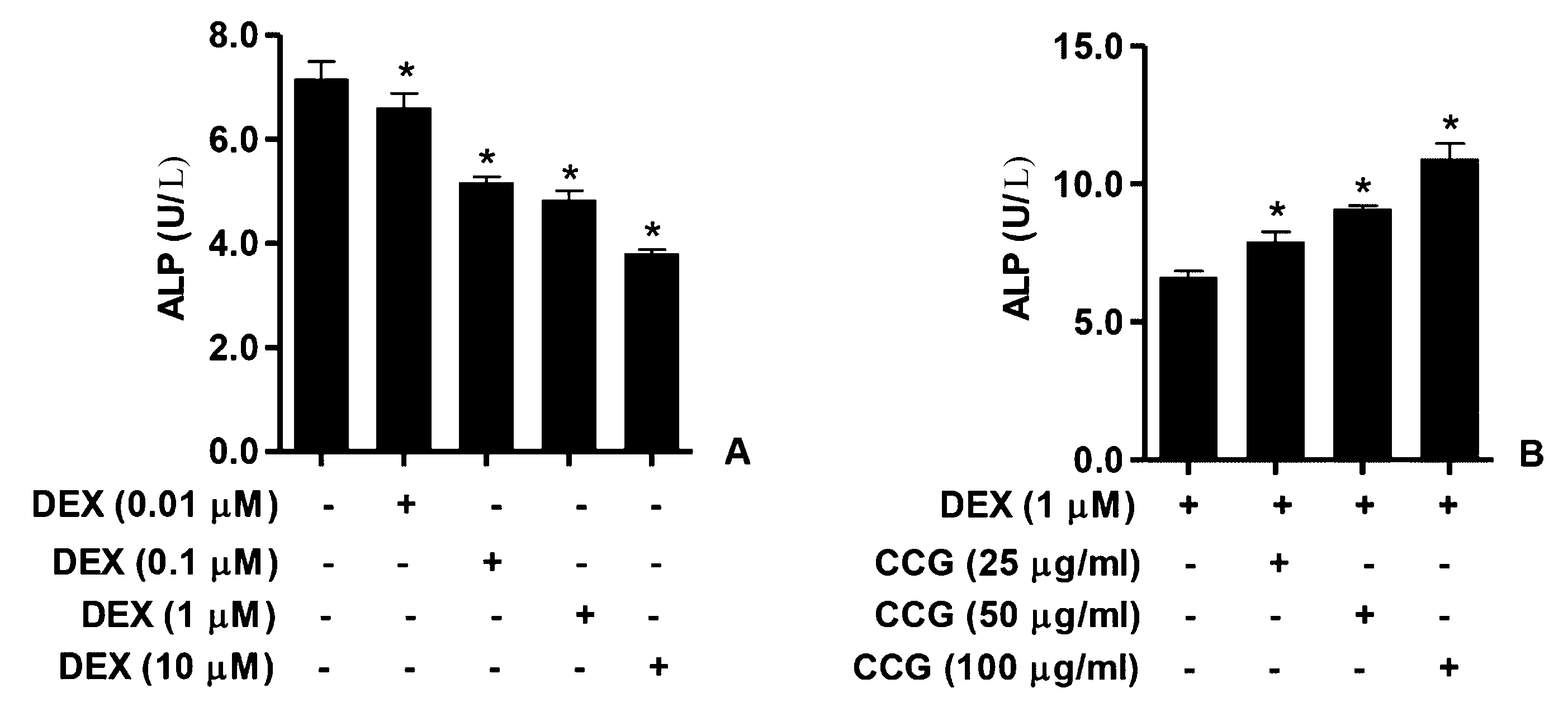
图2 在DEX条件下CCG改变ALP的活性 A:用含有0﹑0.01﹑0.1﹑1或10 μmol/L DEX的培养基处理细胞,ALP活性降低;B:细胞用25﹑50和100 μg/mL的CCG预处理24 h,然后与另外的1 μmol/L DEX一起温育。与对照相比,#P<0.05;与DEX组相比,*P<0.05。Fig.2 The activity of ALP is altered by CCG under DEX condition. A: The cells were treated with medium containing 0, 0.01, 0.1, 1 or 10 μM of DEX and the activity of ALP was decreased; B: The cells were pretreated with 25, 50 and 100 μg/mL of CCG for 24 h, and then incubated with an additional 1 μM of DEX. The data were presented as the mean±SD (n=3); #P<0.05 vs. control without any treatment group, *P<0.05 vs. the DEX only group.
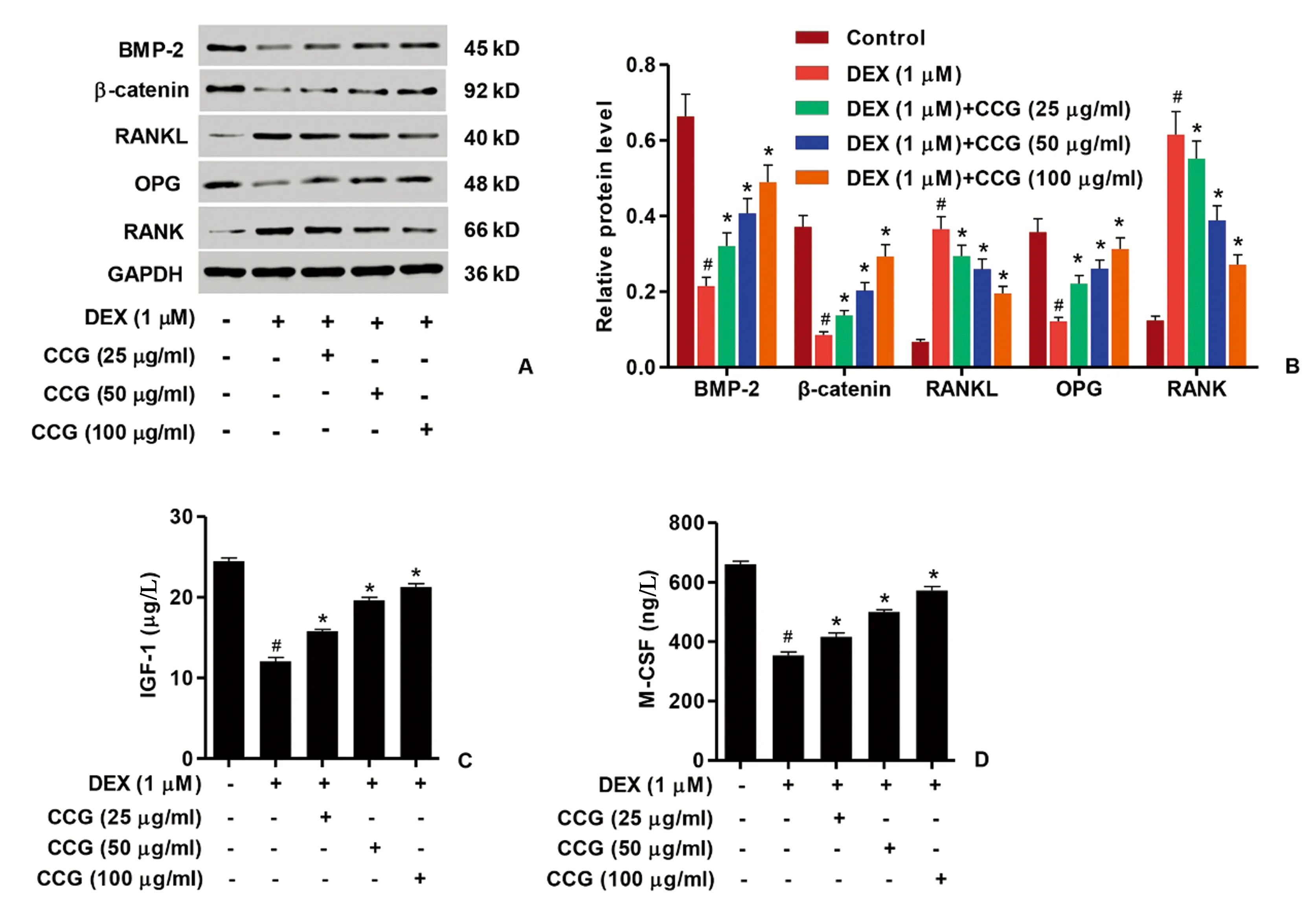
图3 CCG对成骨细胞分化相关标志物表达的影响 A、B:5个处理组中BMP-2、β-catenin、RANKL、OPG和RANK表达谱的蛋白质印迹(左)和定量分析(右);C、D:ELISA分析5组中的IGF-1和M-CSF蛋白质表达。与对照相比,#P<0.05;与DEX组相比,*P<0.05。Fig.3 The effects of CCG on the expression of osteoblastic differentiation associated markers. A, B: Western blotting (left) and quantification (right) of BMP-2, b-catenin, RANKL, OPG and RANK expression profiles in five treatment groups; C, D: ELISA analyzed IGF-1 and M-CSF protein expression in five treatment groups. The data were presented as the mean±SD (n=3); #P<0.05 vs. control without any treatment group, *P<0.05 vs. the DEX only group.
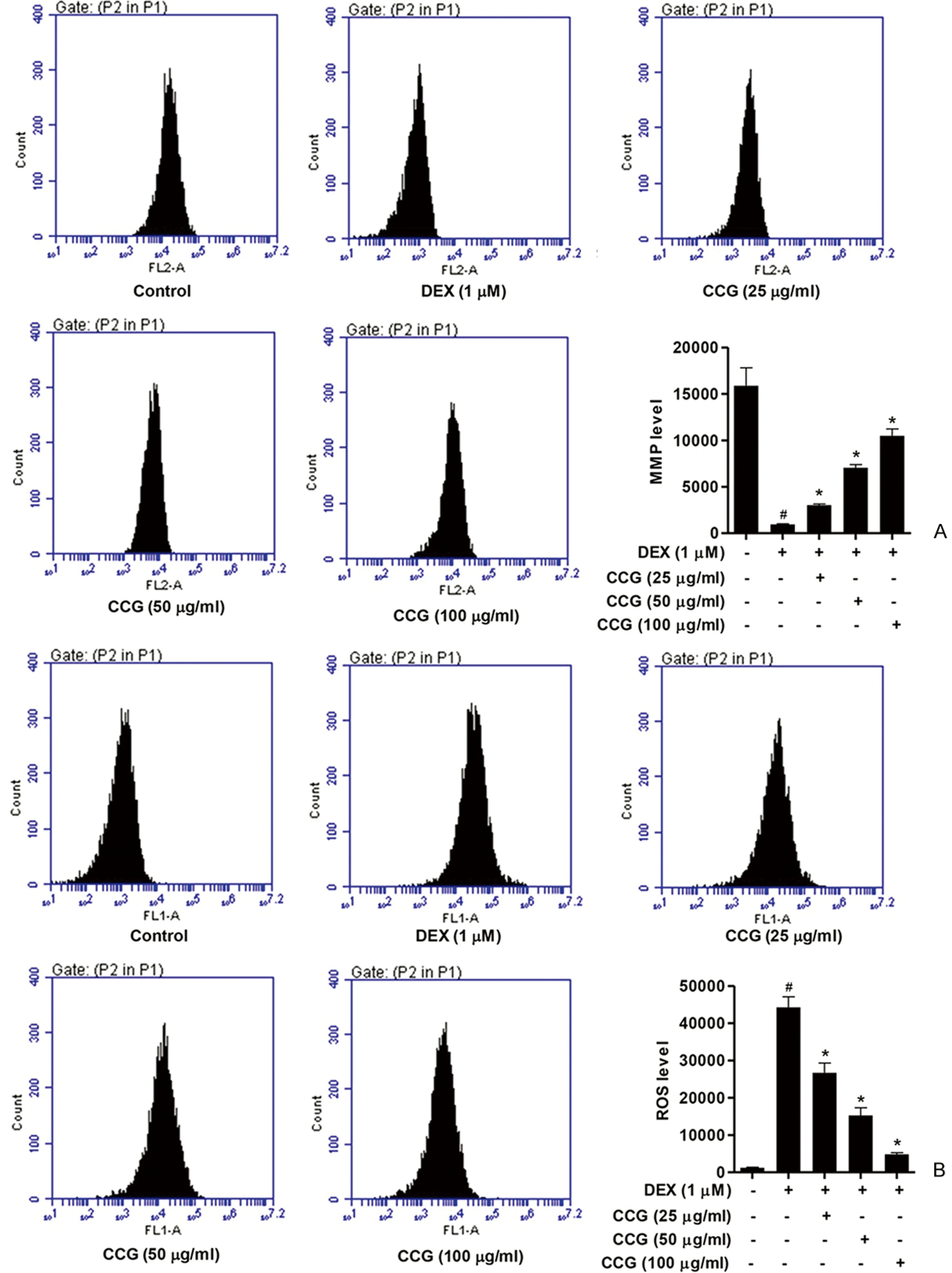
图4 CCG对DEX诱导成骨细胞MMP和ROS的影响 A:DEX诱导的成骨细胞分别予以25、50和100μg/mL的CCG预处理24 h,然后用TMRM孵育,流式细胞仪分析;B:将DEX诱导的成骨细胞分别予以25、50和100μ/mL的CCG预处理24 h,用荧光探针DCFH-DA测定ROS的生成水平。与对照相比,#P<0.05;与DEX组相比,*P<0.05。Fig.4 The effects of CCG on MMP and ROS in DEX-induced osteoblasts. A: DEX-induced osteoblasts were pretreated with CCG for 24 h at 25, 50 and 100 μg/mL respectively, then incubated with TMRM and analyzed by flow cytometry; B: DEX-induced osteoblasts were pretreated with CCG for 24 h at 25, 50 and 100 μg/mL respectively, and fluorescence probe DCFH-DA was used to determine the levels of ROS production. The data were presented as the mean±SD (n=3); #P<0.05 vs. control without any treatment group, *P<0.05 vs. the DEX only group.
2.4 CCG对DEX诱导的成骨细胞中促炎细胞因子表达的影响
如图5所示,DEX(1 μmol/L)治疗可增加TNF-α、IL-1β、IL-6和COX-2的表达。与DEX治疗组相比,CCG以剂量依赖性的降低炎症因子如TNF-α、IL-1β、IL-6和COX-2的表达。
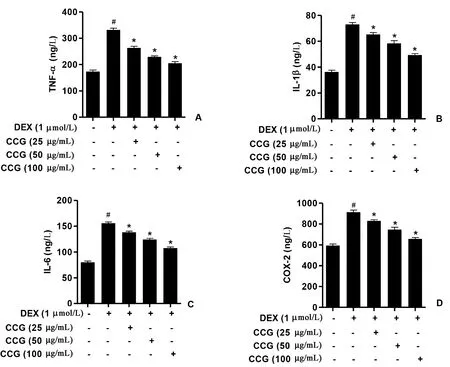
图5 CCG对促炎细胞因子表达的影响。在5组中TNF-α(A)、IL-1β(B)、IL-6(C)和COX-2(D)蛋白表达的ELISA分析。与对照相比,#P<0.05;与DEX组相比,*P<0.05Fig.5 The effects of CCG on the expression of pro-inflammatory cytokines. ELISA analysis of TNF-α (A), IL-1b (B), IL-6 (C), and COX-2 (D) protein expression in five treatment groups. The data were presented as the mean±SD (n=3); #P<0.05 vs. control without any treatment group, *P<0.05 vs. the DEX only group.
3 讨论
3.1 CCG对氧化应激的影响
成骨细胞骨形成和破骨细胞骨吸收在骨重塑过程中发挥关键作用,受多种因素的调控,包括雌激素、炎症和氧化应激[4-5]。氧化应激被认为是导致各种退行性疾病(如动脉粥样硬化、骨质疏松症和癌症)的重要原因,这些患者中氧化应激相关标志物的水平显著增加[6]。在细胞水平,氧化应激激活一系列的信号传导途径诱导细胞从增殖、分化到凋亡的广泛损伤[7]。先前的研究表明,DEX抑制骨髓来源的人间充质干细胞和MC3T3-E1细胞中成骨细胞的分化过程[8]。本研究同样证实DEX明显抑制成骨细胞的分化,降低成骨细胞ALP活性。而CCG明显减少ROS产生,提高MMP水平,促进成骨细胞增值和分化。类似的,也有文献报道发现,当CCG和过氧化氢同时处理成骨细胞时,CCG明显抑制过氧化氢对成骨细胞的氧化损伤,促进成骨细胞分化,增强成骨细胞活性[9]。这些结果表明CCG有效保护成骨细胞免受氧化应激损伤,促进成骨细胞增值分化和增强成骨活性,有望提高骨密度用以骨质疏松症治疗。
3.2 CCG对RANKL/OPG系统的影响
成骨细胞不仅参与骨形成,还通过产生RANKL和OPG来调节破骨细胞的形成、分化和骨吸收活性[10-11]。RANKL/RANK/OPG系统不仅参与调节生理性骨重建,也与病理条件下多种骨病的发生密切相关。RANKL主要由成骨细胞和骨髓基质细胞分泌,与破骨前体细胞或破骨细胞表面上的膜受体RANK结合后,引起一系列细胞生物学反应,促进破骨细胞的分化成熟及骨吸收活性。OPG又称破骨细胞分化抑制因子,主要由成骨细胞和骨髓基质细胞分泌,OPG作为RANKL的诱饵受体,可通过与RANK竞争性结合RANKL,从而阻断骨吸收信号的传递,抑制破骨细胞分化成熟和成熟破骨细胞的骨吸收活性并诱导其凋亡。因此,RANKL/OPG比例协调是调节局部骨代谢平衡的关键。研究发现,CCG提高人羊水源性干细胞成骨分化过程中的碱性磷酸酶活性和钙沉积,提高OPG与RANKL的比值,上调β-catenin表达[12]。本研究同样发现CCG提高OPG与RANKL的相对比值,提示CCG可能有效抑制破骨细胞的生成,但尚需要进一步研究证实。
3.3 CCG对炎症因子释放的影响
各种炎症细胞因子如TNF-α、IL-1β、IL-6在调节破骨细胞以及骨质疏松发生发展中发挥重要的调控作用[13-17]。在骨质疏松性骨折女性中,促破骨细胞生成性细胞因子TNF-α、IL-1β和IL-6的表达明显高于正常绝经后妇女[18]。TNF-α能促进已经与RANKL结合的破骨细胞前体细胞分化为破骨细胞;也能直接激活成熟破骨细胞,抑制破骨细胞凋亡,增加成熟破骨细胞成活率[18]。本文结果显示,CCG减少了细胞因子TNF-α、IL-1β、IL-6和COX-2表达,提示CCG也可能通过抑制促炎性细胞因子表达抑制破骨细胞生成。
综上所述,CCG保护成骨细胞免受DEX诱导的氧化应激损伤,促进成骨细胞增值分化和提高成骨活性,同时抑制促破骨细胞生成细胞因子表达及正向调控OPG与RANKL比值以抑制破骨细胞生成。这些结果为CCG影响骨代谢过程提供了新的见解,提示CCG可作为一种新的选择用于预防和治疗骨质疏松症。
