不同微生物菌剂对田间西红柿品质以及土壤酶活性的影响
2019-06-10鲁凯珩金清曹沁李珊珊孙舒荣蒋秋艳金杰人凌丽晨符歆灏杜萱肖明
鲁凯珩 金清 曹沁 李珊珊 孙舒荣 蒋秋艳 金杰人 凌丽晨 符歆灏 杜萱 肖明
摘 要: 对贝莱斯芽孢杆菌(Bacillus velezensis)S3-1与桔黄假单胞菌(Pseudomonas chlororaphis subsp. aurantiaca)JD37进行测定发现:两者都具有良好的促生能力.将两者制备成相应的液体肥料,施加于种植西红柿的土壤中,发现S3-1能更显著提升西红柿果实中的可溶性糖、可溶性蛋白、可滴定酸、抗坏血酸的含量.对西红柿根际土壤进行平板涂布,发现S3-1能够有效地阻挡更多微生物,尤其是细菌进入植物的根际.使用S3-1生物肥料后,西红柿的干重、根长未见明显变化.进一步的研究显示:S3-1生物肥料显著降低了土壤的脲酶活性,却对土壤蔗糖酶活性没有太大的影响.
关键词: 贝莱斯芽孢杆菌(Bacillus velezensis); 桔黄假单胞菌(Pseudomonas chlororaphis subsp. aurantiaca); 菌种性质; 果实品质; 土壤酶活性
中图分类号: Q 93文献标志码: A文章编号: 1000-5137(2019)02-0197-10
0 引 言
西红柿(Lycopersicon esculentum Mill.)栽培广泛,且随着蔬菜种植业的发展,其种植面积还在不断扩大,生产效益显著[1-2].施用化肥能够有效地提升西红柿的产量,但是过度施用也会造成土壤的酸、碱化,破坏土壤微生物区系和自然农业的生态系统.微生物肥料是一种含有相应活性微生物的生物制剂,具有无毒、无污染的特性,具有广阔的应用前景[3].
芽孢杆菌(Bacillus)具有良好的促生能力,可通过浸种、浇施、灌根等多种方法在多种蔬菜、果树和作物上使用.解淀粉芽孢杆菌Sneb709能有效地促进西红柿果实的质量[4];以芽孢杆菌为主要成分的仙丰168经过200倍稀释,能有效提升西红柿的株高[1];解淀粉芽孢杆菌B1619则提升了西红柿幼苗的株高、鲜重、干重等[5].但贝莱斯芽孢杆菌(Bacillus velezensis)对于西红柿的促生影响以及对土壤酶活性的影响还鲜有报道.
假单胞菌(Pseudomonas)是一类重要的土壤微生物,其在不同的土壤微生物群落中的占比为1%~34%,同时也是一类重要的植物根际促生菌(PGPR),常作为生防细菌以及促生细菌来使用[6-7].现阶段假单胞菌的促生作用主要集中在小麦、蒌蒿[8]、蘑菇[9]等作物上,关于其对西红柿的影响的研究则侧重于病害防治方面,而关于其对西红柿的促生能力的报道较少.
本实验研究了两株菌株贝莱斯芽孢杆菌(B.velezensis)S3-1与桔黄假单胞菌(Pseudomonas chlororaphis subsp. aurantiaca)JD37对于西红柿品质以及土壤酶活性的影响之间的差异,希望为后续的微生物肥料的制备与应用提供理论依据.
1 材料与方法
1.1 实验材料西红柿S18-02幼苗由上海师范大学种质资源中心提供,贝莱斯芽孢杆菌S3-1(B.velezensis)与桔黄假单胞菌JD37(P.chlororaphis subsp.aurantiaca)由上海师范大学微生物与分子生物学实验室保藏.实验试剂包括:铬天青S(Chromeazurol S)固体平板,NBRIP溶磷固体培养基,ADF培养基,无菌脱脂牛奶培养基,salkowski试剂,Luria-Bertani(LB)液体培养基,Kings Medium B(KMB)液体培养基,高氏一号培养基,孟加拉红培养基,牛肉膏蛋白胨(NB)培养基.
1.2 菌种性质鉴定[10-11]将4 ℃下保藏在平皿中的S3-1与JD37分别接种至LB液体培养基与KMB液体培养基中,活化24 h后得到种子液.接种至新的LB与KMB培养基中再培养24 h后得到发酵液,用移液枪小心地吸取1 μL发酵液點于CAS固体平板、NBRIP溶磷固体培养基上,观察其是否是产铁载体和其溶磷的能力.将上述溶液进行梯度稀释后吸取100 μL均匀地涂布在ADF培养基(培养基现配现用,无法加热重复使用)中,若干天后观察是否有菌落产生.利用salkowski法测定细菌产吲哚乙酸(IAA)的能力.
1.3 菌株生物信息学分析将S3-1和JD37分别与已有文献中证明具有植物促生能力的芽孢杆菌与桔黄假单胞菌根据16S rDNA构建系统发育树,以便对其应用潜力进行分析.
1.4 大田实验设计于2018年4月—7月开展大田实验.大田共分为6块,每块面积为1.5 m×3.5 m,纵向间隔35 cm移栽一株西红柿幼苗,横向间隔30 cm移栽一株西红柿幼苗,每块地共移栽45株幼苗,总计移栽幼苗180株(图1).按上文方式活化S3-1与JD37后,以1%的接种量接种于新的LB与KMB液体培养基中,过夜培养24 h,得到发酵液.空白对照使用未经接种的LB与KMB液体培养基.将两者均以1∶50的体积比加水稀释[12].每隔7 d以灌根的方式对西红柿进行菌液浇灌,每天在每块地块定量浇水10 L以保持土壤湿润.
1.5 西红柿根际可培养微生物数量及其根长、株高和植株干重的测定种植前采集土壤样品A,待到西红柿成熟时将西红柿植株连根拔出,收集其根系土壤B[13].将1 g土壤置于9 mL无菌水中,震荡均匀,再取1 mL溶液至9 mL无菌水中,该过程重复3次,分别制备成体积分数为1×10-3与1×10-4的混悬液α,β.用移液枪取100 μL混悬液β分别涂布于NB固体培养基与高氏一号固体培养基上,计数细菌与放线菌;吸取100 μL混悬液α涂布于孟加拉红固体培养基,计数真菌数量;待菌体形成明显菌落后,记录菌落数[14].
通过以下公式来观察不同处理组西红柿根际可培养微生物数量的变化:其中,C为变化率,a为土壤A中的微生物数量,b为土壤B中的微生物数量.将西红柿植株在烘箱内以105 ℃恒温烘干至恒重后测量其根长、株高和干重.
1.6 西红柿果实品质的测定
采集同一批成熟的西紅柿果实,进行匀浆后,使用手持式折光仪分别测定其可溶性固形物;用滴定法测定其可滴定酸;用二氯酚靛酚染料滴定法测定其抗坏血酸;用蒽酮法测定其可溶性糖;用考马斯亮蓝比色法测定其可溶性蛋白;用紫外分光光度法测定其硝酸盐的含量[15].
1.7 土壤酶活性测定
对根际土壤分别测定了脲酶和蔗糖酶的酶活性[16].
1.8 实验数据处理
使用以下软件处理数据:SPSS 24.0,Origin 2017,MEGA7.0.21.
2 结果与分析
2.1 菌种性质
图2(a)为得到的IAA质量浓度与535 nm波长下吸光度(即光密度OD535)值的标准曲线,图2(b)为利用标准曲线得到的S3-1与JD37产IAA的量随时间变化的趋势图.由图2可知:S3-1的IAA最高产量虽不如JD37,且也不能快速地产生IAA,但其最高产量(7.80 μg·mL-1)能维持2 d才出现缓慢下降;而JD37能快速达到其最高产量(8.75 μg·mL-1),但其下降也非常迅速,第3 d开始处于较稳定阶段时其IAA产量已经较低.所以S3-1相较于JD37,在产IAA的能力方面稳定性更强,更为可靠.
S3-1与JD37都具有产蛋白酶的活性以及产1-氨基环丙烷-1-羧酸脱氨酶(ACC)脱氨酶的活性,而S3-1具有产铁载体的能力,JD37具有溶磷活性.以上性质均是良好的植物促生细菌所具有的能力,所以适合后续实验的开展.
2.2 菌种生物信息学分析
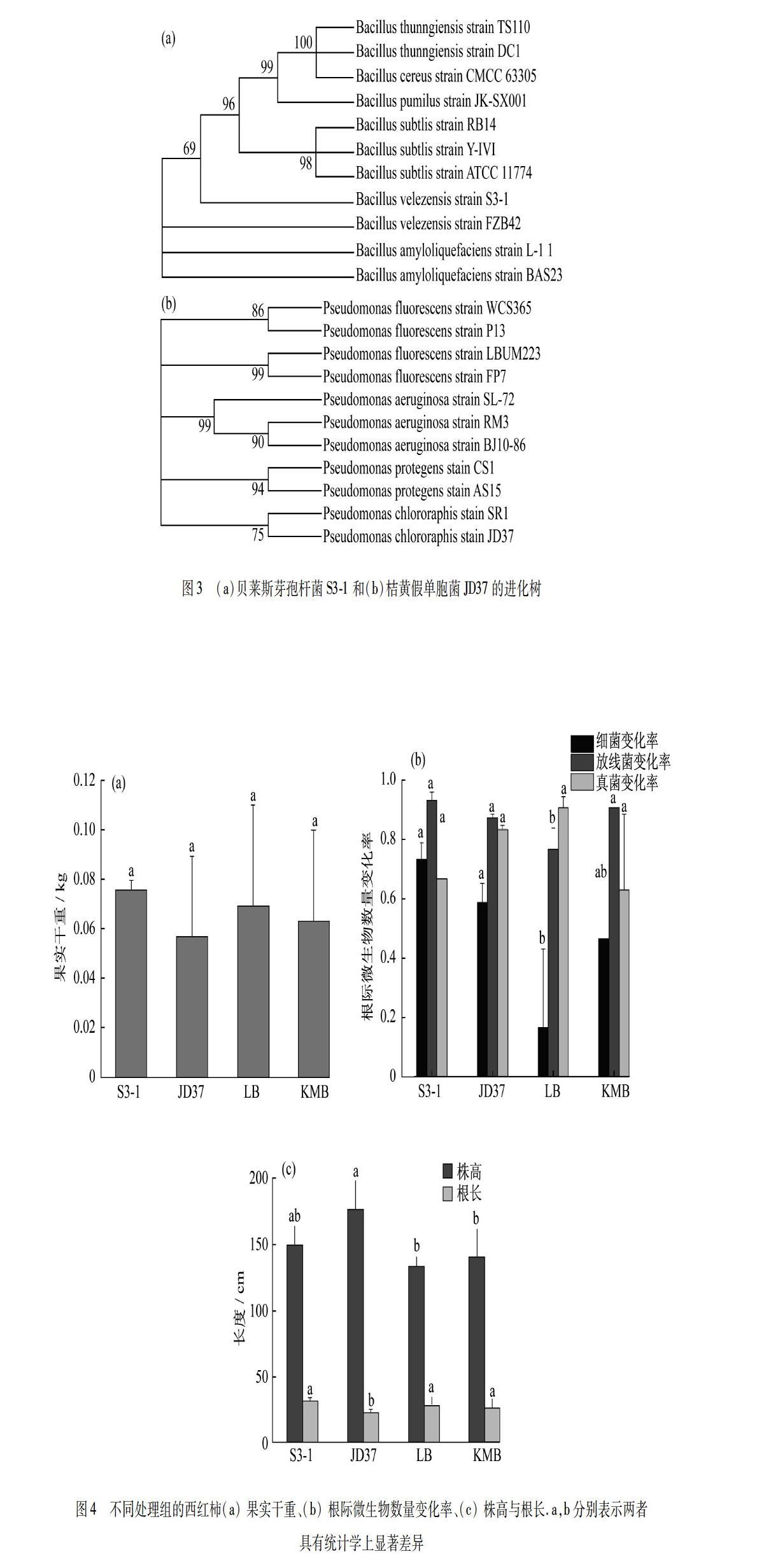
通过与已知的具有植物促生能力的功能菌株[17-31]进行比对发现,S3-1与JD37与这些菌株的亲缘关系较近(图3).例如:桔黄假单胞菌SR1是一种已有报道可用于大豆的生物防治以及促生的菌株,JD37与其具有较近的亲缘关系,说明该菌株在生物防治与促生应用方面可能具有良好的潜力[32].
2.3 西红柿果实干重、根际可培养微生物数量变化率及其根长、株高的测定结果
不同处理组的果实干重、根际微生物数量变化率、根长和株高分别如图4(a)~4(c)所示.
由图4可知:S3-1与JD37菌液并没有对提高西红柿的果实干重起到显著的促进作用;JD37对增加西红柿株高有显著效果,同时也抑制了西红柿根部的生长(p<0.05).而S3-1对于西红柿株高与果实干重的影响与不接种菌株的LB培养基相比的差异并不显著.由于植物根际存在根际效应,所以其微生物数量仅有非根际土壤中的5%左右,绝大部分文献均以富集率来表示根际微生物的根际效应[33].但这种方式却忽略了不同地块本身存在的微生物数量之间的差异,因此本实验采用变化率来表征根际微生物数量的变化.施加S3-1,JD37的处理组与未接种细菌的对照组相比,其细菌、放线菌的变化率均显著增高(p<0.05).
2.4 果实品质测定结果
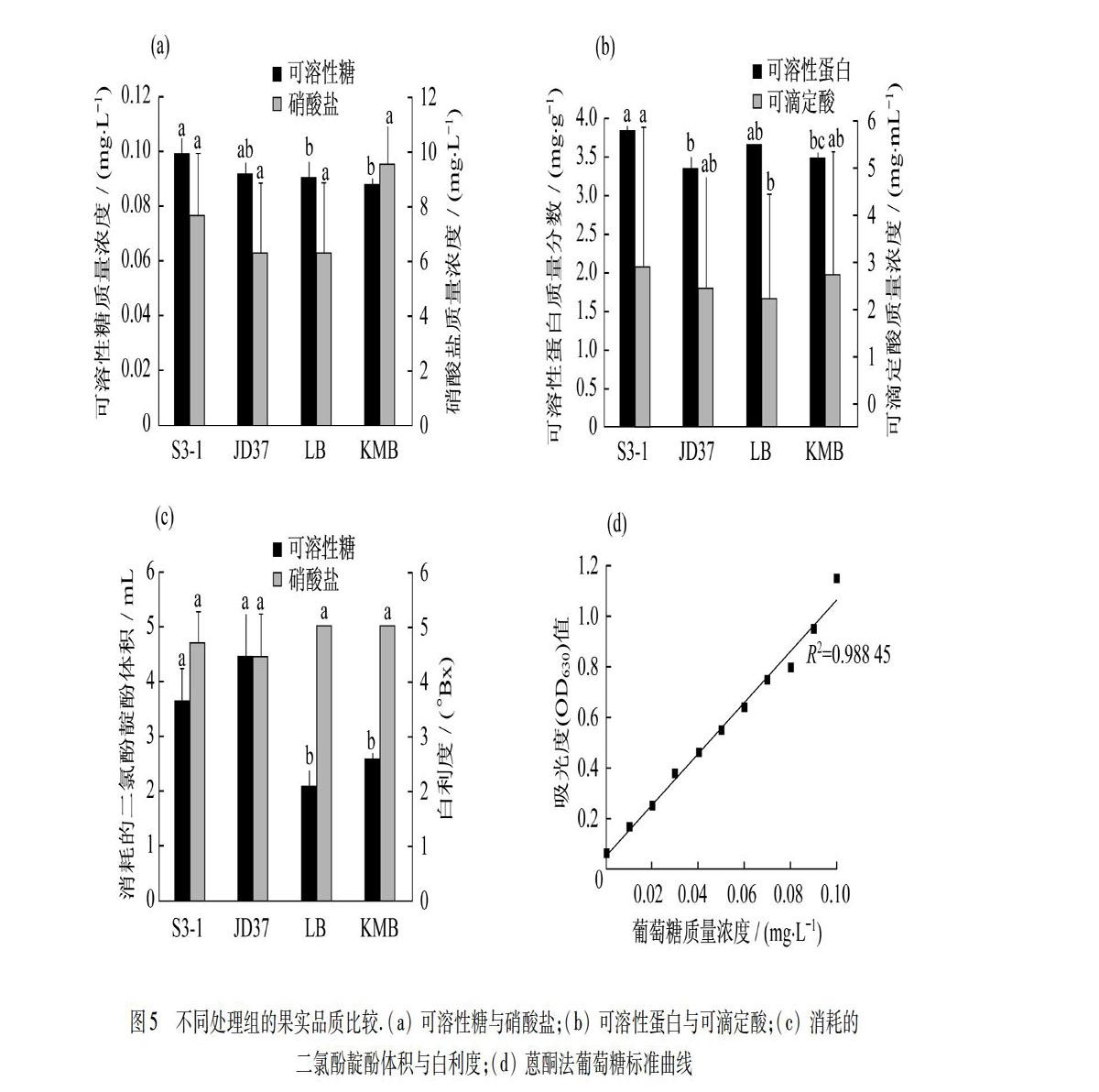
施加了S3-1的处理组,其可溶性糖质量浓度比仅施加LB基质的对照组显著提升(p<0.05),但是与施加JD37的处理组相比,提升并不显著,而施加JD37的处理组与仅施加KMB基质的对照组的可溶性糖质量浓度相比并没有显著差异.就硝酸盐质量浓度而言,4个组均没有显著的差异(p>0.05),如图5(a)所示.施加S3-1的处理组相较于只施加LB基质的对照组,在可溶性蛋白质量分数的提升上并不显著(p>0.05),但是与施加JD37的处理组与仅施加KMB基质的对照组相比,可溶性蛋白质量分数显著提升(p<0.05).施加了S3-1的处理组的可滴定酸质量浓度与仅施加LB基质的对照组相比显著上升(p<0.05),但与施加JD37的处理组与仅施加KMB基质的对照组相比,提升并不显著(p>0.05),如图5(b)所示.本实验用消耗的二氯酚靛酚体积来表示抗坏血酸含量,施加了S3-1,JD37的处理组与仅施加基质的对照组相比,均显著提升了西红柿的抗坏血酸含量(p<0.05).而4个组白利度(表征可溶性固形物含量)影响差异均不显著(p>0.05),如图5(c)所示.
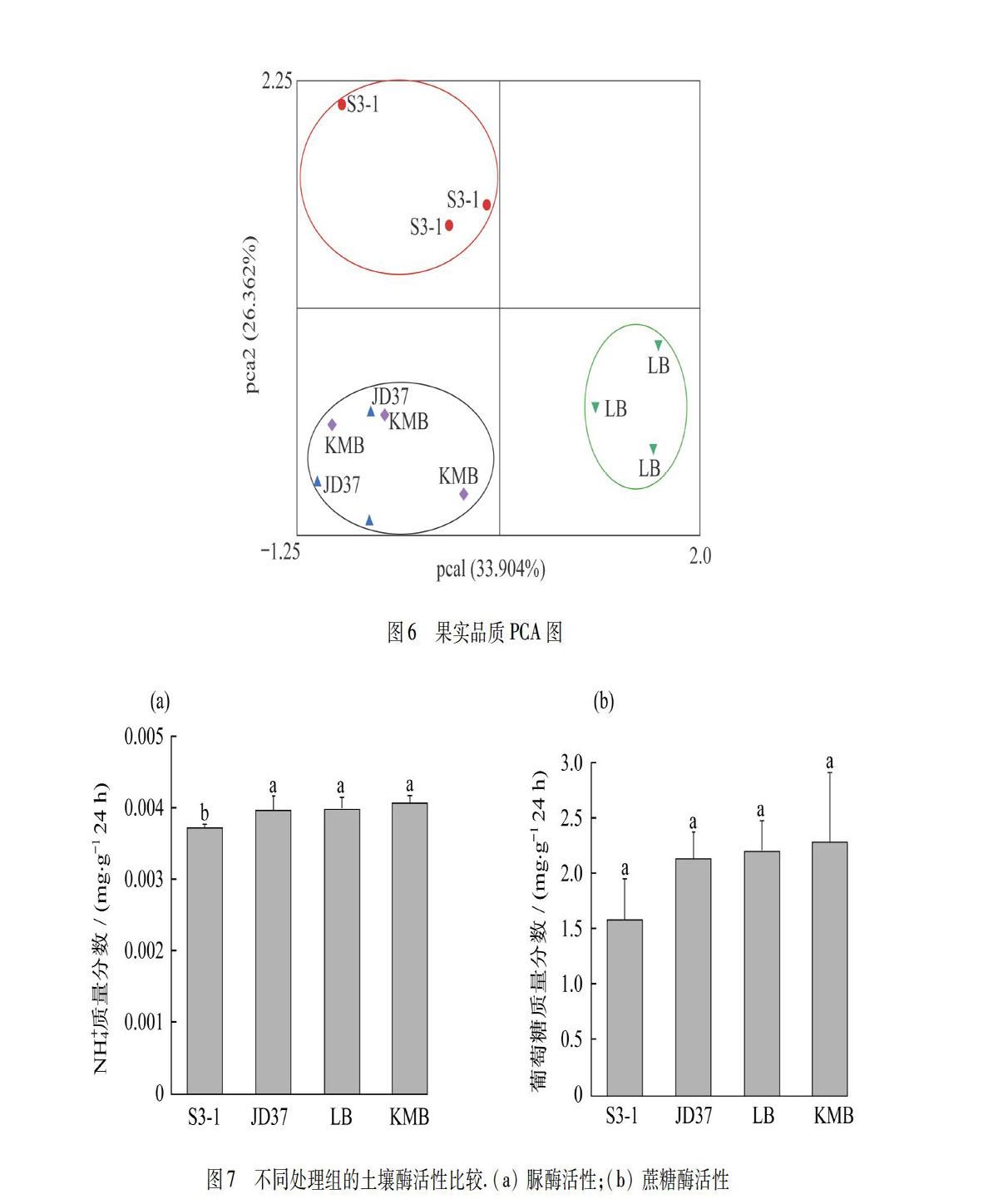
图6为果实品质主成分分析(PCA)图.由图6可知,横坐标解释了33.904%的变异度,纵坐标解释了26.362%的变异度,具有比较良好的解释度.施加S3-1的处理组的果实品质明显聚为一类,仅施加LB基质的对照组的果实品质聚为一类,而施加JD37的处理组与仅施加KMB基质的对照组的果实品质无法区分,表明两者之间的差异并不明显.因此S3-1能较好地提升西红柿的果实品质,而浇灌LB基质也具有一定的促生作用.
2.5 对土壤酶活性的影响
施加 S3-1的处理组在3个月后,与仅施加KMB基质的对照组相比,土壤中的脲酶活性(用NH+4 的质量分数表征)显著降低(p<0.05),但S3-1对蔗糖酶活性(用葡萄糖的质量分数表征)的影响并不显著(p>0.05),如图7所示.
3 讨 论
IAA是植物体内普遍存在的生长激素,该生长激素在一定浓度条件下能够促进植物的生长发育[34].而蛋白酶能够转化土壤中的氮素,使其更易利用.同时,ACC脱氨酶能够将抑制植物生长的乙烯分解成氨和α-酮丁酸,从而保护植物免受胁迫[35].溶磷能力能够将土壤中的难溶性的磷转换成水溶性磷,从而提升土壤的质量[36].铁在地球上多以难溶性的氧化物形式存在,所以铁离子的高效获取对植物的生长至关重要[37].通过测定发现,S3-1与JD37均具有以上促生能力,且通过对比已有文献报道系统发育树,发现两株菌株也具有非常良好的生物防治潜力.
土壤中微生物数量的变化率可作为土壤环境质量评价的指标[38].通过田间实验发现,更多可培养的细菌与放线菌被根际效应阻挡,说明施加S3-1与JD37增加了西红柿根际的选择性.当然这也有可能是由于S3-1与JD37具有较强的定殖能力,从而抢占了其他细菌与放线菌原本的生态位.两种菌剂对于真菌数量变化率的影响并不明显,其原因可能为两株菌与真菌均不处于同一生态位,或者两者之间的相互关联效应较弱.
3个月后,施加S3-1的处理组与对照组相比,西红柿果实中的可溶性糖、可溶性蛋白、可滴定酸、抗坏血酸的含量分别提升了5%,31%,11%,50%,这与侯乐梅等[39]的研究结果的趋势是一致的.说明施加S3-1能够有效提升西红柿果实的品质,这可能是贝莱斯芽孢杆菌在土壤中的存活能力与抗逆性更强所导致的[40].而仅施加LB培养基的土壤也能略微提升果实品质,但效果并不明显.推测其原因可能是LB培养基也吸引了来自土壤中的芽孢杆菌属细菌.相较之下,施加JD37的处理组与仅施加KMB培养基的对照组的果实品质提升并不显著,这可能是由于JD37在土壤中的适应性相对较差,而KMB培养基无法吸引土壤中有提升果实品质能力的微生物.所以就应用方向而言,贝莱斯芽孢杆菌更适合作为微生物肥料.
酶是土壤或基质中生物活性最强的部分,反映了土壤或基质中各种生化过程的强度.酶活性可以作为评价土壤或基质肥力状况的生物活性指标[39].曹银珠等[41]研究表明脲酶的活性较低,可以有效地降低田间氮素的损失.本研究中发现施加S3-1能显著地降低土壤中脲酶的活性(p<0.05),所以推测S3-1能够有效地留存土壤中的氮素,从而提升果实的品质.而土壤中的蔗糖酶对土壤的碳循环有显著影响,但本研究中发现4组处理组的蔗糖酶活性并没有显著性的差异.植物根际的微生物变化率显示S3-1可能替代了土壤根际中与氮循环相关的微生物,因此S3-1能抑制土壤中的氮循环,但对土壤中的碳循环没有明显的抑制作用.
4 结 论
研究了贝莱斯芽孢杆菌S3-1与桔黄假单胞菌JD37的促生能力,结果显示:贝莱斯芽孢杆菌S3-1能够更有效地提升西红柿的可溶性糖、可滴定酸、可溶性蛋白等物质的含量,也能增加根际可培养微生物的变化率,同时能够降低土壤的脲酶活性以减少氮素损失.相较于桔黄假单胞菌,贝莱斯芽孢杆菌S3-1有更强的定殖能力抢占生态位,更稳定的产IAA能力,以及通过改变土壤酶活性来提升植物的果实品质,更适合作为微生物肥料.
参考文献:
[1] 尹显慧,田雪莲,龙友华,等.微生物菌剂对番茄生长发育及产量的影响 [J].湖北农业科学,2016,55(6):1466-1469.
YIN X H,TIAN X L,LONG Y H,et al.Effects of microbial agents on growth and yield of tomato [J].Hubei Agricultural Sciences,2016,55(6):1466-1469.
[2] 赵雯,李金叶.中国番茄国际竞争力分析 [J].新疆社会科学(汉文版),2008(6):19-21.
ZHAO W,LI J Y.Analysis of Chinese tomato international competitiveness [J].Xinjiang Social Sciences (Chinese Edition),2008(6):19-21.
[3] 孟瑶,徐凤花,孟庆有,等.中国微生物肥料研究及应用进展 [J].中国农学通报,2008,24(6):276-283.
MENG Y,XU F H,MENG Q Y,et al.Progress in research and application of microbial fertilizers in China [J].Chinese Agricultural Science Bulletin,2008,24(6):276-283.
[4] 赵惠,范海燕,赵丹,等.芽孢杆菌Sneb709控制番茄根结线虫病及其促生效果研究 [J].中国植保导刊,2018,38(7):13-19.
ZHAO H,FAN H Y,ZHAO D,et al.Study on the control of tomato root-knot nematode disease by Bacillus Sneb709 [J].China Plant Protection Guide,2018,38(7):13-19.
[5] 杨晓云,陈志谊,蒋盼盼,等.解淀粉芽孢杆菌B1619对番茄的促生作用 [J].中国生物防治学报,2016,32(3):349-356.
YANG X Y,CHEN Z Y,JIANG P P,et al.Promoting effect of Bacillus amyloliquefaciens B1619 on tomato [J].Chinese Journal of Biological Control,2016,32(3):349-356.
[6] MEENA V S,MISHRA P K,BISHT J K,et al.Agriculturally Important Microbes for Sustainable Agriculture [M].2017,Singapore:Springer.
[7] KESWANI C,SINGH H B,SARMA B K.Advances in PGPR Research [M].Wallingford:CABI Publishing,2017.
[8] 楊杉杉.假单胞菌BP16的分离鉴定及其植物促生性状和效应 [J].微生物学通报,2018,45(10):2121-2130.
YANG S S.Isolation and identification of Pseudomonas BP16 and its plant growth-promoting traits and effects [J].Bulletin of Microbiology,2018,45(10):2121-2130.
[9] 王琳,魏启舜,周影,等.覆土层益生菌恶臭假单胞菌TK3对双孢蘑菇的促生作用 [J].食用菌学报,2018,25(3):23-29.
WANG L,WEI Q S,ZHOU Y,et al.Promoting effect of probiotics Pseudomonas putida TK3 on Agaricus bisporus [J].Journal of Edible Fungi,2018,25(3):23-29.
[10] 刘萧湘.具有植物促生活性的耐盐菌的筛选及微生物法改良盐渍化土壤初探 [D].上海:上海师范大学,2016.
LIU X X.Screening of salt-tolerant bacteria with plant-promoting life and preliminary study on microbial improvement of salinized soil [D].Shanghai:Shanghai Normal University,2016.
[11] EGAMBERDIEVA D,WIRTH S J,SHURIGIN V V,et al.Endophytic bacteria improve plant growth,symbiotic performance of chickpea (Cicer arietinum L.) and induce suppression of root rot caused by Fusarium solani under salt stress [J].Frontiers in Microbiology,2017,8:1887.
[12] 李頌硕.解淀粉芽孢杆菌S3-1的田间应用及表面活性素发酵工艺优化 [D].上海:上海师范大学,2017.
LI S S.Field application of Bacillus amyloliquefaciens S3-1 and optimization of surfactant fermentation process [D].Shanghai:Shanghai Normal University,2017.
[13] CHEN J,LI S S,XU B,et al.Characterization of Burkholderia sp.XTB-5 for phenol degradation and plant growth promotion and its application in bioremediation of contaminated soil [J].Land Degradation and Development,2017,28(3):1091-1099.
[14] 胡婵娟,刘国华,吴雅琼.土壤微生物生物量及多样性测定方法评述 [J].生态环境学报,2011,20(6):1161-1167.
HU C J,LIU G H,WU Y Q.Review on methods for determination of soil microbial biomass and diversity [J].Chinese Journal of Ecology,2011,20(6):1161-1167.
[15] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导 [M].北京:中国轻工业出版社,2007.
CAO J K,JIANG W B,ZHAO Y M.Physiological and Biochemical Experiment Guidance for Postharvest Fruits and Vegetables [M].Beijing:China Light Industry Press,2007.
[16] 关松荫.土壤酶及其研究法 [M].北京:中国农业出版社,1986.
GUAN S Y.Soil Enzymes and Their Research Methods [M].Beijing:China Agriculture Press,1986.
[17] MINAXI,SAXENA J.Characterization of Pseudomonas aeruginosa RM-3 as a potential biocontrol agent [J].Mycopathologia,2010,170(3):181-193.
[18] 管珺.蜡样芽孢杆菌的培养及其在农业领域中的应用研究 [D].南京:南京工业大学,2008.
GUAN J.Culture of Bacillus cereus and its application in agriculture [D].Nanjing:Nanjing Tech University,2008.
[19] GHOSH T S,CHATTERJEE S,AZMI S A,et al.Virulence assay and role of Bacillus thuringiensis TS110 as biocontrol agent against the larval stages of rice leaf folder Cnaphalocrocis medinalis [J].Journal of Parasitic Diseases,2017,41(2):491-495.
[20] REN J H,LI H,WANG Y F,et al.Biocontrol potential of an endophytic Bacillus pumilus JK-SX001 against poplar canker [J].Biological Control,2013,67(3):421-430.
[21] CHEMELTORIT P P,MUTAQIN K H,WIDODO W.Combining Trichoderma hamatum THSW13 and Pseudomonas aeruginosa BJ10-86:a synergistic chili pepper seed treatment for Phytophthora capsici infested soil [J].European Journal of Plant Pathology,2017,147(1):157-166.
[22] GEORGE A B,ANASTASIA L L,KALLIOPI K,et al.Biological control of three Colletotrichum lindemuthianum races using Pseudomonas chlororaphis PCL1391 and Pseudomonas fluorescens WCS365 [J].Biological Control,2009,49(2):139-145.
[23] ZHAO Q Y,RAN W,WANG H,et al.Biocontrol of Fusarium wilt disease in muskmelon with Bacillus subtilis Y-IVI [J].BioControl,2013,58(2):283-292.
[24] UMME S Z,TAKASHI A,Mohammad S R.Biocontrol of Rhizoctonia solani k1 by iturin a producer Bacillus subtilis RB14 seed treatment in tomato plants [J].Advances in Microbiology,2016(6):425-431.
[25] SAECHOW S,THAMMASITTIRONG A,KITTIKOOP P,et al.Antagonistic activity against dirty panicle rice fungal pathogens and plant growth promoting activity of Bacillus amyloliquefaciens BAS23 [J].Journal of Microbiology and Biotechnology,2018,28(9):1527-1535.
[26] CHOWDHURY S P,HARTMANN A,GAO X,et al.Biocontrol mechanism by root-associated Bacillus amyloliquefaciens FZB42-a review [J].Frontiers in Microbiology,2015,6:780.
[27] ROQUIGNY R,ARSENEAULT T,GADKAR V J,et al.Complete genome sequence of biocontrol strain Pseudomonas fluorescens LBUM223 [J].Genome Announcements,2015,3(3):e00443.
[28] KOUR R,AMBARDAR S,VAKHLU J,et al.Plant growth promoting bacteria associated with corm of Crocus sativus during three growth stages [J].Letters in Applied Microbiology,2018,67(5):458-464.
[29] PEERAN M F,KRISHNAN N,THANGAMANI P R,et al.Development and evaluation of water-in-oil formulation of Pseudomonas fluorescens (FP7) against Colletotrichum musae incitant of anthracnose disease in banana [J].European Journal of Plant Pathology,2014,138(1):167-180.
[30] SABER W I A,GHONEEM K M,AL-ASKAR A A,et.al.Chitinase production by Bacillus subtilis ATCC 11774 and its effect on biocontrol of Rhizoctonia diseases of potato [J].Acta Biologica Hungarica,2015,66(4):436-448.
[31] SUN P P,CUI J C,JIA X H,et al.Isolation and characterization of Bacillus Amyloliquefaciens L-1 for biocontrol of pear ring rot [J].Horticultural Plant Journal,2017(5):10-16.
[32] ROVERA M,NICOLS P,NIEDERHAUSER M,et al.Evaluation of Pseudomonas chlororaphis subsp. aurantiaca SR1 for growth promotion of soybean and for control of Macrophomina phaseolina [J].Biocontrol Science and Technology,2014,24(9):1012-1025.
[33] 张变华,靳东升,张强,等.不同施肥处理下工矿复垦区大豆根际效应分析 [J].大豆科学,2018,37(6):915-922.
ZHANG B H,JIN D S,ZHANG Q,et al.Analysis on the rhizosphere effects of different fertilization treatments on soy-bean in industrial and mining reclamation areas [J].Soybean Science,2018,37(6):915-922.
[34] 李冠杰,王文麗,岳丹丹,等.地衣芽孢杆菌YDY高产吲哚乙酸发酵条件的优化 [J].河南科学,2018(1):70-76.
LI G J,WANG W L,YUE D D,et al.Optimization of high-yield indole acetic acid and fermentation conditions of Bacillus licheniformis YDY [J].Henan Science,2018(1):70-76.
[35] 钟喆栋,曾小波,李友国.ACC脱氨酶对大豆快生根瘤菌及苜蓿中华根瘤菌共生固氮与竞争结瘤的影响 [J].华中农业大学学报,2019,38(1):28-34.
ZHONG Z D,ZENG X B,LI Y G.Effects of ACC deaminase on symbiotic nitrogen fixation and competitive nodulation of soybean rapid Bradyrhizobium and Sinorhizobium meliloti [J].Journal of Huazhong Agricultural University,2019,38(1):28-34.
[36] 吕睿,贾凤安,刘晨,等.无机磷降解菌株的分离、鉴定及解磷能力 [J].江苏农业科学,2017(20):303-306.
L R,JIA F A,LIU C,et al.Isolation,identification and phosphorus solubilization ability of inorganic phosphorus degrading strains [J].Jiangsu Agricultural Sciences,2017(20):303-306.
[37] 朱慧明.高产铁载体菌株的筛选及其对不溶性铁化合物的利用 [D].天津:天津科技大学,2015.
ZHU H M.Isolation of high siderophore-producing bacteria and the utilization of insoluble iron compounds [D].Tianjin:Tianjin University of Science and Technology,2015.
[38] 周小梅,赵运林,董萌,等.荧光假单胞菌对蒌蒿生理与根际微生态的影响 [J].环境科学与技术,2016(8):58-63.
ZHOU X M,ZHAO Y L,DONG M,et al.Effects of Pseudomonas fluorescens on physiological characteristics and rhizosphere micro-ecology of Artemisia selengensis [J].Environmental Science and Technology,2016(8):58-63.
[39] 侯乐梅,孟瑞青,乜兰春,等.不同微生物菌剂对基质酶活性和番茄产量及品质的影响 [J].应用生态学报,2016,27(8):2520-2526.
HOU L M,MENG R Q,MIE L C,et al.Effects of different microbial agents on matrix enzyme activity and tomato yield and quality [J].Chinese Journal of Applied Ecology,2016,27(8):2520-2526.
[40] 娄义,郭俏,彭楚,等.3株芽孢杆菌对番茄的促生作用及对番茄根域微生物的影响 [J].应用生态学报,2018,29(1):260-268.
LOU Y,GUO Q,PENG C,et al.Effects of three Bacillus strains on growth promoting and rhizosphere soil microflora of tomato [J].Chinese Journal of Applied Ecology,2018,29(1):260-268.
[41] 曹银珠,赵同科,刘树庆,等.脲酶/硝化抑制剂双控过程中硝化抑制尿素分解效应 [J].水土保持学报,2015,29(4):143-147.
CAO Y Z,ZHAO T K,LIU S Q,et al.Nitrification inhibits urea decomposition during urease/nitrification inhibitors [J].Journal of Soil and Water Conservation,2015,29(4):143-147.
(责任编辑:顾浩然)
