香椿CCR家族基因TsCCR1的克隆与生物信息学分析
2019-06-06隋娟娟孙晶晶刘小丽姬云涛
隋娟娟,江 平,孙晶晶,刘小丽,姬云涛
(阜阳师范学院 抗衰老中草药安徽省工程技术研究中心,安徽 阜阳 236037)
香椿(Toona sinensis)属于楝科香椿属大型落叶乔木,因其早春嫩芽中含有独特的香味,又含有丰富的铁、磷、钙、维生素以及黄酮类、萜类等营养物质,从而成为人们喜爱的一种蔬菜[1]。香椿通身是宝,叶片、果实、树皮及树根中均含有抗炎、抗氧化、降血脂等药用功效化合物,是一种药食同源的经济树种,因此具有很好的开发前景[2-3]。
木质素是一种广泛存在于植物体内的酚类多聚体,其含量仅次于纤维素,是植物体内的第二大有机物。木质素填充于纤维素的构架中,能够增强植物体的机械强度、有利于水分运输和抵抗外界不良环境侵袭[4]。研究木质素在香椿中的含量,对于提高香椿的栽培抗性,扩大香椿的种植范围与栽培面积具有重要的意义。研究表明,木质素的生物合成过程受到多种酶的调控,其中肉桂酰辅酶 A 还原酶(Cinnamoyl-CoA Reductase,CCR)是木质素合成特异途径中的第一个关键限速酶,能将肉桂酸辅酶A硫酯还原为肉桂醛,在木质素的特异合成途径中发挥重要的调控功能[5]。前人研究表明,通过生物技术手段降低烟草(Nicotiana tabacum)、杨树(Populus L.)、玉米(Zea mays)等植物中CCR基因的表达含量,会导致木质素组成及含量发生显著变化,影响植物正常生长[6-8]。CCR基因属于一个较小的多基因家族,在很多植物如玉米、小麦(Triticum aestivum)、高粱(Sorghum bicolor)中均存在2个或2个以上的CCR,植物中不同CCR基因单体在木质素合成的不同途径中可能催化不同的底物,不同CCR单体具有功能补偿或独立调节木质素合成的作用[5]。从多种植物中克隆得到的CCR家族基因发现,CCR1基因主要参与木质素合成的调控,CCR2基因主要参与植物的抗逆反应,如柳枝稷(Panicum virgatum)、玉米,但在另一些植物中,CCR2基因既参与了木质素合成又参与了植物抗逆,如丹参(Salvia miltiorrhiza)[9]。为了研究香椿中CCR基因的调控作用,从香椿中克隆了CCR2基因,并对其蛋白特性及不同逆境胁迫下的基因表达特征进行了分析,发现CCR2基因在香椿逆境胁迫下的表达发生了显著变化[10]。为进一步研究香椿CCR基因其它家族成员在香椿木质素合成及逆境胁迫条件下的参与情况,本研究从香椿中克隆得到了另一个香椿CCR基因,将其命名为TsCCR1。以NCBI数据库为基础,对该基因进行了蛋白特征及生物信息学分析。
1 材料与方法
1.1 试验材料
试验材料为太和香椿“红油椿”的实生幼苗茎段。总RNA提取试剂盒购于北京天根生化科技有限公司,载体pMD18-T、逆转录试剂盒均购买于Takara公司,DNA片段回收纯化试剂盒购于北京康为世纪生物科技有限公司,Amp(氨苄青霉素)购于Sigma公司,DH5α(大肠杆菌)购于北京全式金生物技术有限公司,试验中所用其他药品均为试验常规药品。扩增所用引物由上海生工生物工程股份有限公司合成,DNA测序由擎科生物技术有限公司(北京)完成。
1.2 RNA提取与cDNA合成
香椿总RNA使用提取试剂盒进行提取,试验步骤按照说明书进行,提取的RNA用1%的琼脂糖凝胶检测完整性,用NanoDrop检测吸光值(A260/A230,A260/A280)。cDNA 第一链的合成使用Reverse Transcriptase Kit(M-MLV)逆转录试剂盒进行,试验步骤按照说明书进行。
1.3 香椿CCR1基因克隆
根据前期香椿转录组测序数据中香椿CCR1基因序列,设计两条引物(上游:TsCCR-F1:ATGGCACCAGCAGCTTCTTTCCTTCAC;下游:TsCCR-R1;GTGAAGGAAAGAAGCTGCTGGTGCCAT)进行PCR扩增。PCR反应体系为:香椿cDNA 模板 1 μL,ddH2O 7 μL,Ex Taq DNA 聚合酶10 μL,上游引物、下游引物各 1 μL;PCR 反应条件为:94 °C(5 min);94 °C(30 s),59 °C(30 s),64 °C(1 min),35个循环;72°C 延伸(10 min)。用 1%琼脂糖凝胶对PCR产物进行电泳检测,将大小正确的条带进行切胶回收,连接到载体上并转化至大肠杆菌(DH5α),随后在37℃恒温条件下摇菌30~60 min,取其菌液均匀涂布于固体LB培养基(含Amp抗生素,100 mg/mL)继续在37℃恒温条件下培养8~12 h,随后挑取单克隆菌株进行PCR鉴定,选择含有阳性克隆的菌液送至公司测序。
1.4 蛋白序列、结构及系统进化分析
利用DNAMAN软件对CCR氨基酸序列进行多重比对分析,利用在线网站NCBI(https://www.ncbi.nlm.nih.gov/)对香椿CCR1基因的核苷酸序列与推导的氨基酸序列进行BLAST分析;利用在线工具ProtParam(http://web.expasy.org/protparam)对香椿CCR1基因推导的蛋白分子式(Formula)、蛋白分子量(Molecular weight)、半衰期(Estimated half-life)以及等电点(pI)进行预测分析;利用在线网站 SOPMA(http://pbil.ibcp.fr/)和Phyre 2(http://www.sbg.bio.ic.ac.uk/phyre2/html)对蛋白香椿CCR1蛋白三级结构进行预测分析;利用软件MEGA5.0对香椿CCR蛋白及其他物种CCR蛋白进行系统进化分析。
2 实验结果
2.1 香椿TsCCR1基因的克隆
以TsCCR-F1、TsCCR-R1为引物,“红油椿”cDNA为模板进行TsCCR1基因扩增,结果获得一条950 bp左右的目的条带。公司测序结果表明该条带大小为924 bp,为香椿TsCCR1基因的开放阅读框,共编码307个氨基酸如图1。
2.2 香椿TsCCR蛋白性质与氨基酸序列分析
ProtParam在线工具预测TsCCR1蛋白的分子式为C1526H2359N407O462S21、分子量为35.48 kDa,PI(等电点)为 5.34(<7),GRAVY(亲水性平均系数)为-0.162,天冬氨酸Asp与谷氨酸Glu总数(蛋白肽链负电荷残基)为40、精氨酸Arg与赖氨酸Lys总数(蛋白肽链正电荷残基)为28见表1,推测香椿TsCCR1蛋白为亲水性、酸性蛋白。将香椿TsCCR1的同家族基因TsCCR2(已发表)及其它同源基因编码的蛋白用ProtParam在线网站进行分析,结果表明,香椿TsCCR1与TsCCR2及其他物种的CCR蛋白氨基酸长度、分子质量、理论等电点、亲水性平均系数及正、负电荷残基数基本一致,说明TsCCR1与其他物种CCR蛋白的性质基本一致。

图1 TsCCR1基因的ORF序列及推导的氨基酸序列
将香椿TsCCR1基因推导的氨基酸序列进行分析,结果发现,TsCCR1蛋白含有NADP结合位点、酶活性位点、底物结合位点、特异位点以及非特异位点如图2,符合CCR基因的酶学特征。但不同物种CCR蛋白同源比对发现,多种植物中CCR蛋白的保守氨基酸序列KNWYCYGK在香椿TsCCR1中变为KLWHALAK,在核桃(Juglans regia,XP_018812460.1)中变为 KLWHGLSK,胡杨(Populus euphratica,XP_011028167.1)中变为KLWHALSK,可可树(Theobroma cacao,XP_017974003.1)中变为 KLWEALSK,月季(Rosa chinensis,XP_024172896.1)中变为 KLWHALSK,而在TsCCR1的同家族蛋白TsCCR2中则变为KIWYSMSK见图3,推测该段序列的变化可能与催化木质素合成的种类及参与抗逆的途径有关。
2.3 香椿TsCCR1蛋白三维结构分析
ProtParam在线预测发现TsCCR1蛋白结构中含有 35%的 α-螺旋(10个)、14%的 β-转角(9个)、5%的TM螺旋(1个)以及15%的不规则蜷曲如图 4a,而 TsCCR2蛋白具有 38%的 α-螺旋(9个)、15%的 β-转角(11个)、5%的TM 螺旋(1个)以及9%的不规则蜷曲如图4b。TsCCR1比TsCCR2蛋白在三级结构上有较高的相似度,但多出1个α-螺旋,少了2个β-转角,由此推测两个蛋白在功能上可能会存在部分差异。
2.4 香椿TsCCR1系统进化分析
为了确定克隆的目的基因是否为CCR1基因,将其推导的氨基酸序列通过NCBI网站进行BLAST,结果检索出目的蛋白与胡杨的CCR1基因亲缘关系最近,由于CCR基因属于多基因家族,为了进一步确定目的基因在CCR家族基因的进化关系,将NCBI网站提供的不同物种的CCR1与CCR2蛋白进行系统进化树分析,结果表明目的蛋白与CCR1聚为一个分枝,而TsCCR2与CCR2聚为另一个分枝如图5,进一步说明克隆得到的基因,即为CCR1的同源基因。
3 讨论
研究表明,木质素在植物的抗逆境胁迫方面发挥重要功能,通过基因工程手段提高香椿幼苗期的木质素合成量,提高抗逆境胁迫能力,对于扩大香椿的种植范围具有重要的意义。前人研究表明CCR基因是木质素合成的关键基因之一,在木质素合成过程中能将肉桂酰辅酶A硫酯发生还原反应,生成相应的肉桂醛[11]。本研究从香椿幼苗中克隆得到一个CCR同源基因,命名为TsCCR1。TsCCR1蛋白结构分析表明该蛋白属于SDR超家族成员,具有酶活性位点、底物结合位点以及NADP结合位点,与CCR酶学功能特征相符合[12]。

表1 不同植物CCR蛋白氨基酸组成与理化性质推测

图2 香椿TsCCR1蛋白结构保守域分析

图3 不同物种CCR1蛋白部分氨基酸序列比对

图4 香椿TsCCR1和TsCCR2三维结构图
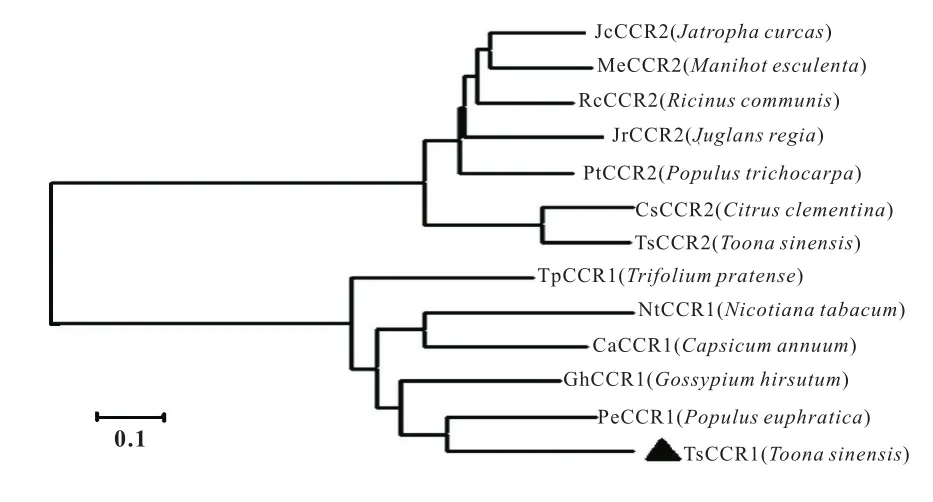
图5 香椿TsCCR1蛋白与其他物种CCR蛋白的系统进化树分析
4 小结
系统进化树分析表明TsCCR1基因与胡杨CCR1基因的亲缘关系最近,因此将其命名为TsCCR1。通过ProtParam在线工具预测发现TsCCR1蛋白与其它物种CCR蛋白的组成与理化性质基本一致,但其保守序列由KNWYCYGK变异为KLWHALAK,该段序列可能与CCR蛋白功能的差异有关。课题组前期已经克隆得到该家族的另一个CCR基因,将其命名为TsCCR2,前期试验结果表明TsCCR2在香椿的抗盐、抗旱、抗热及抗干旱方面可能发挥调控功能(已发表)[10]。TsCCR1蛋白与TsCCR2蛋白的氨基酸组成与理化性质基本一致,三维结构也有很大相似度,但TsCCR1比TsCCR2蛋白多出1个α-螺旋,少了2个β-转角,系统进化树分析显示两个蛋白也分别聚在了不同的分枝上,由此推测两个蛋白在功能上可能会存在部分差异,但TsCCR1基因在香椿木质素合成及抗逆方面发挥的具体作用,以及是否与TsCCR2存在功能冗余现象,仍需要进一步探索分析。
