葡萄糖的添加对富锂锰基正极材料Li1.2Ni0.2Mn0.6O2的影响*
2019-06-06向延鸿廖启军吴贤文吴显明熊利芝何则强
王 雷,向延鸿,廖启军,田 林,吴贤文, 吴显明,熊利芝,何则强
(1.吉首大学 物理与机电工程学院,湖南 吉首 416000;2.锰锌钒产业技术湖南省2011协同 中心,湖南 吉首 416000;3.吉首大学 化学化工学院,湖南 吉首 416000; 4.吉首大学 生物资源与环境科学学院 湖南 吉首 416000)
环境污染问题日益突出,传统化石能源资源日益匮乏,使得以锂离子电池为代表的绿色环保和高效高能的储能设备迅速发展.近年来,锂离子电池大规模应用于手机等小型移动电子设备中,但是在大型储能比如作为电动汽车的动力电池方面则远远不能满足实际运用的需求.正极材料为锂离子电池提供充放电所需要的Li+,是决定锂离子电池性能的限制电极[1-3].所以,对正极材料性能的改善已经成为目前提升锂离子电池性能研究的主流方向.近年来人们研发的热点正极材料主要包含以下几种:(1)橄榄石结构正极材料.LiFePO4是具有代表性的橄榄石结构正极材料,价格便宜,循环稳定性好.但由于LiFePO4为三维空间网状结构,电子和离子电导率较低,所以在常温下其倍率性能以及电化学性能并不理想[4].(2)尖晶石结构正极材料.LiMn2O4是具有尖晶石结构的正极材料,抗过充和过放能力强,同时具有制备工艺简单、生产成本低廉、安全性高、对环境友好等优点,是近年来最受重视的正极材料之一.但是正极材料LiMn2O4在充放电过程中随着锰离子的氧化还原反应会发生Jahn-Teller效应,电极阻抗增大从而导致电池容量衰减.同时,电池中电解液分解导致锰溶解,也使得电池容量衰减严重,从而导致其电化学性能和循环性能变差[5].(3)层状结构正极材料.LiCoO2是目前市场上应用范围最广、生产技术最成熟的正极材料,具有较高的离子电导率和电子电导率.但是LiCoO2中的重要组成元素Co对人体和环境均有毒害作用,同时由于Co资源匮乏导致电池的生产成本,市场价格昂贵.另一方面,由于LiCoO2热力学稳定性差,使电池在使用过程中存在可能爆炸的安全性问题,也阻碍了其进一步发展.
目前处于研发阶段的富锂锰基新材料Li1+xMn1-xO2或xLi2MnO3·(1-x)LiMO2(M=Mn,Ni,Co),具有比容量大、工作电压高、热稳定性好等优势[6-7].其以资源相对丰富的锰为主原料,降低了正极材料的生产成本.同时,由于该材料安全可靠,对环境无污染,符合可持续发展的要求,受到了众多学者的关注,被认为是下一代锂离子电池正极材料理想之选.尽管富锂锰基正极材料表现出良好的前景,但是其首次放电不可逆容量高,循环性能和倍率性能较差[8-9],无法满足人们对高容量、高倍率性电池的需求,从而阻碍了其实际应用.碳包覆可以改善活性材料粒子的分散性和粒子表面活性,增大材料表面电子电导率,提高材料结构的稳定性,是改善正极材料性能的重要手段.葡萄糖市场价格低廉,常温下化学结构稳定.同时,葡萄糖碳氢含量适中,裂解后成分稳定,是对材料进行碳包覆的理想碳源[10].笔者采用在材料中添加葡萄糖的方式、利用葡萄糖裂解产生CO2和水来抑制颗粒发生团聚和变大,从而获得尺寸较小、分布均匀、比表面积大的样品,提高样品的电化学性能.同时,利用葡萄糖未充分裂解形成的碳,对材料形成碳包覆,获得结构稳定,循环、倍率性能优异的正极材料.
1 实验
1.1 材料与制备
根据正极材料Li1.2Ni0.2Mn0.6O2中Li︰Ni︰Mn物质的量的比称量二水乙酸锂(C2H3O2Li·2H2O)、四水乙酸镍(C4H6NiO4·4H2O)、四水乙酸锰(C4H6MnO4·4H2O)溶于去离子水中,配制成50 mL总浓度为1 mol/L的溶液.在溶液中加入不同质量的葡萄糖x(x=葡萄糖质量/试剂总质量=0,6%,12%,36%,48%),将溶液置于恒温水浴锅中搅拌均匀,然后缓慢滴加50 mL 浓度为1 mol/L的C6H8O7·H2O溶液,并用氨水将混合溶液pH值调节至7.0.混合溶液在80 ℃恒温水浴锅中搅拌至溶胶后,在120 ℃环境下干燥,研磨成粉,制成前驱体.将前驱体在550 ℃环境下煅烧4 h,继续研磨使材料均匀,再将研磨后的材料在900 ℃环境下煅烧10 h.
1.2 材料的表征
采用日本的Rigaku 2500型X射线粉末衍射仪(XRD)表征材料的结构.测试条件:选取Cu靶,Kα射线(λ=0.154 05 nm),工作电流250 mA,工作电压40 kV,扫描范围为10~80(°).
1.3 电池的组装
按照质量比 8︰1 ︰1将正极活性物质、聚偏氟乙烯(PVDF)和乙炔黑进行混合研磨,并溶解到 N-甲基-2-吡咯烷酮(NMP)中.使用涂布刀将浆料涂刮到铝箔上,并在105 ℃下干燥.使用铳片机压片后得到正极片.将正极片、隔膜等置于真空干燥箱中,真空状态下60 ℃干燥 10 h.以金属锂片为负极,以溶解于乙烯碳酸酯(EC)+碳酸甲乙酯(EMC)+碳酸二甲酯(DMC)(体积比为1︰1 ︰1)溶液的1 mol/L的LiPF6为电解液、聚丙烯微孔膜(Celgard 2400)为隔膜,在高纯氦气保护的手套箱中组装成CR2032扣式半电池,取出后用封口机将电池进行密封.
1.4 电池的测试
使用武汉蓝电电子股份有限公司生产的LAND-CT2001A型电池测试系统进行电池的恒电流充放电测试,充放电电压区间为2.0~4.8 V;使用上海辰华CHI660E 电化学工作站对电池进行交流阻抗(EIS)测试,测试频率范围为0.01~100 kHz,振幅为5 mV;使用上海辰华CHI660E 电化学工作站对电池进行循环伏安测试,测试电压区间为2.0~5.0 V,扫描速度为0.1 mV/s.
2 结果与讨论
2.1 结构与形貌特征
图1为添加不同量葡萄糖(x=0,6%,12%,36%,48%)后材料的XRD图谱.参照文献[11],可以发现合成的产物为富锂锰基正极材料,葡萄糖的添加并没有改变材料原本的晶体结构.
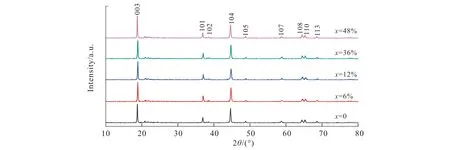
图1 样品XRD图谱Fig. 1 XRD of Synthetic Samples
由图1可以看出,材料在添加葡萄糖后衍射峰比较尖锐,说明形成了结晶度较好的目标产物.图1中(108)/(110)峰明显分裂,表明该材料具有良好的的分层结构并有助于电解液中离子的运输.通过比较加入和未加入葡萄糖材料的XRD图谱,可以看出添加葡萄糖后没有出现其他杂质峰及碳的衍射峰,说明样品中的碳可能以非晶态的形式存在,同时也说明,由于在空气气氛中烧结,碳并没有还原Li1.2Ni0.2Mn0.6O2材料中的过渡金属而造成材料结构的破坏.
图2为添加不同质量葡萄糖(x=0,6%,12%,36%,48%)后材料的扫描电镜图谱.

图2 不同葡萄糖添加量样品的SEM图谱Fig. 2 SEM with Different Amount of Glucose Addition
图2a,2b,2c葡萄糖添加量分别为0,6%,12%.从图2a—c可以看出,不加入葡萄糖(x=0)的材料颗粒尺寸比较大并且出现了明显的团聚.随着少量葡萄糖(x=6%,12%)的加入,材料颗粒粒径开始变小,团聚现象的得到明显改善.当葡萄糖添加量为12%时,材料的颗粒尺寸最小.这是由于少量葡萄糖在材料煅烧过程中裂解产生了CO2和H2O,CO2溢出和H2O的蒸发抑制了颗粒的团聚和变大,提高了粒径的单分散程度[12].
图2d和2e葡萄糖添加量分别为36%和48%.从图2d和2e可以看出,它们颗粒的粒径相对于图2c呈现逐渐增大的趋势.这主要是因为当葡萄糖的添加量增加时,包覆颗粒表面的碳层也逐渐增加,碳的包覆使得材料粒径增大.
2.2 电化学性能分析
图3为添加不同质量葡萄糖(x=0,6%,12%,36%,48%)的样品0.05C首次充放电曲线,充放电电压区间为2.0~4.8 V.
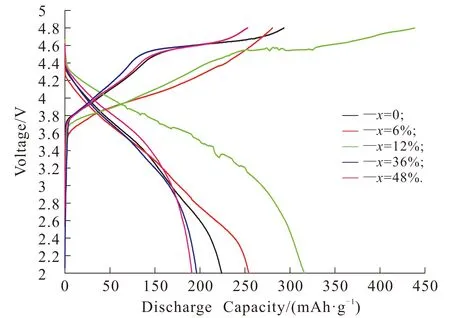
图3 不同葡萄糖添加量样品的首次充放电曲线Fig. 3 Initial Charge/Discharge Curve with Different Amount of Glucose Addition
从图3的充放电曲线可以看出,所有的样品在首次充放电过程中都存在2个阶段.第1阶段是电压小于4.5 V的常规阶段,对应着过渡金属Ni2+氧化为Ni4+.第2个阶段是电压高于4.5 V时,充电趋向形成一个平台.这是由于充电至4.5 V以上时,Li2O从Li2MnO3结构中脱出所引起的[13-14].比较葡萄糖添加量0,6%,12%的样品首次充放电曲线可以看出,葡萄糖添加量6%,12%的样品较未加入葡萄糖的样品的首次放电比容量有明显提高,由未加入葡萄糖材料的174 mAh/g分别提高到204,265.9 mAh/g.这是因为少量葡萄糖的加入,提高了粒径的单分散程度,增大了材料的比表面积.同时,少量的碳包覆在材料表面,减少了Li+的界面电荷转移阻抗,提高了材料电化学性能.比较葡萄糖量添加量12%,36%,48%的样品首次充放电曲线可以看出,随着葡萄糖含量的增加,首次放电比容量分别为265.9,147,141 mAh/g,呈逐渐下降趋势.这是由于颗粒表面包覆的碳层逐渐增加,导致包覆层增厚,大量碳层的加入使得单位质量材料中活性物质减少,影响了材料的电化学性能.
添加不同质量葡萄糖(x=0,6%,12%,36%,48%)的样品倍率性图谱如图4所示.

图4 不同葡萄糖添加量样品的倍率性图谱Fig.4 Magnification Performance Chart with Different Amount of Glucose Addition
图4a为葡萄糖添加量0,6%,12%的样品倍率性图谱.从图4a可以看出,材料在不同倍率下测试的循环稳定性能和倍率性能都比较差.这是因为当葡萄糖添加量比较少时,形成并包覆在材料表面的碳较少,材料颗粒分布均匀程度未得到明显改善,结构不稳定.故少量葡萄糖加入未明显改善材料的循环性能和倍率性能.
图4b为葡萄糖添加量36%,48%的样品倍率性图谱.经过0.05C,0.1C,0.2C,0.5C,1.0C循环测试后,再进行0.1C循环测试30次,容量保持率分别为58%和78%,材料在不同倍率下测试的循环稳定性和倍率性都比较好.这是因为随着葡萄糖添加量的增大,材料碳包覆更加完全,材料颗粒分布均匀程度得到改善,材料的稳定性增强.
图5为合成样品的循环伏安测试曲线图.结果表明,样品存在多个氧化峰,其中发生在4.1~4.5 V中的1对氧化峰为层状材料Li1.2Ni0.2Mn0.6O2中的Ni2+氧化到Ni4+[15-16].此峰在随后的扫描过程中合二为一,其对应的还原峰在3.5~4.5 V之间.当电压大于4.5 V以后,出现了1个强烈的氧化峰,它代表富锂锰基单元Li2MnO3中Li2O的净脱出过程.此过程造成了富锂锰基正极材料比较大的首次不可逆容量[17-20].首次循环高于4.5 V的峰的强度,在接下来循环过程中趋于减弱.这是由于首次循环时材料发生不可逆电化学活化以及电解液分解,导致样品的容量出现首次不可逆损失,氧化峰峰的强度降低.
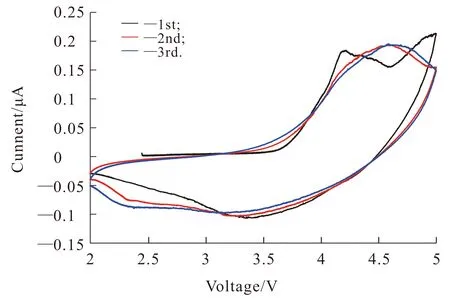
图5 材料的循环伏安曲线 Fig. 5 Cyclic Voltammetric Curve of the Material

图6 样品的交流阻抗曲线Fig. 6 AC Impedance Curve of the Material
材料添加不同质量葡萄糖(x=0,6%,12%,36%,48%)后测得的交流阻抗曲线如图6所示.由图6可以看出,样品的阻抗曲线由高频区的半圆和低频区的一条斜线两部分构成.高频区的半圆弧表示正极材料表面的电荷转移速率,半圆弧越小代表反应越容易进行.对比不同样品的曲线可以看出,样品的电荷转移阻抗随着葡萄糖添加量的增大而逐渐减小.此结果与材料的倍率性能测试结果相一致.
3 结论
XRD表征结果显示,加入葡萄糖不会改变材料原本的晶体结构.SEM结果显示,当葡萄糖添加量较少时(x=6%,12%),较未加入葡萄糖的材料,材料粒径逐渐减小,材料颗粒单分散程度逐渐增大.当葡萄糖添加量较多(x=36%,48%)时,材料粒径逐渐增大,材料颗粒分布也变均匀.首次充放电数据显示,当葡萄糖添加量较少时(x=6%,12%),材料首次放电比容量较未加入葡萄糖的材料明显增大.由未添加葡萄糖材料的174 mAh/g增加到葡萄糖添加量为12%时的265.9 mAh/g;当葡萄糖添加量较多时(x=36%,48%),材料的首次放电比容量随着葡萄糖加入量的增多而逐渐减小,葡萄糖添加量为48%时材料首次放电比容量下降到141 mAh/g.材料倍率性能测试结果显示,葡萄糖的加入显著提高材料的倍率性能.当葡萄糖添加量为48%时材料的倍率性能最好,首次放电比容量为141 mAh/g,经过0.05C,0.1C,0.2C,0.5C,1C后再进行0.1C循环30次测试,放电比容量可以达到110 mAh/g,容量保持率78%.
