川西獐牙菜SmSLS2基因的克隆、生物信息学及表达分析
2019-06-06李文静侯晓强孙艳香韩美玲李晓雪向蓓蓓
李文静 冯 雨 侯晓强 孙艳香 韩美玲 李晓雪 王 勇 向蓓蓓
(1.廊坊师范学院生命科学学院,廊坊 065000; 2.南开大学生命科学学院,天津 300071; 3.天津中医药大学中药学院,天津 300193)
藏药川西獐牙菜(SwertiamussotiiFranch.)隶属龙胆科(Gentianaceae)獐牙菜属(SwertiaL.),主要分布于我国西藏、云南、青海、四川等海拔在2 300~3 900 m地区,俗称“藏茵陈”[1]。全草可入药,性寒、味苦,具有清热解毒、清肝利胆之功效,主治肝功能紊乱和黄疸等症[2~3]。川西獐牙菜中次生代谢产物包括环烯醚萜类、萜类、三萜类黄酮、多元酚类等[4~5]。川西獐牙菜的药理活性与其含有的代谢产物有着必然联系[6]。其中獐牙菜苦苷、龙胆苦苷、獐牙菜苷等环烯醚萜类化合物是主要药效成分,具有清热解毒、利胆退黄之功效,对于肝炎、糖尿病具有显著效果[7~9]。近年来环烯醚萜类化合物的生物活性备受关注,但研究主要集中在新化合物的分类鉴定,药理活性等方面[10~11]。獐牙菜苦苷、獐牙菜苷及龙胆苦苷在獐牙菜中含量极其微少,从原植物中提取远远不能满足市场需求;化学合成和半合成由于成本太高导致无商业前景[12]。利用分子生物学手段来提高川西獐牙菜有效成分含量成为有效手段。
川西獐牙菜目前尚无公开的基因组序列,目前裂环烯醚萜途径仅SmGPPS、SmIS、SmDL7H、SmG10H等少数酶被成功克隆[13~16],但这些酶都处于环烯醚萜合成途径较上游位置。裂环马钱子苷合成酶(secologanin synthase,SLS)是环烯醚萜类化合物合成途径的关键限速酶,该酶能够催化马钱子苷到环烯醚萜途径终产物裂环马钱子苷,裂环马钱子苷再与吲哚途径的色胺在异胡豆苷合成酶(strictosidine synthase,STR)的催化下生成3α(S)-异胡豆苷,之后经过一系列的酶促反应生成环烯醚萜类化合物[17~18]。裂环马钱子苷合成酶有两种形式,SLS1和SLS2,在长春花中这两种亚型核苷酸一致性高达94%,而川西獐牙菜中SmSLS1和SmSLS2一致性仅达63%,且主要以SmSLS2形式存在,SmSLS1在根、茎、叶、花等器官中表达量都很低[19~20]。裂环马钱子苷合成酶的功能研究目前仅在长春花、喜树、滇龙胆等少数植物中有报道[21~25]。
鉴于SmSLS2在环烯醚萜合成途径中的重要作用,本研究以川西獐牙菜为材料,根据本实验室前期获得的转录组数据,提取SmSLS2基因序列,设计引物分别对其cDNA和DNA序列进行扩增,通过克隆、测序及相应生物信息学分析,预测其编码产物理化性质和高级结构;构建原核表达载体pET-28a-sumo-SmSLS2,转入大肠杆菌BL21(DE3)中,在37℃、0.5 mmol·L-1IPTG条件下进行诱导表达。以上研究为阐明川西獐牙菜中环烯醚萜化合物生物合成途径提供了良好的理论依据,同时在蛋白应用开发以及利用基因工程手段提高川西獐牙菜次生代谢产物有效成分的含量方面具有非常重要的作用。
1 材料与方法
1.1 材料
川西獐牙菜(SwertiamussotiiFranch)野生种子,由青海大学董汇泽教授采集于青海省玉树县并进行鉴定。实验材料来自于实验室种植的川西獐牙菜植株。E.coliTrans10和BL21(DE3)菌种购于全式金生物有限公司。pET-28a-sumo载体由廊坊师范学院遗传与育种研究所保存。
DNA marker、6×Loading Buffer、Taq DNA聚合酶、10×PCR Buffer、XhoⅠ、SacⅠ限制性内切酶、10×M Buffer和dNTP均购自大连宝生物公司(TaKaRa);Ligation high购自东洋纺公司;2×A8 FastHiFi PCR MasterMix(+dye),Zero Background pTOPO-Blunt cloning kit购自北京艾德莱生物科技有限公司;快速琼脂糖凝胶DNA纯化回收试剂盒、高纯度质粒小提试剂盒、RNAprep pure植物总RNA提取试剂盒购自天根生化科技(北京)有限公司;GoScriptTMReverse Transcription System购自普洛麦格(北京)生物技术有限公司;异丙基硫代半乳糖(isopropyl-1-thio-β-D-galactopyranoside,IPTG)、卡那霉素购自生工生物科技有限公司;引物合成和基因测序由上海美吉生物医药科技有限公司完成。
1.2 总RNA提取及cDNA的合成
参照RNAprep pure植物总RNA提取试剂盒的说明书提取川西獐牙菜叶片总RNA,用NanoDrop 2000c对其浓度和纯度进行测定;按照GoScriptTMReverse Transcription System试剂盒说明书合成第一链cDNA,-20℃保存备用。
1.3 SmSLS2全长cDNA的克隆
由于川西獐牙菜植物目前没有可用的基因组序列,我们前期提取了川西獐牙菜叶片RNA,送诺禾致源公司通过Illumina Hiseq 4000高通量测序技术进行转录组测序。通过生物信息学方法对获得的大量Unigenes进行功能注释,同时从NCBI获得长春花CrSLS序列,通过同源比对转录组数据获得SmSLS2基因cDNA序列。根据该cDNA序列和原核表达载体pET-28a-sumo多克隆位点,设计一对含有限制性内切酶的特异性引物:SmSLS-F 5′-AAGAGCTCATGGAGGTGGAGCTAATCAAGA-3′;SmSLS-R 5′-AACTCGAGAGCCGAGCTTCTTGTAAATCA-3′。以cDNA为模板进行PCR扩增,50 μL PCR反应体系由SmSLS-F(10 μmol/L)2 μL;SmSLS-R(10 μmol/L)2 μL;2×A8 FastHiFi PCR MasterMix 25 μL;ddH2O 21 μL;川西獐牙菜cDNA 1 μL组成。以该体系中的cDNA模板替换为ddH2O作为阴性对照。反应条件为94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸120 s,总计30个循环;72℃延伸10 min。
1.4 SmSLS2基因结构分析
参照艾德莱CTAB植物基因组DNA快速提取试剂盒提取川西獐牙菜叶片DNA,使用SmSLS-F和SmSLS-R引物分别对DNA和cDNA进行扩增并测序。将测序获得的DNA和cDNA序列提交https://www.ebi.ac.uk/Tools/msa/clustalo/网站进行比对,确定外显子、内含子位置及个数。
1.5 SmSLS2重组质粒的获得与鉴定
SmSLS2基因RT-PCR产物经过1%的琼脂糖凝胶电泳检测,用天根琼脂糖凝胶DNA纯化回收试剂盒纯化目的片段。取4 μL纯化后的目的片段与0.5 μL Zero Background pTOPO Blunt Cloning Vector以及0.5 μL 10×enhancer混匀于25℃下反应5 min。将5 μL连接产物转化Trans 10感受态细胞,涂布于含有50 mg·L-1卡那霉素的LB平板上,37℃倒置培养10 h。使用SmSLS-F和SmSLS-F引物进行菌液PCR,反应体系如下:SmSLS-F和SmSLS-R(10 μmol·L-1)各1 μL;dNTP(2.5 mmol·L-1)2 μL;10×PCR Buffer 2 μL;ddH2O 12.8 μL;菌液1 μL;Taq DNA聚合酶(50 U·μL-1)0.2 μL。反应条件为94℃、5 min;94℃、30 s;55℃、30 s;72℃ 120 s;30个循环;72℃延伸10 min。扩大培养阳性克隆后获得菌液,提取质粒,进行质粒双酶切鉴定。20 μL质粒双酶切鉴定体系为SacⅠ和XhoⅠ限制性内切酶(10 U·μL-1)各1 μL、10×M Buffer 2 μL、ddH2O 11 μL;质粒5 μL。将双酶切体系混匀后,37℃反应2 h。选取菌液PCR和质粒双酶切鉴定正确的质粒进行测序,获得重组载体pTOPO-Blunt Cloning Vector-SmSLS2(简称pTOPO-B-SmSLS2)。
1.6 SmSLS2的生物信息学分析
利用ExPASy ProtParam tool工具(https://web.expasy.org/protparam/)预测SmSLS2编码氨基酸的相对分子质量、等电点及疏水性,利用Signal P3.0 Server进行信号肽预测;利用TMHMM Server2.0进行蛋白跨膜区预测;利用NCBI网站上的CDD分析SmSLS2蛋白保守域。利用PredictProtein方法(https://ppopen.informatik.tu-muenchen.de/)、InterPro protein(http://www.ebi.ac.uk/interpro/)和SWISS-MODEL软件预测其二级和三级结构。将SmSLS2蛋白全长序列提交到NCBI的BLASTP中获得其同源序列(https://blast.ncbi.nlm.nih.gov/Blast.cgi),利用culstal omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)和genedoc(http://www.ch.embnet.org/software/BOX_form.html)进行多重序列比对。将川西獐牙菜SmSLS2序列和水甘草Amsoniahubrichtii(AGX93046.1)、长春花Catharanthusroseus(AGX93064.1)、秀丽藤Tabernaemontanaelegans(AGX93048.1)、小蔓长春花Vincaminor(AGX93049.1)、萝芙木Rauvolfiaserpentina(AGX93047.1)、短小蛇根草Ophiorrhizapumila(BAP90521.1)、金鸡纳树Cinchonacalisaya(AGX93045.1)、青脆枝Nothapodytesnimmoniana(AQW38832.1)、喜树Camptothecaacuminata(ADU19849.1)、滇龙胆Gentianarigescens(KF941191)的SLS氨基酸序列先用BioEdit[26]进行比对和手工校对(采用软件默认设置的参数)。然后用MEGA 5.0[27]进行系统发育分析(Maximum Likelihood Tree,Bootstrap 1 000次重复检验各分支的置信度),分支处的数字表示该分支分析的可靠程度,数值越大,可信度越高。
1.7 原核表达载体的构建
将pTOPO-B-SmSLS2重组载体和pET-28a-sumo载体分别进行SacⅠ和XhoⅠ双酶切,20 μL双酶切的体系为SacⅠ和XhoⅠ限制性内切酶(10 U·μL-1)各1 μL、10×M Buffer 2 μL、质粒10 μL、双蒸水6 μL,37℃反应4 h。回收目的基因和载体片段,使用Ligation high进行连接。其中10 μL连接体系为目的片段5 μL;载体片段1 μL;Ligation high 4 μL;16℃反应30 min,转化Trans10感受态细胞,涂布于含有卡那霉素(50 mg·L-1)的LB培养基上,37℃倒置培养10 h。挑取克隆进行菌液PCR,之后利用质粒小提试剂盒进行质粒的提取并进行双酶切鉴定。20 μL菌液PCR的体系为T7 pro和T7 ter(10 μmol·L-1)各1 μL;dNTP(2.5 mmol·L-1)2 μL;10×PCR Buffer 2 μL;ddH2O 12.8 μL;Taq DNA聚合酶(50 U·μL-1)0.2 μL;菌液1 μL。反应条件均为94℃、5 min;94℃、30 s;55℃、30 s;72℃、120 s;30个循环;72℃延伸10 min。20 μL质粒双酶切鉴定的体系为SacⅠ和XhoⅠ限制性内切酶(10 U/μL)各1 μL、10×M Buffer 2 μL、质粒10 μL、双蒸水6 μL。将双酶切体系混匀后,37℃反应4 h。选取菌液PCR和质粒双酶切鉴定正确的质粒进行测序,获得原核表达载体pET-28a-sumo-SmSLS2。
1.8 SmSLS2在大肠杆菌中的原核表达
利用热激方法分别将重组质粒pET-28a-sumo-SmSLS2和pET-28a-sumo空载质粒转化大肠杆菌BL21(DE3)感受态细胞,菌液PCR扩增获得成功转化的菌株。挑取单菌落接种于1 mL的含50 mg·L-1卡那霉素的LB液体培养基中,37℃ 150 r·min-1过夜培养。次日以1∶100的比例转接到新鲜LB液体培养基中,至OD600值0.6~0.8左右,菌液中分别加入IPTG至终浓度0.5 mmol·L-1,于37℃进行诱导。诱导时间分别为0、1、2和4 h。12 000 r·min-14℃离心2 min收集菌体,加入50 μL 2×SDS-PAGE上样缓冲液(0.125 mol·L-1Tris-HCl(pH6.8)、4% SDS、0.5%溴酚蓝、40%甘油、5% β-巯基乙醇,4 mol·L-1尿素),震荡涡旋混匀,100℃煮沸10 min。室温12 000 r·min-1离心2 min,取10 μL上清液上样进行聚丙烯酰胺凝胶(4.5%浓缩胶和15%分离胶)电泳检测。
2 结果与分析
2.1 川西獐牙菜SmSLS2基因的开放阅读框(ORF)的克隆
根据转录组测序信息,设计含有SacⅠ和XhoⅠ酶切位点的特异性引物,RT-PCR扩增SmSLS2基因全长cDNA序列,得到一条约1 500 bp的DNA片段(SmSLS2 ORF大小为1 566 bp)(图1)。将PCR产物与pTOPO-Blunt Cloning vector进行连接,转化,选取阳性克隆进行菌落PCR扩增,得到一条与ORF全长大小一致的片段(图2)。进一步对重组质粒进行双酶切验证,酶切获得两条带,一条与pTOPO-Blunt Cloning vector大小一致(1 865 bp),另一条与目的片段大小一致(图3)。成功获得了重组质粒pTOPO-B-SmSLS2后送上海美吉生物公司测序。测序结果表明SmSLS2(登录号为MH535904)全长1 566 bp,编码521个氨基酸(图4)。以DNA为模板,使用SmSLS-F和SmSLS-R引物进行PCR扩增,获得全长2 576 bp DNA片段,包括4个大小分别为128、95、705、82 bp的内含子。各扩增电泳图和内含子位置见图1,4。

图1 SmSLS2基因的PCR与RT-PCR扩增产物 M. DL5000 Marker;1.阴性对照;2.SmSLS2基因RT-PCR产物;3.SmSLS2基因PCR产物Fig.1 PCR and RT-PCR detection of SmSLS2 M. DL5000 Marker; 1.Control; 2.RT-PCR product of SmSLS2; 3.PCR product of SmSLS2
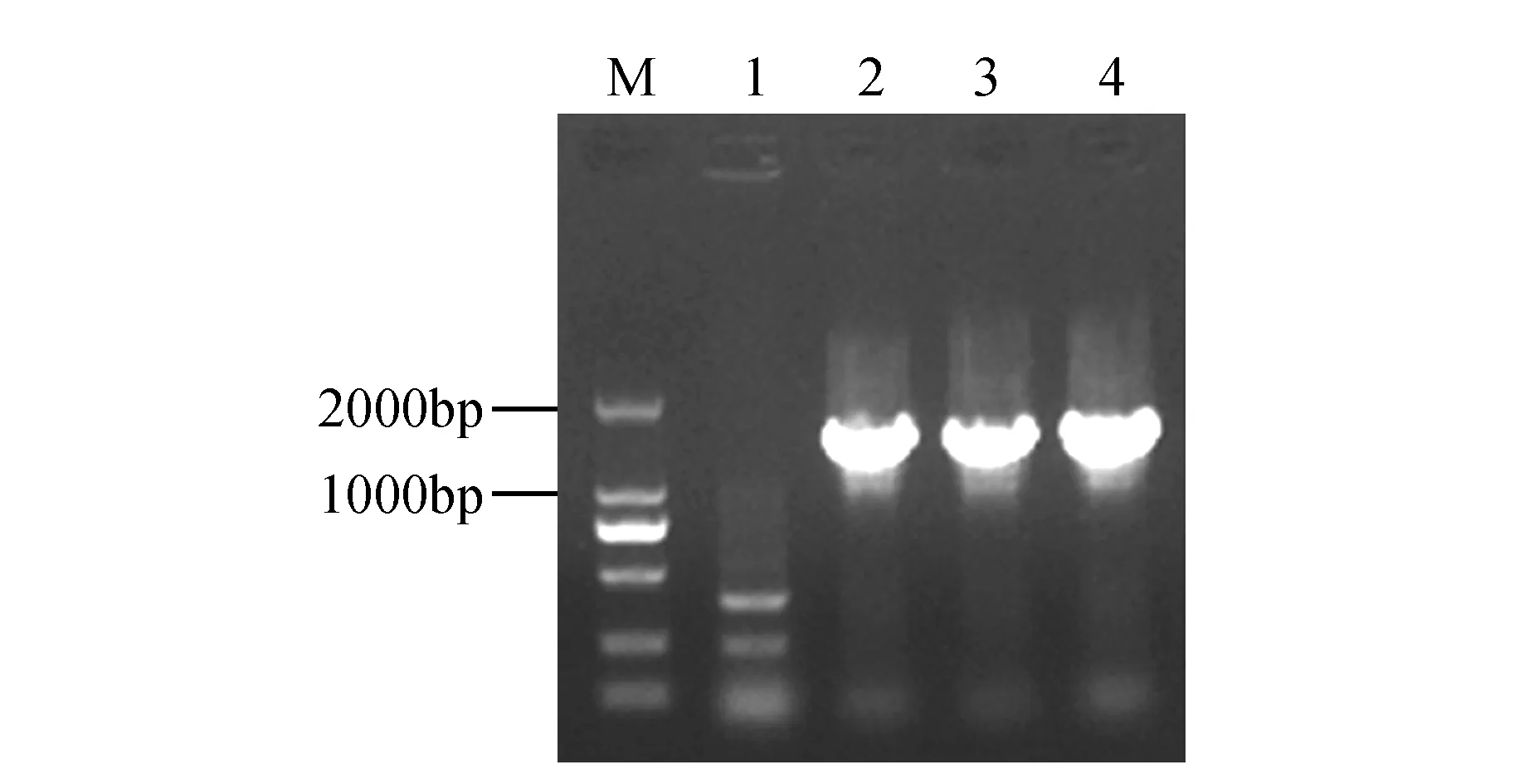
图2 菌液PCR产物检测 M.DL2000 Marker;1.阴性对照;2~4.菌液PCR产物Fig.2 Clonal PCR detection of SmSLS2 M.DL2000 Marker; 1.Control; 2-4.PCR product of SmSLS2
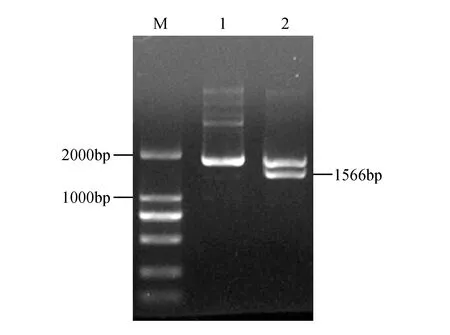
图3 pTOPO-B-SmSLS2载体双酶切鉴定图 M.DL2000 Marker;1.pTOPO-B-SmSLS2质粒;2.pTOPO-B-SmSLS2质粒SacⅠ和XhoⅠ双酶切鉴定Fig.3 Digestive detection of pTOPO-B-SmSLS2 plasmid M.DL2000 Marker; 1.pTOPO-B-SmSLS2 plasmid; 2.Double digestion of pTOPO-B-SmSLS2 plasmid digested by SacⅠ and XhoⅠ
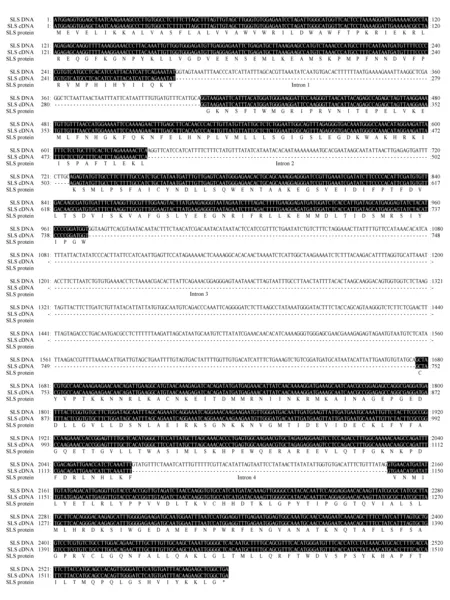
图4 SmSLS2 gDNA、cDNA及编码氨基酸序列 黑色标记部分代表外显子;-代表内含子位置;*代表终止密码子Fig.4 Genomice DNA,cDNA and encoded amino acid sequences of SmSLS2 Black shaded parts were exons;- represented intron;* stands for stop codon
2.2 川西獐牙菜SmSLS2基因的生物信息学分析
2.2.1 川西獐牙菜SmSLS2蛋白质序列分析
利用ExPASy ProtParam tool工具对SmSLS2蛋白的理化性质进行分析,结果表明SmSLS2相对分子质量为59 792.74,等电点(pI)为8.92,分子式为C2718H4261N713O748S28,半衰期为30 h。不稳定指数为33.21,说明SmSLS2蛋白较稳定;脂肪族指数为90.75,总平均疏水性为-0.200。该蛋白由20种氨基酸组成,含量最高的三位分别是亮氨酸(11.1%)、赖氨酸(8.3%)和半胱氨酸(1.2%)(图5)。SmSLS2蛋白保守结构域预测表明SmSLS2氨基酸序列中含有细胞色素P450保守结构域,属于P450超家族成员(图6)。
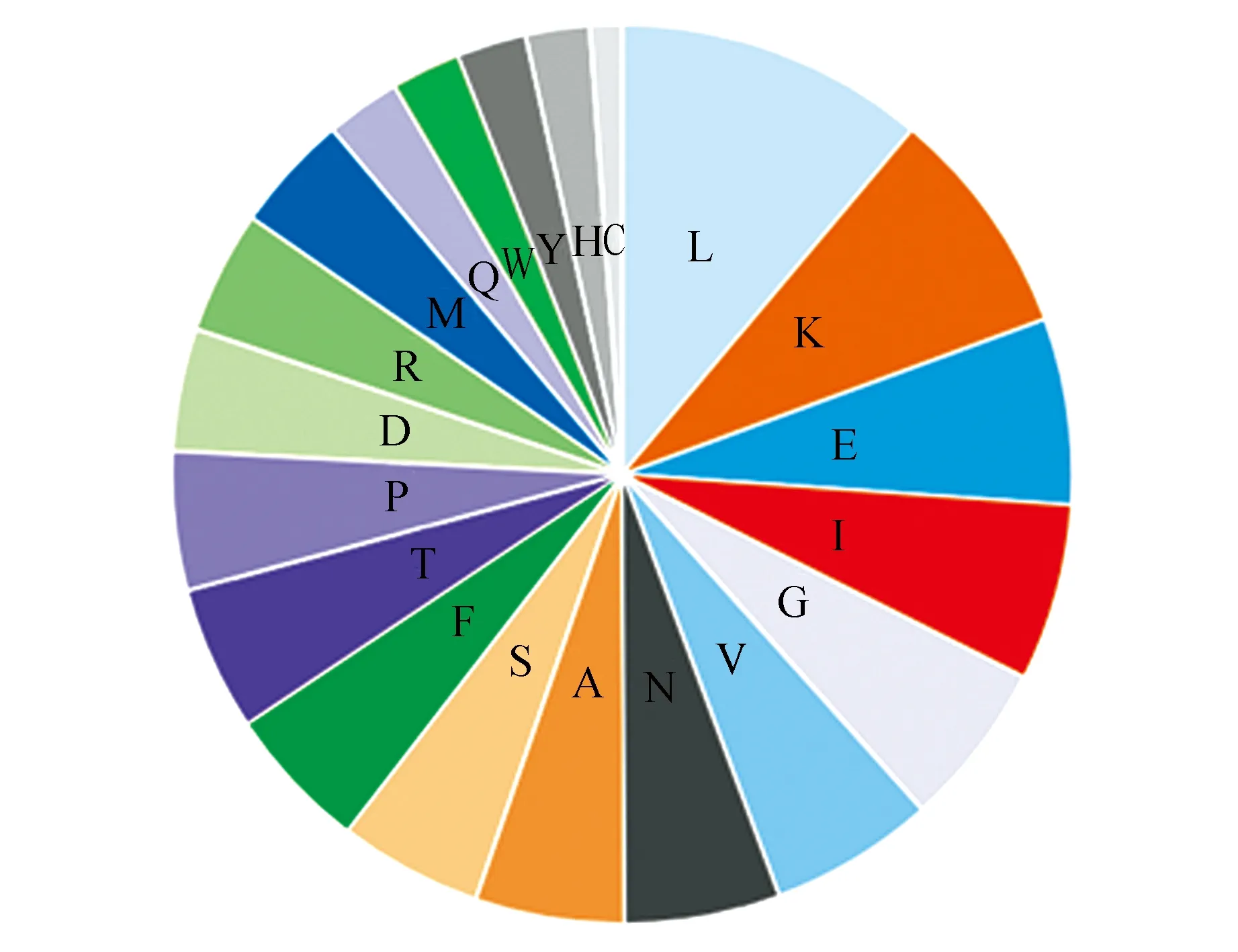
图5 SmSLS2氨基酸组成Fig.5 Amino acid composition of SmSLS2

图6 SmSLS2蛋白保守域分析Fig.6 Conserved domain prediction of SmSLS2 protein

图7 SmSLS2蛋白信号肽预测Fig.7 Signal peptide of SmSLS2 predicted by Signal P
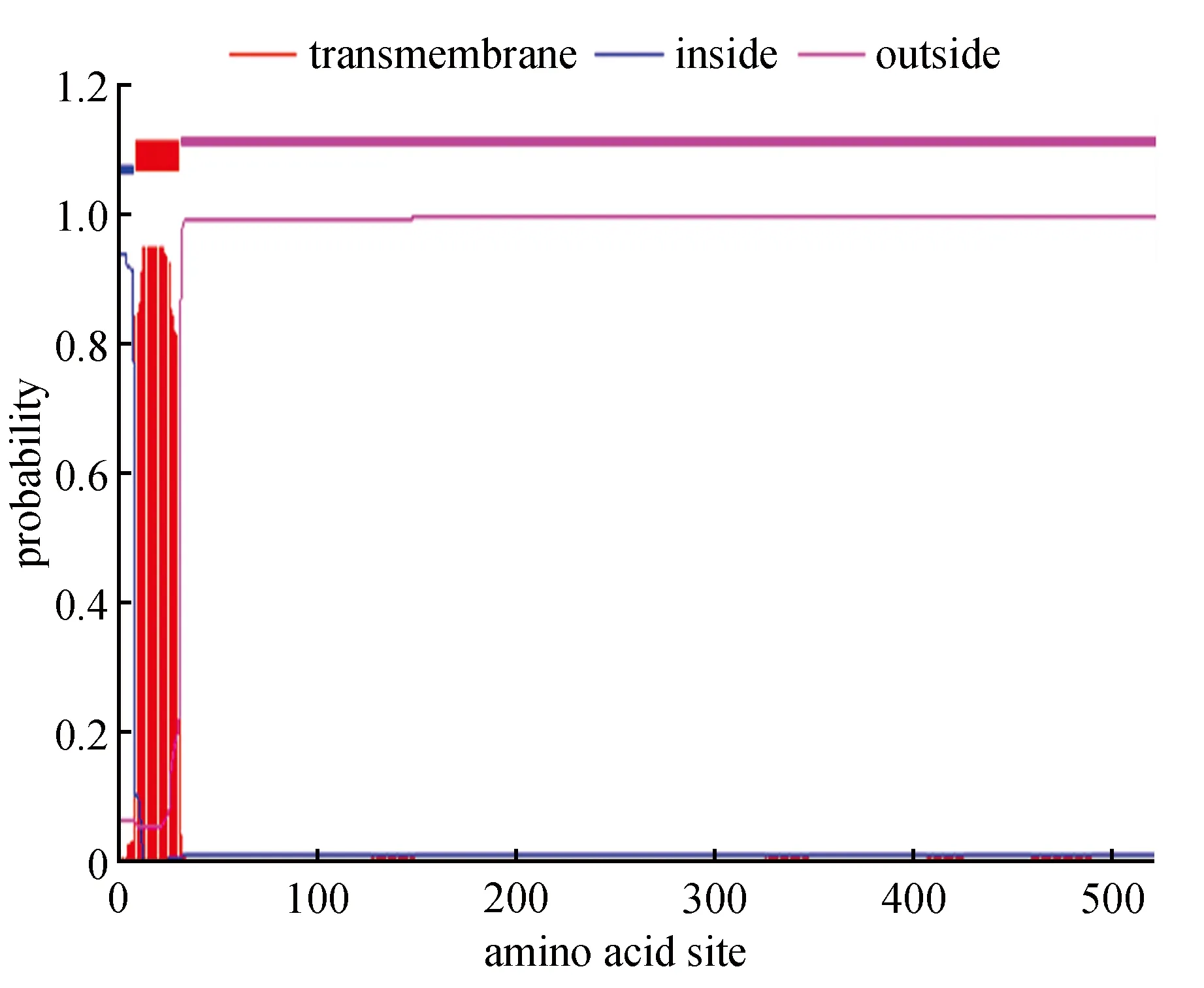
图8 SmSLS2蛋白跨膜结构域分析Fig.8 Transmembrane domain analysis of SmSLS2
信号肽预测结果表明SmSLS2是一分泌型蛋白,序列中有明显的信号肽序列,其切割位点位于VVA和WV之间(图7);蛋白跨膜区预测结果表明SmSLS2第9~31位氨基酸是一个典型的跨膜区(图8);利用PredictProtein方法(https://ppopen.informatik.tu-muenchen.de/)对SmSLS2二级结构进行分析。结果表明该蛋白二级结构中α-螺旋(H)占50.48%,延伸链占6.53%,无规卷曲(C)占42.99%。利用Swiss-Model Workspace以5veu.3.A为模板预测SmSLS2蛋白的三级结构,序列相似度为24.39%,依据39-520位氨基酸建模,模型覆盖率87%(图9),与二级结构预测结果一致。

图9 SmSLS2蛋白三级结构预测Fig.9 3D structure prediction of amino acid sequences of SmSLS2 protein

图10 SmSLS2与其他植物中SLS氨基酸序列的多序列比对结果Fig.10 Multiple sequence alignment of SmSLS2 amino acid sequence with SLS in other plants

图11 SmSLS2与相关物种SLS蛋白的系统发育分析Fig.11 Phylogentic analysis of SmSLS2 and relative SLS proteins
2.2.2 氨基酸序列同源性分析
经culstal omega比对分析,川西獐牙菜SmSLS2蛋白序列与其他植物具有较高相似性(图10)。图10中不同颜色代表SmSLS2氨基酸与其他植物中SLS氨基酸的同源程度,黑色区域代表同源程度高达100%。川西獐牙菜(MH535904)与水甘草(AmsoniahubrichtiiAGX93046.1)、长春花(CatharanthusroseusAGX93064.1)、秀丽藤(TabernaemontanaelegansAGX93048.1)、小蔓长春花(VincaminorAGX93049.1)、萝芙木(RauvolfiaserpentinaAGX93047.1)、短小蛇根草(OphiorrhizapumilaBAP90521.1)、金鸡纳树(CinchonacalisayaAGX93045.1)、青脆枝(NothapodytesnimmonianaAQW38832.1)、喜树(CamptothecaacuminataADU19849.1)的SLS蛋白质的相似度分别为75.62%、74.28%、73.90%、72.94%、72.74%、72.12%、68.92%、66.35%和62.94%。其保守性可能与其在植物体内的功能有关。最大似然法系统发育分析显示,川西獐牙菜(Swertiamussotii)SLS2蛋白与其他物种(水甘草、长春花、秀丽藤、小蔓长春花、萝芙木、短小蛇根草、金鸡纳树、青脆枝、喜树)SLS蛋白未聚在一个分支,亲缘关系均较远(图11)。
2.3 川西獐牙菜SmSLS2蛋白的原核表达
2.3.1SmSLS2基因原核表达载体的构建
将克隆得到的SmSLS2基因片段与原核表达载体pET-28a-sumo进行酶切连接,阳性克隆用SacⅠ和XhoⅠ双酶切鉴定(图12)并进行测序,测序结果无误后,将其转入感受态细胞BL21(DE3)中。
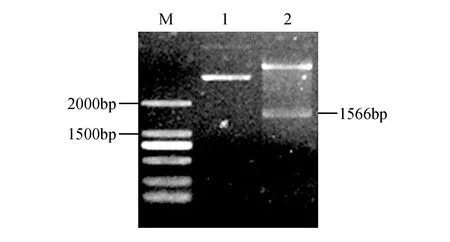
图12 pET-28a-sumo-SmSLS2双酶切检测 M.DL2000 marker;1.pET-28a-sumo-SmSLS2质粒;2.pET-28a-sumo-SmSLS2质粒SacⅠ和XhoⅠ双酶切鉴定Fig.12 Digestive detection of pET-28a-sumo-SmSLS2 plasmid M.DL2000 marker; 1.Plasmid of pET-28a-sumo-SmSLS2; 2.Detection of pET-28a-sumo-SmSLS2 digested by SacⅠ and XhoⅠ
2.3.2 将pET-28a-SmSLS2转入表达菌株BL21(DE3)中进行原核表达
将重组质粒pET-28a-sumo-SmSLS2转入宿主菌株BL21(DE3)后,菌落PCR检测获得正确的转化菌株,并使用IPTG诱导重组蛋白表达。一般原核蛋白诱导表达需要从标签蛋白、IPTG的浓度、诱导温度及时间方面入手[28]。SmSLS2蛋白原核表达首先选择0.5 mmol·L-1IPTG,37℃温度进行诱导,故本研究主要是通过调整诱导时间进行优化。如图13所示,空载体经0、1、2、4 h诱导后获得20 kDa sumo标签蛋白,而pET-28a-sumo-SmSLS2经0、1、2、4 h诱导后获得一条与预期蛋白一致(77 kDa)的特异性条带。蛋白表达量随诱导时间增加而增多,在4 h时达到最高水平(图13)。结果表明pET-28a-sumo-SmSLS2载体构建成功,并成功通过IPTG诱导获得了目的蛋白。
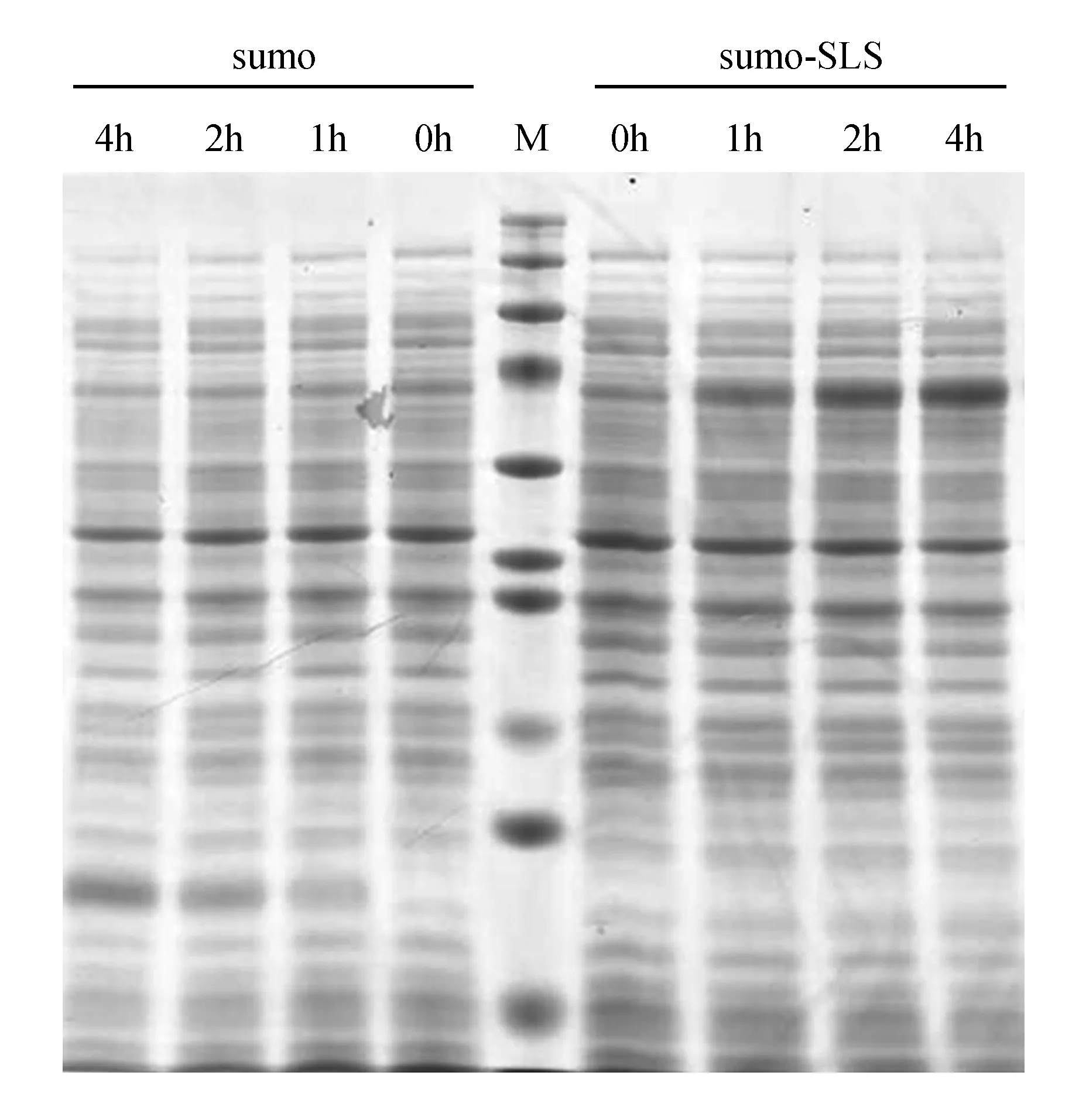
图13 原核表达SmSLS2的SDS-PAGE电泳检测 M.Dual Color Prestained Protein Marker;0、1、2和4 h代表转入pET-28a-sumo和pET-28a-sumo-SmSLS2载体的BL21菌株诱导0、1、2、4 h的总蛋白Fig.13 Prokaryotic expression detection of SmSLS2 gene by SDS-PAGE M.Dual Color Prestained Protein Marker; 0, 1, 2 and 4 h represent the expressed product of pET-28a-sumo and pET-28a-sumo-SmSLS2 with 0.5 mmol·L-1 of IPTG induction for 0, 1, 2 and 4 h at 37℃
3 讨论
裂环马钱子苷合成酶是调控次生代谢产物獐牙菜苦苷及龙胆苦苷的关键酶,能够催化裂环马钱子苷生成马钱子苷。该酶含有两种亚型,SmSLS1和SmSLS2,SmSLS1在根、茎、叶片、花等器官中表达量均较低,主要以SmSLS2形式存在[20]。本研究成功在川西獐牙菜中克隆到SmSLS2基因的ORF及基因组序列,同源序列比对分析发现川西獐牙菜SmSLS2的氨基酸序列与其他植物的相似性较高,表明其确为SLS基因,编码蛋白属于P450家族成员。SmSLS2蛋白与其他植物中SLS相似度较高,系统进化树分析与其他蛋白均未聚于一个分支,亲缘关系较远。滇龙胆与川西獐牙菜同属于龙胆科,但目前滇龙胆中仅克隆得到GrSLS1基因,川西獐牙菜中SmSLS1与SmSLS2两个基因核苷酸同源性仅达63%[20],因此SmSLS2与GrSLS1未聚于同一分支。除滇龙胆外其他物种与獐牙菜不同属于龙胆科,该结果与传统分类结果相一致。
真核生物基因的原核表达受载体所带标签、宿主菌株、诱导温度、诱导时间、IPTG浓度等因素的影响[28]。本研究最初采用pet28a载体进行表达,从诱导温度、诱导时间、IPTG浓度多方面进行改进,均未获得重组蛋白。后来将SmSLS2构建到pet28a-sumo载体上,该载体在目的蛋白N端添加了sumo标签,增加了目的蛋白的可溶性和快速纯化能力。在37℃和0.5 mmol·L-1IPTG浓度下,成功诱导出与预期大小一致的目的蛋白,且随着诱导时间延长,蛋白浓度升高,诱导表达4 h,蛋白量可以满足纯化需求。
川西獐牙菜主要有效成分獐牙菜苦苷及龙胆苦苷为环烯醚萜化合物,在獐牙菜中含量极其微少,如何提高有效成分含量至关重要。近年利用分子生物学手段来提高川西獐牙菜有效成分含量成为有效途径。本课题组在对川西獐牙菜转录组测序之后,克隆了川西獐牙菜裂环烯醚萜途径两个关键酶(SmGPPS和SmIS)[13~14]。裂环马钱子苷合成酶是环烯醚萜合成途径最下游的一个关键酶,以SmSLS2为元件,通过合成生物学手段提高次生代谢产物具有重要意义。本研究成功从川西獐牙菜叶片中克隆了环烯醚萜生物合成关键酶基因SmSLS2,对其蛋白质进行功能预测,并构建原核表达载体,成功诱导表达了该蛋白,对进一步实现川西獐牙菜及类似以环烯醚萜化合物为主要活性成分植物的遗传改良、提高药材品质具有十分重要的理论意义和实践价值。
